超声WI技术评价维持性血液透析患者颈总动脉早期粥样硬化及心血管整体功能*
2018-05-03蔡璐尹立雪周婕徐芸
蔡璐 尹立雪 周婕 徐芸
(1.西南医科大学,四川 泸州 646000;2.四川省医学科学院·四川省人民医院心血管超声科·超声心脏电生理学与生物力学四川省重点实验室, 四川 成都 610072)
维持性血液透析(maintenance hemodialysis,MHD)是肾脏功能替代治疗的重要方式之一,其可改善终末期肾脏病患者的生存质量。有研究表明,维持性血液透析可通过多种因素导致动脉粥样硬化[1-6]。也有研究表明,维持性血液透析可导致左心室收缩功能障碍[7]。而透析相关性心血管疾病是MHD患者死亡的主要原因[1-2,4],因此对MHD患者的动脉硬化情况及左心室-颈总动脉整体功能的早期检测尤为重要。众所周知,颈动脉病变与主动脉、冠状动脉等血管病变高度相关,可作为观察全身血管病变的一个窗口。本研究拟采用颈总动脉WI技术评价MHD患者颈总动脉硬化情况,分析其早期动脉硬化所致左心室—颈总动脉血流动力学变化,以探讨WI技术对MHD患者颈总动脉早期粥样硬化评价的可行性及其临床应用价值,同时分析其WI相关参数与左心室—颈总动脉整体功能的关系。
1 资料与方法
1.1 研究对象 MHD组:选择在四川省人民医院血液透析中心进行维持性血液透析的终末期肾脏病患者30例,其中男性14例,女性16例;年龄35~60岁,平均(46.7±10.5)岁。所有入组者均进行维持性血液透析时间超过1年,每周规律透析三次,每次透析3~4小时。对照组:经常规体检,血压、肾功能、血脂、血糖、心电图和超声心动图检查均无异常发现的健康人群30例,其中男性15例,女性15例,年龄35~60岁,平均(44.6±11.2)岁。所有入选者均行双侧颈总动脉超声检查,排除颈总动脉已形成粥样斑块者,且入选者颈总动脉内中膜厚度≤9mm,见表1。

表1 MHD组和正常对照组入组标准Table 1 Criteria of MHD group and normal control group
1.2 仪器及方法 采用Aloka Prosound 70彩色多普勒超声诊断仪,血管超声探头频率5~13MHz,心脏超声探头频率为1~5MHz。
颈总动脉WI检查:①颈总动脉取样:检查前,受检者保持平静休息5分钟,测量肱动脉血压两次。受检者取平卧位,按顺序连接肢导联心电图后,受检者的头部偏向检查的对侧,于颈总动脉窦下2cm处,避开颈静脉,作为WI的检查部位。②测量颈总动脉内中膜厚度,见图1。启动WI功能,调节Beam Steer(B)键在20°,使颈总动脉前后壁能够同时清晰显示,在B/M模式下启动WI功能。将B模式取样线上的两个取样门分别置于颈总动脉的前壁、后壁中-外膜交界区,保证二维取样门与血管壁垂直;M型Sweep Speed设置为200mm/s,启动WI的血流显示键,保持声束与血流的夹角≤60°。③采集图像和数据:操作者屏气,实时描记颈总动脉血管壁运动轨迹,保持图像采集稳定,见图2。按Select键采样,描记的图形超过7个,确认符合WI图像描记要求后冻结图像进入分析步骤;再次测量血压后录入,系统将自动取3次血压的平均值,之后再挑选5个以上连续且相对平稳的波形存储用于分析,见图3、图4。
左心室功能测量:受检者左侧卧位,平静呼吸。取左心室长轴切面,分别获取左心室后壁及室间隔厚度、左心房前后径、左心室舒张期最大内径、左心室收缩期最小内径;取心脏四腔心及二腔心平面,以二维Simpson法测量计算左心室射血分数EF值。在心脏四腔心切面,测量舒张早期峰值速度E及舒张晚期峰值速度A,计算E/A;切换组织多普勒DTI模式,测量舒张早期峰值速度E’、舒张晚期峰值速度A’,计算E’/A’及E/E’。

图1 MHD组患者颈总动脉内中膜厚度
Figure1InternalmedialthicknessofarteriacarotiscommunisinMHDgroup
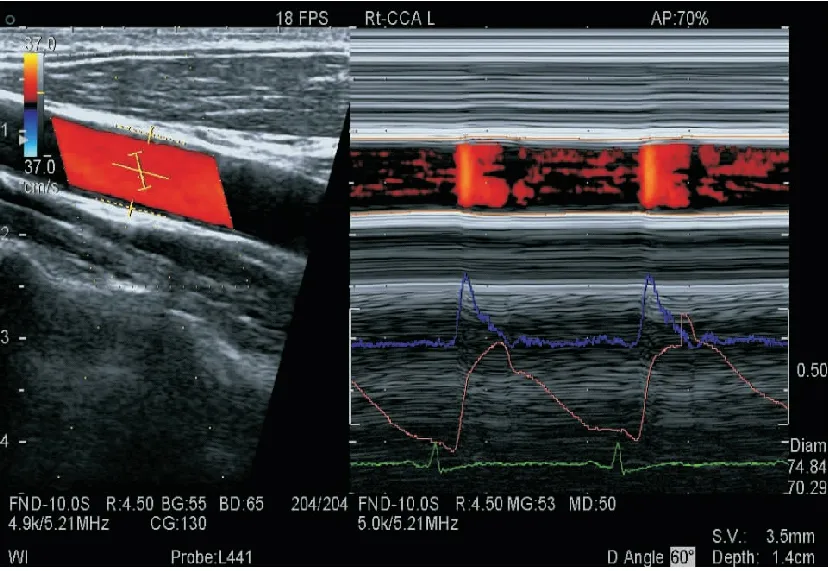
图2 实时描记MHD组患者颈总动脉血管壁运动轨迹
Figure2RealtimetracingthemovementofthevascularwallofthearteriacarotiscommunisintheMHDgroup
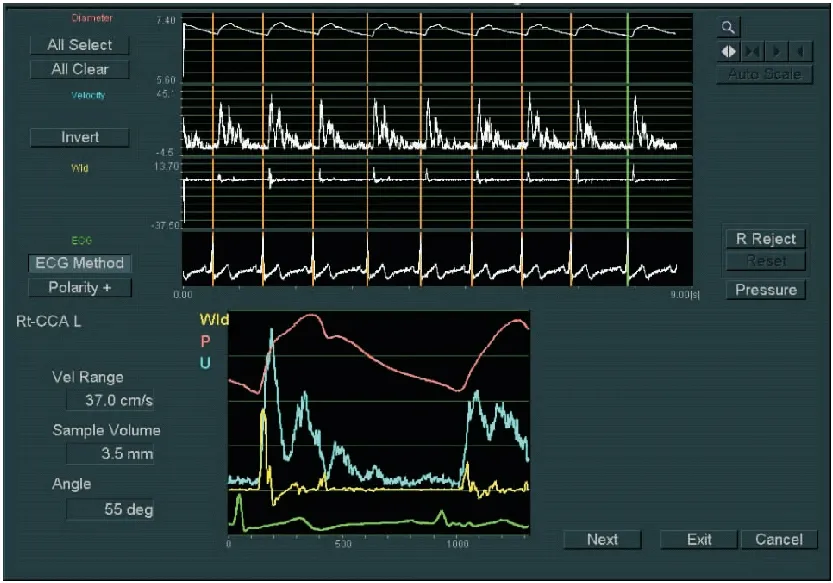
图3 Select键采样符合标准的WI图像Figure 3 Select key sampling of standard WI images
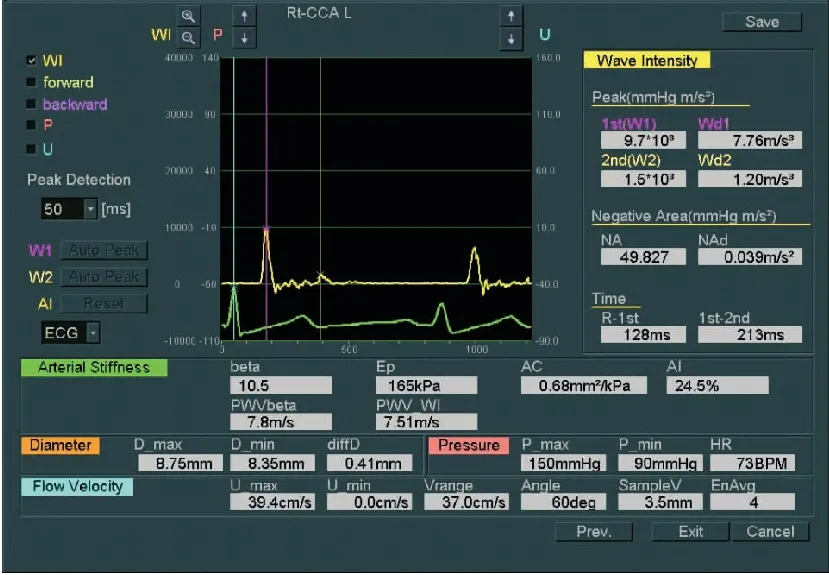
图4 MHD组患者WI系统分析后结果
Figure4ResultsofWIsystemanalysisoftheMHDgrouppatient
2 结果
经统计检验,两组间常规参数:患者的年龄、心率、收缩压、舒张压、双侧颈动脉内中膜厚度(MT)、LVEF、E/A,对照组的E’/A’、E/E’值符合正态分布、方差齐。WI参数:MHD组与对照组的W1、W2、AC、PWVβ、W1-W2符合正态分布、方差齐。对照组的PWVwi、β、EP、NA符合正态分布,MHD组的PWVwi、β、EP、NA不符合正态分布。
2.1 两组常规参数比较 两组间年龄、性别、心率比较差异无统计学意义(P>0.05);MHD组患者SBP、DBP较对照组高,差异有统计学意义(P<0.01);MHD组左心房前后径、左心室舒张期最大内径较对照组增大、室间隔厚度较对照组增厚,差异均有统计学意义(P<0.01)。两组颈总动脉内中膜厚度(IMT)均在正常范围内,但MHD组IMT较对照组增厚,差异有统计学意义(P<0.01)。两组间E’/A’及E/E’差异有统计学意义(P<0.01),而LVEF、E/A差异无统计学意义,见表2。
2.2 两组WI参数比较 MHD组W1、W2、W1-W2、PWVwi、β、EP、PWVβ均较对照组明显升高,(P<0.01),AC较对照组明显减低(P<0.01),差异均具有统计学意义,见表3 。
表2MHD组与正常对照组相关参数的统计学比较
Table2StatisticalcomparisonoftherelatedparametersintheMHDgroupandthenormalcontrolgroup
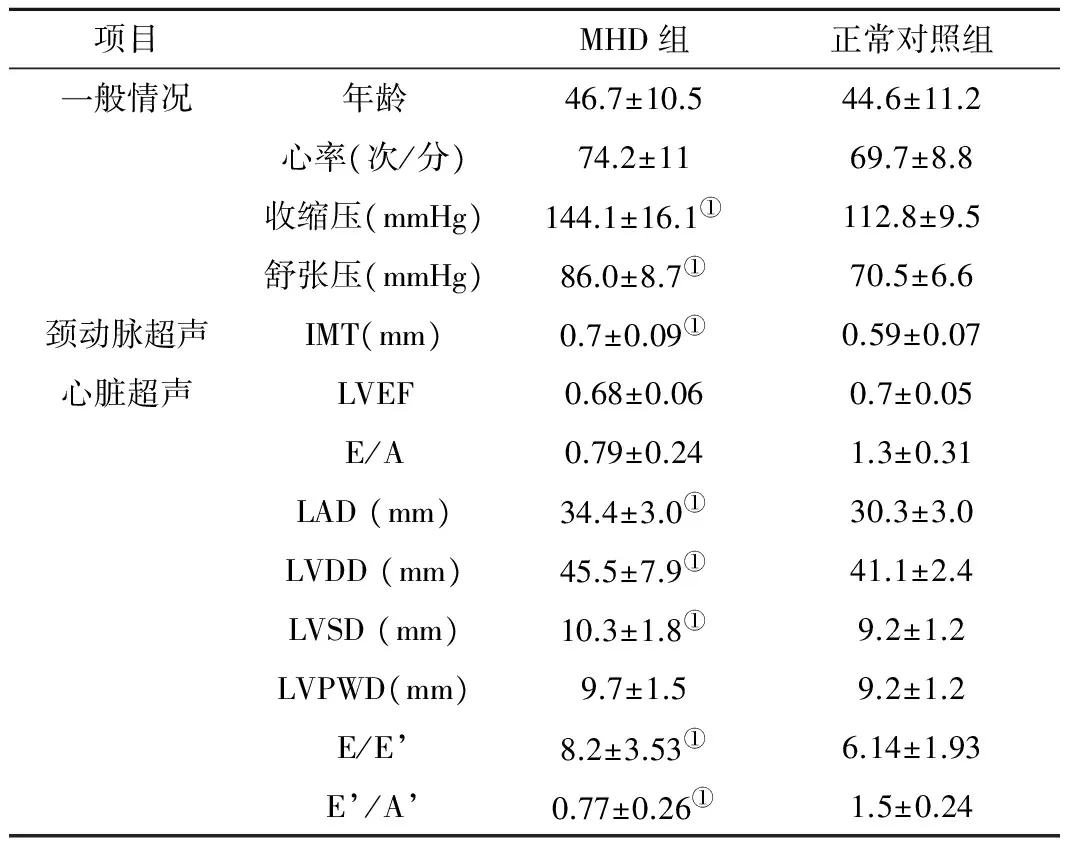
项目MHD组正常对照组一般情况年龄46.7±10.544.6±11.2心率(次/分)74.2±1169.7±8.8收缩压(mmHg)144.1±16.1①112.8±9.5舒张压(mmHg)86.0±8.7①70.5±6.6颈动脉超声IMT(mm)0.7±0.09①0.59±0.07心脏超声LVEF0.68±0.060.7±0.05E/A0.79±0.241.3±0.31LAD(mm)34.4±3.0①30.3±3.0LVDD(mm)45.5±7.9①41.1±2.4LVSD(mm)10.3±1.8①9.2±1.2LVPWD(mm)9.7±1.59.2±1.2E/E’8.2±3.53①6.14±1.93E’/A’0.77±0.26①1.5±0.24
注:与对照组比较,①P<0.01。IMT:颈动脉内中膜厚度;LVEF:左心室射血分数;LAD:左心房舒张期内径;LVDD:左心室舒张期内径;LVSD:左心室收缩期内径;LVPWD:左心室后壁厚度
表3MHD组与正常对照组相关参数的统计学比较
Table3StatisticalcomparisonoftherelatedparametersintheMHDgroupandthenormalcontrolgroup

项目MHD组正常对照组WI参数W1(mmHg·m/s3)11.18±6.99①7.74±3.71W2(mmHg·m/s3)2.50±0.73①1.56±1.07W1-W2(s)242.2±12.2①267.5±15.8NA(mmHg·m/s3)39.0331.65AC(mm2/kPa)0.78±0.29①0.92±0.35PWVβ(m/s)7.15±1.44①5.31±1.13PWVVwi(m/s)7.16①4.78±1.20β8.8①6.73±2.38EP(KPa)126①80±29.79
注:与对照组比较,①P<0.01。。w1:瞬时加速度波强;w2:瞬时减速度波强 w1-w2:w1到w2的时间;NA:负向波面积;AC:动脉顺应性;PWVβ:单点脉搏波传导速度;PWVwi:WI脉搏波传导速度;β:动脉弹性参数—颈动脉僵硬度;EP:血管的压力-应变弹性系数
2.3 两组WI参数的相关性分析 两组的W1值均与SBP水平呈正相关(r=0.32,P<0.01),与PWVβ值呈正相关(r=0.31,P<0.05);两组的w1-w2值与心率负相关(r=-0.54,P<0.01),见表4。
3 讨论
心血管疾病是MHD患者死亡的主要原因[1],而动脉硬化是导致其发生心血管疾病的重要危险因素[3,5]。现有研究发现,除高血压、糖尿病、高血脂等传统的危险因素之外,血液透析本身引起的一系列内外环境的变化也会导致血管内皮功能紊乱,最终形成动脉粥样硬化。同时,血液透析也会对左心室收缩功能造成影响[2-6]。因此,对MHD患者动脉硬化的早期检测,对其左心室—颈总动脉血流动力学状态以及颈总动脉早期粥样硬化对心血管整体功能的影响进行早期准确的评价,对MHD患者的治疗选择和评估预后有重要意义。
表4MHD组及对照组的WI参数相关性分析
Table4CorrelationanalysisofWIparametersinMHDgroupandnormalcontrolgroup

参数rPW1值与SBP032P<001W1值与PWVβ031P<005w1⁃w2值与心率⁃054P<001
超声已被广泛应用于评估动脉粥样硬化,通常包括对动脉血管结构和功能的评估。动脉粥样硬化主要病变在其血管的内膜层,传统的超声方法可以通过测量动脉内中膜厚度(IMT)从而从结构上来评价早期动脉硬化。但研究发现,IMT与年龄及血压水平有密切的关系,且IMT的测量值在正常范围的人群,可能其动脉血管已发生血流动力学的改变[8]。因此,使用IMT不能通过其动脉血管形态学的变化来反映血管功能学上的变化。既往研究表明使用回声跟踪(Echo-Tracking,ET)技术可以从功能学上对动脉粥样硬化进行早期检测[9-13]。然而ET技术仅限于对血管功能的评价,而缺乏对心血管系统整体评价的能力。
WI技术基于ET技术,通过检测循环系统中动脉血管内任意点的WI来评估心血管整体功能。WI波形由出现于收缩早期的正向W1波、收缩中期的反向波、收缩晚期的正向W2波构成,在此基础上,还可以显示W1-W2、β、EP、PWVβ、PWVwi、AC等值[14-18]。研究表明[15-20],正常人群颈动脉W1的大小与左心室的最大dP/dt相关,因此W1值主要与左心室的收缩功能相关;收缩晚期出现的W2主要与血压的下降和血流速度降低有关,其值的大小主要取决于收缩晚期到舒张早期的左心室功能状态。W1-W2与左心室的射血时间相关。β、AC分别代表动脉的僵硬度和顺应,EP为血管的压力-应变弹性系数,以上三个ET指标主要反映动脉血管本身的弹性功状态;而PWVβ为单点脉搏波传导速度、PWVwi为WI脉搏波传导速度,主要表示动脉血管的血流动力学情况。可见,通过WI技术获取的相关参数,不仅可以从功能上评价动脉血管硬化情况,还可以进一步评价其左心室-颈总动脉血流动力学状态,能够更为全面地反映其心血管系统的整体功能。
本研究MHD组和对照组对比,MHD组的内膜增厚,β、EP、PWVβ、PWVwi均较对照组明显升高(P<0.01);MHD组的AC较对照组明显减低(P<0.01)。出现这种结果的可能机制如下:对于进行维持性血液透析的终末期肾脏病患者,除外高血压(原发或继发)、贫血、继发性甲状旁腺功能亢进、脂代谢紊乱等对血管造成损害以外,血液透析本身也会导致一系列引起动脉硬化的危险因素[2-3],如营养不良-炎症-动脉粥样硬化(MIA)综合征、氧化应激、高同型半胱氨酸血症、细胞因子的异常表达等均会直接或间接的导致血管内皮功能的紊乱,造成血管内膜的损伤,引起血管的舒张功能障碍,从而导致动脉粥样硬化,甚至形成明显的斑块。因此,本研究中代表MHD组患者的血管弹性参数均明显下降,代表动脉硬化所致血流动力学改变的参数均明显升高。说明,在常规超声所测量的IMT基础上,通过超声WI技术,可以探测到MHD患者颈总动脉粥样硬化所导致的血管功能的早期变化,并且量化其血管功能的变化及其血流动力的改变。
本研究结果可见,MHD组与对照组比较,w1、w2均明显升高,w1-w2明显减低,差异均具有统计学意义。其中,W1值与SBP水平呈正相关(r=0.32,P<0.01);W1值与PWVβ呈正相关(r=0.31,P<0.05);MHD组经常规超声心动图所测量的EF值均在正常范围以内,且与对照组的EF值差异无统计学意义。结合其颈总动脉血管功能评估的结果,考虑原因为,MHD组患者存在早期的动脉粥样硬化,其心血管系统的血流动力学也相应的发生变化,因心脏射血的外周阻力增加,为克服外周阻力,心脏功能尚处于代偿阶段时,为使左心室射血分数在正常范围,左心室的收缩功能会代偿性增强,而相对的射血时间则会缩短,因此W1值较对照组增加,而W1-W2值较对照组减低。此外,W1-W2值与心率负相关,考虑与心率增快时左心室射血时间缩短有关。可见超声WI技术可反映MHD患者颈总动脉粥样硬化所导致的左心室-颈总动脉的血流动力学变化。
而本研究中,W2与常规超声心动图所测的左心室舒张功能各参数并没有明显相关性,与动脉弹性参数亦无明显相关性,其反映左心室舒张功能的价值有待于进一步研究,也有可能与本研究例数相对较少有关。
4 结论
超声WI技术可以在MHD患者颈总动脉出现粥样斑块前,全面量化评价其颈总动脉粥样硬化导致的动脉血管功能变化,并进一步反映MHD患者左心室-颈总动脉的血流动力学状态,以评价其心血管系统的整体功能。对MHD患者动脉粥样硬化的早期检测、心血管功能的综合评估,对临床早期干预、预防心血管系统并发症、改善MHD患者生活质量、提高MHD患者生存率均具有重要的意义。超声WI技术无创伤,检测的数据可以在机实时分析且操作便捷,无绝对禁忌症,临床应用前景较广。
【参考文献】
[1]Foley RN. Cardiac disease in chronic uremia: can it explain the reverse epidemiology of hypertension and survival in dialysis patients [J]. Seminars in Dialysis, 2010,17(4):275-278.
[2]Danielski M, Ikizler TA, Mcmonagle E,etal. Linkage of hypoalbuminemia, inflammation, and oxidative stress in patients receiving maintenance hemodialysis therapy[J]. American Journal of Kidney Diseases the Official Journal of the National Kidney Foundation, 2003, 42(2):286-294.
[3]Sato M, Ogawa T, Otsuka K,etal. Stiffness parameter as a predictor of the 4-year all-cause mortality of chronic hemodialysis patients[J]. Clinical & Experimental Nephrology, 2013, 17(2):268-274.
[4]Choi S J, Park M Y, Kim J K,etal. The 24-Month Changes in Body Fat Mass and Adipokines in Patients Starting Peritoneal Dialysis[J]. Peritoneal Dialysis International Journal of the International Society for Peritoneal Dialysis, 2017, 37(3):290.
[5]Guerin AP, Blacher J, Pannier B,etal. Impact of aortic stiffness attenuation on survival of patients in end-stage renal failure[J]. Circulation, 2001, 103(7):987.
[6]Yang L, Lin Y, Ye C,etal. Effects of peritoneal dialysis and hemodialysis on arterial stiffness compared with predialysis patients.[J]. Clinical Nephrology, 2011, 75(3):188.
[7]Assa S, Hummel YM, Voors AA,etal. Hemodialysis-induced regional left ventricular systolic dysfunction: prevalence, patient and dialysis treatment-related factors, and prognostic significance[J]. Clinical Journal of the American Society of Nephrology Cjasn, 2012, 7(10):1615.
[8]Kim GH, Youn HJ. Is Carotid Artery Ultrasound Still Useful Method for Evaluation of Atherosclerosis[J]. Korean Circulation Journal, 2017, 47(1):1-8.
[9]刘悦, 杨晓英, 王志宏. 血管回声跟踪技术评价血液透析患者血管内皮功能[J]. 中国超声医学杂志, 2008, 24(6):543-545.
[10] 张宏. ET及FMD技术对血液透析患者血管功能的研究[D]. 首都医科大学, 2012.
[11] Song Y, De-Zhao W, Hong-Xia Z,etal. Echo-tracking technology assessment of carotid artery stiffness in patients with coronary slow flow[J]. Ultrasound in Medicine & Biology, 2015, 41(1):72.
[12] Várady E, Feher E, Levai A,etal. Estimation of vessel age and early diagnose of atherosclerosis in progeria syndrome by using echo-tracking.[J]. Clinical Hemorheology & Microcirculation, 2010, 44(4):297-301.
[13] Yu ZX, Wang XZ, Guo RJ,etal. Comparison of ultrasound echo-tracking technology and pulse wave velocity for measuring carotid elasticity among hemodialysis patients[J]. Hemodialysis International International Symposium on Home Hemodialysis, 2012, 17(1):19.
[14] Sugawara M, Niki K, Ohte N,etal. Clinical usefulness of wave intensity analysis[J]. Medical & Biological Engineering & Computing, 2009, 47(2):197-206.
[15] Niki K, Sugawara M, Chang D,etal. A new noninvasive measurement system for wave intensity: evaluation of carotid arterial wave intensity and reproducibility.[J]. Heart & Vessels, 2002, 17(1):12-21.
[16] 张若冰, 杨娅, 李治安,等. 正常人颈动脉WI分析及其与左心室功能的关系[J]. 北京生物医学工程, 2010, 29(5):517-522.
[17] Bortel LMV, Backer TD, Segers P. Direct Measurement of Local Arterial Stiffness and Pulse Pressure[M]// Blood Pressure and Arterial Wall Mechanics in Cardiovascular Diseases. Springer London, 2014:23-35.
[18] Koh TW, Pepper JR, Desouza AC,etal. Analysis of wave reflections in the arterial system using wave intensity: a novel method for predicting the timing and amplitude of reflected waves.[J]. Heart & Vessels, 1998, 13(3):103.
[19] Ohte N, Narita H, Sugawara M,etal. Clinical usefulness of carotid arterial wave intensity in assessing left ventricular systolic and early diastolic performance[J]. Heart & Vessels, 2003, 18(3):107-111.
[20] Yu ZX, Wang XZ, Guo RJ,etal. Comparison of ultrasound echo-tracking technology and pulse wave velocity for measuring carotid elasticity among hemodialysis patients[J]. Hemodialysis International International Symposium on Home Hemodialysis, 2013, 17(1):19-23.
