血液净化对烧伤脓毒症患者血清炎性细胞因子的影响*
2018-05-03杨帆周伟刘薇赵坤郑梁张翔
杨帆 周伟 刘薇 赵坤 郑梁 张翔
(湖北医药学院太和医院整形烧伤科,湖北 十堰 442000)
烧伤是人体皮肤在高温液体、金属、高温气体等因素下导致的皮肤损害[1-2]。轻者5~7天创面可以自行进行恢复愈合,重者不仅皮下组织受到高温伤害,患者内脏器官、肌肉组织同样能受损[3]。根据患者烧伤的面积,可将烧伤程度分为轻度烧伤、中度烧伤、重度烧伤、特重烧伤。重度烧伤面积可达到皮肤总面积的30%~49%,由于人体抵御外界细菌、病毒的第一道防线破坏严重;重度烧伤或特重烧伤可引起患者出现严重烧伤并发症反应,如休克、感染。在皮肤创面极易感染细菌,患者常见皮肤深度烧伤后并发症为烧伤脓毒症[4-6]。脓毒症一般为单一种类细菌或多种类细菌感染,患者可临床症状可出现体温升高、中毒性心肌炎症或认知水平改变等现象,影响患者生活质量水平[7]。据文献报道,脓毒症病理机制主要是由于皮肤大面积损害后,患者机体免疫功能紊乱感染并发症,大量外界细菌病毒繁殖,侵犯人体正常组织[8-9]。治疗烧伤脓毒症目的在于及时有效清除患者体内炎症介质,并稳定患者机体内环境状态[10]。临床上针对烧伤脓毒症进行了一系列的治疗措施,其中包括常规创面清洁、抗感染治疗、消炎补液治疗、与免疫调节治疗[11-12]。随着近几年医学科技的发展与医疗仪器的不断更新,临床运用血液净化治疗清理患者血液中病毒因子,协助机体重建的免疫内功能稳定[13]。本文就我院经烧伤科收治的28例烧伤脓毒症患者进行了血液净化治疗研究,旨在观察血液净化治疗对烧伤脓毒症患者血清炎性细胞因子的影响。
1 对象与方法
1.1 研究对象 选取2013年1月~2014年12月入我院经烧伤科收治的烧伤患者28例。纳入标准:①患者年龄均≥18周岁;②患者无其他恶性肿瘤疾病;③烧伤脓毒症的患者均符合中国医师协会烧伤医师分会制定的《烧伤感染诊治指南》的诊断标准[14];④患者皮肤烧伤面积≥30%;⑤患者及患者家属均知情并签署了《治疗同意书》。排除标准:①存在严重脏器代谢障碍者,如肾衰竭、心衰竭;②未同意进行研究治疗者;③妊娠期妇女或哺乳期妇女;④存在明确药物过敏史者。符合研究标准的28例患者按照入院时间顺序,随机分为对照组与观察组。对照组14例,患者男性9例,女性5例,年龄18~63岁,平均年龄(41.78±9.67)岁。观察组14例,男性10例,女性4例,年龄18~65岁,平均年龄(43.59±10.23)岁。两组患者治疗前临床资料比较差异均无统计学意义(P>0.05),见表1。

表1 两组患者临床资料比较Table 1 Comparison of clinical data between the two groups
1.2 治疗方法 对照组14例患者进行常规烧伤治疗,包括抗生素消炎治疗、免疫治疗、营养支持、抗感染治疗等,对患者皮肤创面进行及时清洁换药。观察组14例患者在对照组患者常规治疗基础上加以血液净化治疗。血液净化设备采用金宝床旁血滤机PRISMAFLEX进行血液净化。透析标准:透析液钠离子浓度恒定,为135mmol/L,透析液温度为37℃,透析过程中两者始终不变。血液透析导管穿刺根据患者病情选择,一般选择股静脉或锁骨下静脉,左右侧均可[15]。患者细菌血培养呈阳性后,根据患者个人情况在0~2d后进行血液净化,净化模式:采用连续性静脉-静脉血液滤过模式(CVVHDF),滤膜面积设置:1.2m2,按照患者体重设置过滤量。每小时透析流量为30~45ml/h/kg,并对患者进行预充液与常规抗凝治疗,脱水量:50~120ml/h,预充液配置:使用3000ml的NaCl(0.9%)注射液与25000IU肝素注射液进行配置。肝素用量依据患者凝血功能情况进行调整,以维持活化部分凝血酶原时间(activated partial thromboplastin time ,APTT)在80s范围里为最佳,适量调整血液净化的参数设置。置换液:使用上海长征富民金山制药有限公司生产的血液滤过置换液,国药准字H10940220,规格1000ml,置换液流量控制在35~45ml/h/kg。
1.3 观察指标 记录两组患者治疗前1d与进行治疗后24d时、48h时体征指数,包括心率、血压、体温、血气分析等。检测两组患者不同治疗时期血液中WBC、Lac、Na、PCT、PaO2/FiO2、BUN、Scr 及炎症因子(TNF-α、IL-6、IL-8)的浓度水平变化。
1.4 检验方法 Lac及氧合指数分析使用全自动血气分析仪进行检测;两组患者在治疗前1d、治疗后24d、48h时采取患者血外周血液3~5ml送至我院检验科,对患者 WBC计数、Na、BUN、Scr、PCT进行水平浓度检测;血液标本进行离心机离心5min处理后,取出患者血浆,用于检测患者炎症因子(TNF-α、IL-6、IL-8)的浓度水平变化。

2 结果
2.1 两组患者氧合指数(PaO2/FiO2)在各时间点的数值变化 两组患者治疗前氧合指数比较差异无统计学意义(P>0.05);观察组治疗后24、48h较治疗前1d,氧合指数均明显升高(P<0.05),对照组较治疗前无明显差异(P>0.05)。在同一治疗时间点中,观察组氧合指数水平优于对照组(P<0.05),见表2。
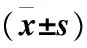
表 2 两组患者氧合指数(PaO2/FiO2)各时间点的数值变化Table 2 The oxygenation index (PaO2 / FiO2) at each time point
注:为组内与治疗前相比较,①P<0.05;两组间在同一治疗时间点相比较,②P<0.05。两组氧合指数交互作用:F=13.01,P<0.01;时间主效应:F=18.56,P>0.05;处理主效应:F=8.47,P<0.01
2.2 两组患者乳酸(Lac)在各时间点的数值变化 两组患者治疗前1d乳酸水平无比较差异(P>0.05);对照组治疗后24、48h与治疗前乳酸水平相比均无统计学意义(P>0.05);观察组在治疗后24h乳酸水平呈下降趋势,至治疗后48h乳酸水平降至平均2.08mmol/L,观察组治疗后24h、48h乳酸水平与治疗前相比具有差异(P<0.05),见表3。
2.3 两组患者血清肌酐(Scr)与尿素氮(BUN)在各时间点的数值变化 观察组患者在治疗后血清肌酐浓度水平均呈现下降趋势(P<0.05),同一时间点观察组血清肌酐水平较对照组下降幅度更显著(P<0.05或P<0.001);对照组患者治疗后各时间点的BUN水平与治疗前相比差异均无统计学意义(P>0.05),观察组组内治疗后各时间点BUN水平较治疗前明显下降(P<0.05),见表4。
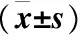
表3 两组患者乳酸(Lac)在各时间点的数值变化
注:为组内与治疗前相比较,①P<0.05;两组间在同一治疗时间点相比较,②P<0.05。乳酸时间因素主效应:F=15.04,P<0.01;处理主效应:F=6.01,P<0.01;两组交互作用:F=6.48,P<0.01
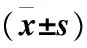
表4 两组患者血清肌酐(Scr)与尿素氮(BUN)在各时间点的数值变化Table 4 The change of serum creatinine (Scr) and urea nitrogen (BUN) in the two groups at each time point
注:为组内与治疗前相比较,①P<0.05;两组间在同一治疗时间点相比较,②P<0.05。Scr时间因素主效应:F=0.61,P<0.05;处理因素主效应:F=1.75,P<0.05;交互作用:F=1.81,P<0.05;BUN时间因素主效应:F=2.21,P<0.05;处理因素主效应:F=1.34,P<0.05;交互作用:F=1.41,P<0.05
2.4 两组患者白细胞(WBC)在各时间点的数值变化 对照组患者治疗后WBC水平呈升高趋势,组内比较差异无统计学意义(P>0.05);观察组治疗后WBC计数呈下降趋势,组内比较差异具有统计学意义(P<0.05);两组间治疗后同一治疗时间点WBC计数比较差异具有统计学意义(P<0.05),见表5。
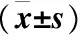
Table5Thechangeofleukocyteinthetwogroupsofpatientsatdifferenttimepoints

治疗时间WBC(×109/L)对照组(n=14)观察组(n=14)tP治疗前1d1401±4011461±37804070687治疗后24h1601±5041211±204①②2683<005治疗后48h1741±5141126±311①②3830<0001
注:为组内与治疗前相比较,①P<0.05; 两组间在同一治疗时间点相比较,②P<0.05。WBC时间主效应:F=2.84,P>0.05;两组相互作用:F=11.08,P<0.01;处理因素主效应:F=8.14,P<0.01
2.5 两组患者血清钠离子(Na+)在各时间点的数值变化 观察组治疗后各治疗时间点较治疗前Na+浓度均有下降(P<0.05);对照组治疗后组内比较差异均无统计学意义(P>0.05);两组间治疗后各治疗时间点比较观察组Na+浓度下降幅度更显著(P<0.05),见表6。
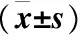
Table6Thechangeofserumsodiuminthetwogroupsofpatientsateachtimepoint

治疗时间Na+(mmol/L)对照组(n=14)观察组(n=14)tP治疗前1d15424±42615678±40916090119治疗后24h15241±37814522±517①②4200<0001治疗后48h15641±49614018±529①②8374<001
注:为组内与治疗前相比较,①P<0.05;两组间在同一治疗时间点相比较,②P<0.05。Na+时间主效应:F=30.15,P<0.05;两组相互作用:F=24.14,P<0.05;处理因素主效应:F=5.06,P<0.05
2.6 两组患者治疗前后降钙素原(PCT)的表达水平比较 观察组患者在治疗后PCT表达水平呈下降的趋势(P<0.05);与对照组同一时间点相比,观察组PCT表达水平低于对照组(P<0.001);对照组组内PCT表达水平比较差异无统计意义(P>0.05),见表7。
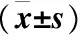
Table7ComparisonoftheexpressionlevelofPCTinthetwogroupsbeforeandaftertreatment

治疗时间PCT(mmol/L)对照组(n=14)观察组(n=14)tP治疗前1d1217±2511307±23409810335治疗后24h1278±210814±194①②6072<0001治疗后48h1158±248601±117①②7600<0001
注:为组内与治疗前相比较,①P<0.05; 两组间在同一治疗时间点相比较,②P<0.05。PCT时间主效应:F=13.11,P<0.01;两组相互作用:F=22.13,P<0.01;处理因素主效应:F=24.06,P<0.01
2.7 两组患者治疗前后血清炎症因子表达情况 对照组治疗后TNF-a、IL-6与IL-8的表达水平无明显差异(P>0.05);观察组治疗后24h、48h的TNF-a、IL-6与IL-8的表达水平均显著下降,组内与治疗前相比差异具有统计学意义(P<0.05);两组间治疗后各时间点TNF-a、IL-6与IL-8的表达水平比较差异具有统计学意义(P<0.05),见表8。
3 讨论
血液净化临床中又称其为透析;其主要是将患者血液通过导管导出体外,经过医疗设备对人体内导出血管进行净化、纠正水电解质平衡、清除致病菌及病毒的一种治疗方式[16-18]。血液透析设备是与人体血液进行物质交换的场所,在患者进行股静脉、颈内静脉或锁骨下静脉建立血管通道后,开始进行血液净化[19-20]。血液透析机器可对透析液中的进行血液流量、脱水量等进行调节控制,根据患者自身病情及状态可进行不同时间短的透析,主要避免患者溶质水平及水分水平处于波动状态,透析方式其一为日间短透析,其二为夜间长时间透析。需要进行血液透析的疾病包括肾衰竭、尿毒症等[21-22]。烧伤脓毒症患者由于皮肤大面积受损,细菌病毒易侵入人体内出现脓毒症(systemic inflammatory response syndrome,SIRS)。SIRS在人体内存在细菌或感染区域,根据SIRS严重程度的不同,患者表现出来的症状不尽相同,严重SIRS患者可以发生器官功能障碍,一定程度上影响了患者的生命[23]。烧伤脓毒症的根本发病机制与免疫功能、炎症介质、病原体感染及毒素异常表达有关系,其中炎性介质会引起患者全身各大系统及器官的广泛损伤,脓毒症病情发展凶险,患者病死率高,及时对患者病情进行控制治疗能有利地减低患者病死率[24-25]。
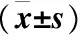
表8 两组患者治疗前后血清炎症因子表达情况
注:为组内与治疗前相比较,①P<0.05; 两组间在同一治疗时间点相比较,②P<0.05。IL-6处理因素主效应:F=621.49,P<0.01;时间因素主效应:F=103.17,P<0.01;两组相互作用:F=875.36,P<0.01;IL-8处理因素主效应:F=906.48,P<0.01;时间因素主效应:F=9.27,P<0.01;两组相互作用:F=975.36,P<0.01;TNF-a处理因素主效应:F=131.05,P<0.01;时间因素主效应:F=8.46,P<0.01;两组相互作用:F=194.41,P<0.01
本文对28例烧伤脓毒症患者进行血液净化研究分析,对照组使用常规治疗后PaO2/FiO2并无明显变化,氧合指数是测量人体内器官组织中氧气含量的指标之一,当患者PaO2/FiO2水平下降,PaO2/FiO2<300mmhg可提示患者存在肺呼吸功能障碍。观察组氧合指数水平在治疗后均呈现上升状态(P<0.05),表明血液净化治疗对烧伤脓毒症患者可提高PaO2/FiO2水平。血乳酸是人体内糖代谢的中间产物,其主要来源于由脑组织、肌肉组织内,在人体出现病理症状时,脑组织及横纹肌供养不足,体内乳酸含量升高[26]。乳酸的水平可评估患者潜在的异常疾病。对照组治疗前后差异无统计学意义(P>0.05),观察组在治疗后24h乳酸水平呈下降趋势,至治疗后48h乳酸水平降至平均2.08mmol/L,且观察组血清Na+浓度较对照组下降幅度更显著(P<0.05)。临床中烧伤脓毒症患者内环境紊乱现象出现机率高,乳酸水平与血清钠的浓度升高引发高钠血症、高乳酸血症,普通抗感染及消炎治疗很难改善患者内环境状态,血液透析中控制合理的血液流速及含氧量,对降低烧伤脓血症患者乳酸水平效果显著,控制、稳定调节内环境达到稳态,且乳酸水平的下降减低了患者出现乳酸中毒情况。血清肌酐与尿素氮浓度水平是肾脏功能的重要指标值之一,133umol/L的血清肌酐即可评估患者为炎症损伤期[27],患者使用血液净化后,血清肌酐浓度、BUN水平均呈现下降趋势(P<0.05),而对照组与治疗前血清肌酐浓度、BUN水平并无明显差异(P>0.05),血清肌酐的浓度升高,提示肾小球率过滤能力下降,患者代谢能力障碍易致使肾脏损伤[28]。血清钠在人体内的生理功能是维持电解质、酸碱平衡,观察组患者治疗后Na+浓度均有下降(P<0.05),表明患者体内电解质、酸碱物质趋于恢复平稳。对比两组炎性因子水平结果,其PCT水平表达水平低于对照组(P<0.001),PCT在一定程度中反应了患者炎症反应的表达程度,PCT的升高会导致休克与MODS,控制PCT的表达水平是治疗烧伤脓毒症的重要措施之一。使用血液进化治疗的患者的TNF-a、IL-6与IL-8的表达水平均较常规治疗患者低(P<0.05),IL-6与IL-8是炎症反应刺激下的产物,其表达水平的降低表明炎性反应,抑制诱导恶性病质。其使用血液净化的患者WBC计数在治疗后均呈下降趋势(P<0.05),血液净化清除了患者血液中一定比例的炎性因子,IL-6的降低避免了烧伤脓毒症患者出现诱导急性期反应蛋白的合成,减低炎性级联反应,在根源中有效改善了脓毒症患者病因。
4 结论
烧伤脓毒症患者在常规治疗的基础上进行血液净化治疗,可有效清除患者体内炎症介质因子,改善烧伤脓毒症患者的脏器功能,维持机体内环境平衡,是治疗烧伤脓毒症的一种有效方法,可在临床推广运用。
【参考文献】
[1]巴特, 周彪, 王凌峰,等. 连续性血液净化治疗在重度烧伤脓毒症患者中的临床应用[J]. 中华损伤与修复杂志:电子版, 2011, 6(2):43-46.
[2]胡高中, 彭毅志, 王凡,等. 血液净化对烧伤脓毒症患者的作用[J]. 中华烧伤杂志, 2014, 30(3):213-218.
[3]Vught LAV, Endeman H, Meijvis SC,etal. The effect of age on the systemic inflammatory response in patients with community-acquired pneumonia[J]. Clinical Microbiology & Infection, 2014, 20(11):1183-1188.
[4]杨鑫,孙启涛.中西医结合治疗烧伤脓毒症的疗效观察[J]. 创伤外科杂志, 2016,17(1):50-52.
[5]李朝晖, 钟馨, 何桂芳,等. 连续性血液净化对严重脓毒症患者血清IL-18、sICAM-1动态变化的影响[J]. 中国中西医结合肾病杂志, 2013, 14(9):815-816.
[6]贾凤玉, 任红旗, 龚德华,等. 连续性血液净化治疗在重度烧伤患者救治中的应用[J]. 肾脏病与透析肾移植杂志, 2016, 25(1):30-34.
[7]Liang Y, Ling J, Wen Z,etal. IL-37 inhibits the production of inflammatory cytokines in peripheral blood mononuclear cells of patients with systemic lupus erythematosus: its correlation with disease activity[J]. Journal of Translational Medicine, 2014, 12(1):1-8.
[8]温前宽, 李彦, 杨建萍,等. 严重脓毒症患者炎症因子的动态变化及预后意义[J]. 中华急诊医学杂志, 2015, 24(7):314-346.
[9]陈晓梅. 胰岛素强化治疗对脓毒症患者血清非特异性炎性因子表达水平及预后的影响[J]. 检验医学与临床, 2014,14(4):471-472.
[10] 暴向阳, 朱兵, 刘毅,等. 流式微球阵列法检测烟雾病患者血清血管生成因子和炎性细胞因子水平[J]. 国际脑血管病杂志, 2016, 24(2):504-506.
[11] Jian L, Fa X, Zhou Z,etal. Functional analysis of UMOD gene and its effect on inflammatory cytokines in serum of essential hypertension patients.[J]. International Journal of Clinical & Experimental Pathology, 2015, 8(9):11356-11363.
[12] 陈偲, 杨敬平, 银雪,等. 脓毒症患者血清中TLR-4、TREM-1、sCD14和IL-18的变化[J]. 临床肺科杂志, 2014,18(11):1956-1959.
[13] 付素珍, 孙杰, 董云,等. 连续性血液净化对脓毒症患者免疫功能及预后的影响[J]. 实用医学杂志, 2014,42(17):2731-2734.
[14] Papakonstantinou VD, Chini M, Mangafas N,etal. In vivo, effect of two first-line ART regimens on inflammatory mediators in male HIV patients[J]. Lipids in Health & Disease, 2014, 13(1):1-9.
[15] 陈勉. 高容量血液滤过对严重脓毒症炎症因子及血流动力学的影响[J]. 中华全科医学, 2014, 12(2):318-319.
[16] 石瑞平, 郭树霞, 秦娜,等. 恶性血液病患者医院感染病原菌对血清炎性因子的影响研究[J]. 中华医院感染学杂志, 2016,25(3):599-601.
[17] 薛庆亮, 贾金虎, 刘杜姣. 脓毒症与炎性因子的研究进展[J]. 临床肺科杂志, 2015,19(2):335-336.
[18] 王洪亮, 王敏敏, 赵静. 血液净化疗法在脓毒症中的应用[J]. 中国血液净化, 2014, 13(4):329-332.
[19] 陈凯. 严重烧伤脓毒症患者血清TNF-α、IL-6、IL-10、PLA2的变化及器官功能损害状况分析[J]. 重庆医学, 2014,42(8):937-940.
[20] 左建娇, 闫慧明, 多慧玲,等. 慢性肾功能衰竭抗生素脑病临床分析[J]. 临床误诊误治, 2015,30(5):65-67.
[21] 左建娇. 血液透析患者应用低分子肝素导致肺出血原因分析[J]. 解放军医药杂志, 2015, 27(6):76-77.
[22] 张宏, 李新伦, 李红霞,等. 低通量血液透析对蛋白结合类毒素清除效果的研究[J]. 空军医学杂志, 2016, 32(2):333-335.
[23] Gong BQ. Effect of Danzhi decoction on expression of angiogenesis factors in patients with sequelae of pelvic inflammatory disease[J]. Asian Pacific Journal of Tropical Medicine, 2014, 7(12):985-990.
[24] 计鹏, 胡大海, 杨晨,等. 重度烧伤并发脓毒症64例血清 T N F-α、IL-1β、IL-6水平测定及其相关性分析[J]. 陕西医学杂志, 2016, 45(9):432-425.
[25] 郭万里, 雷晋, 段鹏,等. 严重烧伤早期间歇性血液滤过联合血液灌流防治脓毒症的临床研究[J]. 中华烧伤杂志, 2015, 31(4):248-250.
[26] Cheng X, Fan K, Xie L,etal. Evaluation of optimized continuous venovenous hemodiafiltration therapy efficiency in severe burn patients with sepsis[J]. Burns & Trauma, 2014, 2(3):125-129.
[27] 刘乃全, 孙广萍. 尿毒清联合复方α-酮酸片对维持性血液透析患者钙磷代谢的影响[J]. 解放军预防医学杂志, 2016, 34(2):172-174.
[28] 刘杜姣, 贾金虎, 薛庆亮. 炎性因子浓度与脓毒症患者病情程度量化关系的关联性分析[J]. 临床军医杂志, 2014, 42(12):1215-1217.
