不同浓度辣椒素对缺氧复氧后A549细胞凋亡的影响*
2018-05-03曾结婷王儒蓉李雪寒徐弋成燕
曾结婷 王儒蓉 李雪寒 徐弋 成燕
(1.四川大学华西医院麻醉科,四川 成都610041;2.重庆医科大学附属第一医院麻醉科,重庆 400016)
辣椒素(capsaicin,cap)是辣椒植物属的主要刺鼻成分,是红辣椒的主要活性成分,可以对包括人类在内的哺乳类动物产生刺激性,而且在口腔中产生灼烧感[1]。它是一种香草素受体激动剂,可以激活瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)。辣椒素具有缓解疼痛[2]、抗氧化、抗炎和抗癌作用等特性[3],而且辣椒素还在调节肥胖方面也起着重要作用[4]。近年研究发现辣椒素对内脏器官的缺血再灌注损伤具有保护作用,包括心脏[5]、肾脏[6]、脑[7]等。我们以前的研究发现,辣椒素可以减轻大鼠的肺缺血再灌注损伤,其机制与增加肺内神经肽类物质的释放以及上调肺和脑干的TRPV1和神经肽类物质受体,从而缓解氧化应激和炎症反应有关[8]。肺缺血再灌注损伤可发生于心肺复苏术、肺移植、体外循环、肺动脉栓塞、肺的袖式切除、创伤等情况[9-10],其主要损伤机制并不完全清楚,主要包括氧化应激,炎症反应,细胞凋亡,细胞内钙超载和神经源性炎症等途径[11-12]。细胞凋亡是缺血再灌注损伤的机制之一;肺缺血再灌注损伤会引起肺泡上皮细胞、肺血管内皮细胞以及支气上皮细胞等发生凋亡。然而,目前仍然不清楚辣椒素如何影响肺缺血再灌注引起的肺内细胞凋亡。
肺泡Ⅱ型上皮细胞被认为是肺泡上皮的干细胞,肺泡Ⅱ型上皮细胞的增殖和分化不仅可以修复肺泡的正常结构,更能有效地进行功能上的恢复[13]。有文献报道称,辣椒素的使用可以降低大鼠海马角质层神经元缺氧复氧后的细胞凋亡[14];25~75μM辣椒素可以明显减少谷氨酸诱导的皮质神经元凋亡,拮抗谷氨酸盐对皮层神经元细胞的损伤作用[15]。本实验拟建立离体A549细胞缺氧复氧模型,模拟在体肺缺血缺氧过程,探讨不同浓度辣椒素对A549细胞缺氧复氧后增殖活力和细胞凋亡的影响。
1 材料及方法
1.1 主要试剂及细胞 天然辣椒素及合成辣椒素标准品均购自美国sigma公司,CCK8试剂盒、Annexin-V-FITC/PI(荧光探针FITC标记的膜联蛋白-5/碘化丙啶)双染细胞凋亡检测试剂盒均购自Keygen公司。A549细胞由四川大学生物治疗国家重点实验室惠赠,于37℃、5%CO2的普通培养箱中在含10% FBS的 DMEM培养基中培养,取对数生长期的细胞用于实验。
1.2 辣椒素的配制 用DMSO(Sigma公司)分别溶解天然辣椒素粉末和合成辣椒素标准品粉末,配成溶液,置于-20℃冰箱保存。临用时,以DMEM稀释天然辣椒素和合成辣椒素标准品成各种所需浓度(0.25μM,2.5μM,25μM,250μM,2500μM)。
1.3 A549细胞的培养与鉴定 A549细胞在含10% FBS的DMEM培养基中培养。取长满培养瓶瓶底、生长状态良好的A549细胞,弃掉培养基,加入适量PBS洗涤3遍,加入适量胰酶至细胞变圆,加入含胎牛血清培养基终止胰酶消化,吹打成细胞悬液,收集于EP管中,后1500r/min离心10分钟,弃掉上清液,用4℃预冷PBS洗涤细胞3次,离心,去上清;用0.5%戊二醛固定,置于4℃冰箱中静置10min;再10000r/min离心15分钟,弃掉上清液,用3%戊二醛固定后送透射电子显微镜观察(四川大学电镜室)。
1.4 实验分组 将培养的A549细胞随机分为7组:正常培养细胞组(control组)、缺氧36小时复氧24小时组(HR组)、在缺氧前用5个不同浓度:0.25μMcap,2.5μMcap,25μMcap,250μMcap,2500μMcap处理,分别为cap0.25+HR组、cap2.5+HR组、cap25+HR组、cap250+HR组、cap2500+HR组。
Control组是正常培养的细胞,未经任何处理;HR 组是用含100U/mL青霉素-链霉素混合液的无糖Hank’s缓冲液,于37℃、1%O2、94%N2、5%CO2三气培养箱中缺氧培养36小时后,然后放置于不含FBS的DMEM在37℃、5%CO2普通培养箱中复氧培养24小时;5个不同浓度辣椒素处理的cap+HR组在缺氧前加入0.25μM,2.5μM,25μM,250μM,2500μM辣椒素,其他处理与HR组相同。
各组细胞在培养后用倒置显微镜进行细胞形态学观察。HR组、cap0.25+HR组、cap2.5+HR组、cap25+HR组、cap250+HR组、cap2500+HR组用CCK-8试剂盒检测细胞增殖活力。Control组、HR组、cap25+HR组和cap250+HR组用Annexin-V-FITC/PI双染色法后用流式细胞仪技术检测细胞凋亡情况。
1.5 CCK8试剂盒检测细胞增殖活力 本实验采用CCK-8试剂盒(Keygen)进行定量测定评估A549缺氧复氧细胞增殖活力。以(1~5)×105/孔接种于96孔板中,将培养板放在37℃、5%CO2普通培养箱预培养24小时;在缺氧前加入0.25μM,2.5μM,25μM,250μM,2500μM辣椒素,其他处理与HR组相同;复氧结束后向每孔加入10μL 10%CCK8溶液,在37℃下孵育2小时;使用酶标仪(EPOCH2,Bio Tek)测定450nm处的吸光度。每个六个平行实验样品用于评估细胞活力。
1.6 流式细胞仪检测细胞凋亡 本实验采用Annexin-V-FITC/PI双染细胞凋亡检测试剂盒检测细胞凋亡情况。将control组、HR组、cap25+HR组、cap250+HR组A549细胞按照Annexin-V-FITC/PI双染细胞凋亡检测试剂盒说明书处理,收集上清液,用无EDTA-胰蛋白酶消化液消化收集贴壁细胞,加入上述上清液中,2000r/min离心3分钟,弃掉上清液,PBS洗涤2次,1200r/min离心3分钟,弃掉上清,加入300μL结合缓冲液,悬浮细胞,加入3μL Annexin-V-FITC混匀后,再加入3μL PI(Propidum Iodide,碘化丙啶)混匀,室温避光反应5分钟,在1小时内采用流式细胞仪(Navios)检测细胞凋亡的百分率。
2 结果
2.1 A549细胞的鉴定 在透射电镜下观察,A549细胞表面有短小微绒毛,细胞核较大,核形不规则,核膜皱褶较多,核仁肥大,胞浆内含有多个吞饮小泡,见图1A。另外,在胞浆内可见多个大小不一的圆形或卵圆形的年轮状板层小体,其内容物呈螺纹状排列,见图1B。这是肺泡Ⅱ型上皮细胞的特征性结构,可以认为A549细胞具有肺泡Ⅱ型上皮细胞特性。
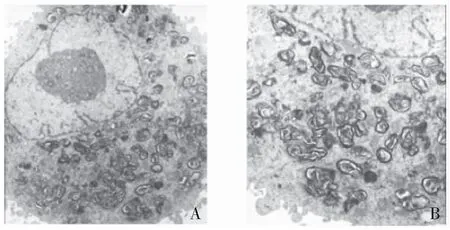
图1 电子显微镜下A549细胞形态
Figure1ThemorphologyofA549cellsunderelectronmicroscope
注:A.A549细胞表面有短小微绒毛,细胞核明显,胞浆内含多个吞饮小泡;B.胞浆内多个内呈螺纹状排列的板层小体
2.2 辣椒素对缺氧复氧A549细胞形态学的影响 倒置显微镜下见control组细胞贴壁连接成片,平展呈多边形,上清液干净,见图2A;HR 组细胞形态变圆,贴壁细胞数量减少,上清液中有较多的白色颗粒状脱落细胞,见图2B;cap25+HR组细胞贴壁成小片状,细胞呈多边形,贴壁细胞多于HR组,白色颗粒状脱落细胞少于HR组,见图2C;cap250+HR组细胞贴壁成小片状,呈多边形,贴壁细胞较HR组明显增多,白色颗粒状脱落细胞较HR组明显减少,见图2D。
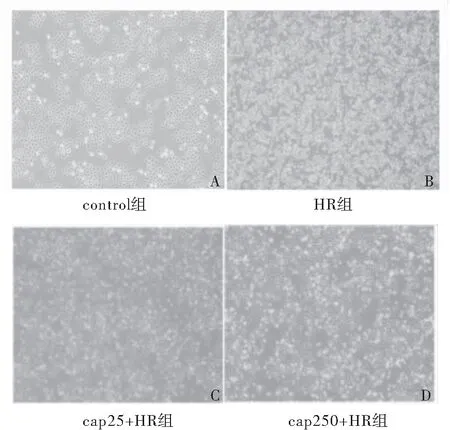
图2 倒置显微镜下各组的细胞形态 (×40)
Figure2Cellmorphologyofeachgroupunderinvertedmicroscope
注:A.control组细胞贴壁成片,上清液干净;B.HR组细胞呈近圆形,贴壁细胞较少,有较多白色颗粒状脱落细胞;C、D.cap25+HR组及cap250+HR组细胞贴壁成小片状,白色颗粒状脱落细胞较少
2.3 辣椒素对A549细胞缺氧复氧后增殖活力的影响 缺氧前加入0.25μM,2.5μM,25μM,250μM,2500μM天然辣椒素或者合成辣椒素标准品后,缺氧36小时复氧24小时,用CCK8试剂盒检测A549细胞增殖活力。使用天然辣椒素处理A549细胞后,与HR组(细胞活力为1)比较,使用不同浓度天然辣椒素的各组的细胞增殖活力结果见表1。低浓度(2.5μM,25μM,250μM)天然辣椒素可一定程度促进缺氧复氧A549细胞增殖,但是高浓度(2500μM)天然辣椒素抑制细胞增殖。
使用合成辣椒素标准品处理A549细胞后,与HR组(细胞活力为1)比较,使用不同浓度合成辣椒素标准品的各组的细胞增殖活力结果如表1所示。合成辣椒素标准品对于A549细胞增殖活力的影响与天然辣椒素呈现相同的结果,低浓度(2.5μM,25μM,250μM)合成辣椒素标准品可一定程度促进缺氧复氧A549细胞增殖,高浓度(2500μM)合成辣椒素标准品抑制细胞增殖。
在cap0.25+HR组、cap2.5+HR组、cap25+HR组、cap250+HR组、cap2500+HR组,天然辣椒素和合成辣椒素标准品对A549细胞增殖活力影响比较差异无统计学意义(P>0.05)。
2.4 辣椒素对A549缺氧复氧后凋亡率的影响 缺氧前加入25μM、250μM天然辣椒素,缺氧复氧后流式细胞仪检测A549细胞凋亡示意图见图3,表2。与control组比较,HR组、cap25+HR组、cap250+HR组缺氧复氧后细胞凋亡率明显升高(P<0.05)。与HR组比较,cap25+HR组和cap250+HR组细胞凋亡率明显下降(P<0.05),分别减少约7.8%(25μM)和13.53%(250μM),即缺氧前使用25μM和250μM辣椒素处理A549细胞均可降低缺氧复氧引起的凋亡,且高浓度(250μM)保护作用更明显。
3 讨论
细胞凋亡又称为细胞程序性死亡,在形态学上表现为核固缩、染色体浓集和 DNA片段化至寡核苷酸化片段,但是细胞膜及细胞内细胞器保持相对完整[16]。
Table1Theviabilityofhypoxia-reoxygenationA549cellstreatedwithdifferentconcentrationsofnaturalandsyntheticcapsaicin

组别组别细胞活力细胞活力HR组11cap025+HR组112±017124±017cap25+HR组167±007①146±009①cap25+HR组186±013①172±025①cap250+HR组226±035①212±018①cap2500+HR组001±001①⁃004±001①
注:与HR 组,①P<0.05

图3 流式细胞仪检测结果示意图Figure 3 Schematic diagram of results from flow cytometry
注:C1象限:Annexin-V-/PI+表示坏死细胞;C2象限. Annexin-V+/PI+表示中晚期凋亡细胞; C3象限:Annexin-V-/PI-表示存活细胞; C4象限. Annexin-V+/PI-表示早期凋亡细胞
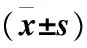
表2 各组A549细胞的凋亡率Table 2 Cell apoptosis rate of each group
注:与control组比较,①P<0.05;与HR组比较,②P<0.05;与cap25+HR组比较,③P<0.05
肺泡Ⅱ型上皮细胞具有增殖功能,被认为是肺泡上皮的干细胞,其增殖和分化不仅可以修复肺泡的正常结构,更可以有效地进行功能上的恢复[13]。另外,肺泡Ⅱ型上皮细胞还具有合成和分泌肺泡表面活性物质及其相关蛋白以及免疫调节的作用[13]。因此,肺泡Ⅱ型上皮细胞的正常结构与功能对维持肺泡结构和功能及局部环境稳态具有重要作用。肺组织在缺血再灌注过程中会引起肺泡Ⅱ型上皮细胞发生凋亡,从而引起肺损伤[17]。A549细胞是来源于人肺腺癌的肺泡基底上皮细胞株,它可以在体外无限分裂而且具有肺泡Ⅱ型上皮细胞特性[18]。本实验电镜结果证实,A549细胞核明显,胞浆内含有吞饮小泡,有大小不一的年轮状板层小体,其内容物近似同心圆状排列,此为肺泡Ⅱ型上皮细胞的特征性结构。因此,本实验建立A549细胞缺氧复氧模型用于模拟体内肺缺血缺氧过程,观察辣椒素对A549细胞缺氧复氧后细胞增殖及凋亡的作用,探讨辣椒素对肺泡Ⅱ型上皮细胞凋亡的影响。
缺氧复氧可以使得肿瘤细胞[19]、心肌细胞[20]、神经细胞[21]、上皮细胞等不同组织细胞发生凋亡,而且肺组织在缺血再灌注过程中会引起肺泡Ⅱ型上皮细胞发生凋亡[17]。为建立A549细胞缺氧复氧模型,本实验参考Wang 等[22]的方法,当A549细胞生长达70%~80%培养板底时,更换培养液为含100U/mL青霉素-链霉素混合液的无糖Hank’s缓冲液,置于37℃、1%O2、94%N2、5%CO2三气培养箱中缺氧培养不同时间(3~36h);缺氧培养结束后,更换培养液为不含FBS的DMEM,置于37℃、5%CO2普通培养箱中复氧培养24h。预实验结果示,经过缺氧36h复氧24h处理后,A549细胞发生凋亡的细胞为50%左右。与正常对照组比较,倒置显微镜下见贴壁细胞数量明显减少,上清液中见呈白色颗粒状脱落的细胞,贴壁细胞形态发生改变,细胞变圆或长出分支,有些细胞呈颗粒状,细胞膜完整,但胞核脆裂。其他缺氧时间A549细胞的凋亡率与control组差异不如缺氧36h明显。因此,本实验选择缺氧36h复氧24h建立A549细胞缺氧复氧模型。
研究显示,不同浓度辣椒素对细胞凋亡的影响是不同的[23-24]。因此,本实验参考Lin等[24]的方法选择多个浓度的辣椒素(0.25μM、2.5μM、25μM、250μM、2500μM)进行细胞增殖活力的实验,结果显示低浓度(0.25μM)对缺氧复氧A549细胞活力无明显影响,2.5μM、25μM、250μM辣椒素可增加缺氧复氧A549细胞的增殖活力,250μM最为显著,高浓度(2500μM)不仅不能增加A549细胞活力反而起抑制作用。为了阐明辣椒素增加缺氧复氧A549细胞的增殖活力是否与减少缺氧复氧诱导的细胞凋亡相关,用Annexin-V-FITC染色并评估细胞凋亡率。基于CCK8检测细胞增殖活力的结果,我们选择用25μM和250μM辣椒素处理以检测缺氧复氧A549细胞的凋亡。
本实验所用的两种辣椒素分别是从红辣椒提取纯化辣椒素纯度达95%以上的天然辣椒素和用化学合成的方法得到的纯度达99.99%的合成辣椒素标准品。从红辣椒提取的辣椒素类物质,除了天然辣椒素,还有二氢辣椒素、降二氢辣椒素、高二氢辣椒素和高辣椒素等系列同类物[25]。本实验选择合成辣椒素标准品进行细胞增殖活力检测的平行实验,比较天然辣椒素与合成辣椒素标准品对缺氧复氧A549细胞的作用,从而排除二氢辣椒素等辣椒素类物质对缺氧复氧A549细胞的作用。本实验结果显示,在0.25~2500μM各个浓度组别中天然辣椒素和合成辣椒素标准品对A549细胞增殖活力的影响无差异。故后续检测辣椒素对缺氧复氧A549细胞凋亡的影响选用了天然辣椒素。
有研究表明,25~75μM辣椒素可浓度依赖性地拮抗谷氨酸盐对皮层神经元细胞的损伤作用,增加细胞活力且降低细胞凋亡率,60μM辣椒素处理后的皮层神经元细胞活力最高[15];辣椒素可以浓度依赖性地显著减少大鼠海马角质层神经元缺氧复氧后的细胞凋亡,可能与细胞内ROS产生减少及抑制caspase-3活化有关[14];还有研究表明,在体外小鼠红藻氨酸诱导的癫痫模型实验中发现,辣椒素可明显减少细胞凋亡[26]。我们的结果与上述研究一致。不同的是,大量关于辣椒素对肿瘤细胞作用的研究中表明,辣椒素在体外和体内可抑制癌症生长和进展,并诱导各种类型的癌细胞凋亡,从而产生抑制肿瘤的作用;如:辣椒素通过诱导细胞周期G0/G1停滞和细胞凋亡对人结肠癌细胞具有抗增殖作用,而且辣椒素抗肿瘤效能与p53的稳定和活化有关[27];辣椒素可以抑制AGS人胃癌细胞增殖和诱导癌细胞凋亡和自噬[28];辣椒素可以介导人膀胱癌细胞凋亡,而且通过CD91激活树突细胞从而获得有效和持久的抗癌T细胞介导的免疫作用[29];辣椒素对SUM149PT乳腺癌细胞有抗肿瘤活性[30]。这种辣椒素对细胞凋亡作用的不同可能与细胞类型、细胞损伤程度、辣椒素浓度等有关。
TRPV1又称辣椒素受体,在1997年由Caterina等人第一次从大鼠背根神经节和三叉细胞中克隆出来,是一种配体门控的阳离子通道,辣椒素是TRPV1的天然配体[31];辣椒平是辣椒素的竞争性拮抗剂[32]。另外,TRPV1受体在器官缺血再灌注损伤中起着重要作用[33]。本课题组在以前的研究发现,缺血前给予辣椒素显着改善了大鼠心脏缺血再灌注后大鼠心脏功能和减少了心肌梗死面积,其机制可能与激活辣椒素受体, 引起P物质释放,进一步激活NK1型P物质受体有关;在辣椒素前给予辣椒平消除了辣椒素的心脏保护作用[5]。缺血前给予辣椒素降低了大鼠的肺缺血再灌注诱导的肺部炎症和氧化应激,减弱了肺功能障碍,其机制可能是通过激活TRPV1受体和释放降钙素基因相关肽(calcitonin gene-related peptide,CGRP);而在辣椒平预处理组其保护作用消失[8]。这些研究表明,辣椒素是通过作用于TRPV1而减轻肺缺血再灌注损伤。既往研究表明,TRPV1不仅表达在感觉传入神经元以及神经末梢,而且在血管内皮细胞、平滑肌细胞、淋巴细胞等非神经细胞上也有表达[34-35],TRPV1在呼吸道也表达,包括鼻粘膜细胞、C纤维神经元、气道平滑肌细胞、肺泡上皮细胞和支气管上皮细胞[36]。因此,我们推测辣椒素可能是通过作用于细胞上的TRPV1受体而发挥抗凋亡作用,其具体机制有待进一步的研究。
4 结论
缺氧前给予一定浓度的辣椒素可促进缺氧复氧A549细胞增殖,并抑制其凋亡,对缺氧复氧细胞有保护作用,但是高浓度(2500μM)辣椒素可抑制缺氧复氧A549细胞增殖活力,对缺氧复氧细胞有损伤作用。
【参考文献】
[1]Monsereenusorn Y, Kongsamut S, Pezalla PD. Capsaicin-a literature survey[J]. Crit Rev Toxicol, 1982, 10(4): 321-339.
[2]John F Peppin, Marco Pappagallo. Capsaicinoids in the treatment of neuropathic pain: a review[J]. Therapeutic Advances in Neurological Disorders, 2014, 7(1): 22-32.
[3]Angela M Chapa-Oliver, Laura Mejía-Teniente. Capsaicin: From Plants to a Cancer-Suppressing Agent[J]. Molecules, 2016, 21(8): 931-939.
[4]Luo XJ, Peng J, Li YJ. Recent advances in the study on capsaicinoids and capsinoids[J]. European Journal of Pharmacology, 2011, 650(1): 1-7.
[5]秦素兰, 刘陕岭, 王儒蓉. 辣椒素对大鼠心肌缺血再灌注损伤保护作用的研究[J]. 四川大学学报(医学版), 2008, 39(4): 550-554.
[6]Ueda K, Tsuji F, Hirata T,etal. Preventive effect of TRPV1 agonists capsaicin and resiniferatoxin on ischemia/reperfusion-induced renal injury in rats[J]. Journal of Cardiovascular Pharmacology, 2008, 51(5): 513-520.
[7]Huang M, Cheng G, Tan H,etal. Capsaicin protects cortical neurons against ischemia/reperfusion injury via down-regulating NMDA receptors[J]. Experimental Neurology, 2017, 295: 66-76.
[8]Wang MH, Ji P, Wang RR,etal. TRPV1 Agonist Capsaicin Attenuates Lung Ischemia-Reperfusion Injury in Rabbits[J]. Journal of Surgical Research, 2012, 173(1): 153-160.
[9]Rubenfeld GD, Caldwell E, Peabody Eve,etal. Incidence and outcomes of acute lung injury[J]. The New England Journal of Medicine, 2005, 353: 1685-1693.
[10] Ailawadi G, Lau CL, Smith PW,etal. Does reperfusion injury still cause significant mortality after lung transplantation [J]. Journal of Thoracic and Cardiovascular Surgery, 2009, 137: 688-694.
[11] Marc de Perrot, Mingyao Liu, Thomas K Waddell,etal. Ischemia reperfusion-induced lung injury[J]. American Journal of Respiratory and Critical Care Medicine, 2003, 167: 490-511.
[12] Xiong J, Xue FS, Yuan YJ,etal. Cholinergic anti-inflammatory pathway: a possible approach to protect against myocardial ischemia reperfusion injury[J]. Chin Med J (engl), 2010, 123: 2720-2726.
[13] 柳琪林, 胡森, 盛志勇. 肺泡Ⅱ型上皮细胞形态与功能的研究进展[J]. 中国危重病急救医学, 2003, 15(7): 445-446.
[14] Guo SY, Yang GP, Jiang DJ,etal. Protection of Capsaisin against hypoxia-reoxygenation-induced apoptosis of rat hippocampal neurons[J]. Canadian Journal of Physiology and Pharmacology, 2008, 86(11): 785-792.
[15] Lee JG, Yon JM, Lin CM,etal. Combined treatment with capsaicin and resveratrol enhances neuroprotection against glutamate-induced toxicity in mouse cerebral cortical neurons[J]. Food and Chemical Toxicology, 2012, 50(11): 3877-3885.
[16] SarasteA, Pulkki K. Morphologic and biochemical hallmarks of apoptosis[J]. Cardiovascular Research, 2000, 45(3): 528-537.
[17] 张赛,陈如坤,林敏,等. 大鼠肺缺血再灌注损伤中肺泡细胞凋亡的动态观察[J]. 中华医学杂志, 2004, 84(19): 1597-1600.
[18] 黄建华,李理,邱娴,等. 肺泡Ⅱ型上皮细胞A549对TNF-α和LPS的刺激效果研究[J]. 免疫学杂志, 2013, 29(3): 211-215.
[19] Ho FY, Tsang WP, Kong SK,etal. The critical role of caspases activation in hypoxia/reoxygenation induced apoptosis[J]. Biochemical and Biophysical Research Communications, 2006, 345(3): 1131-1137.
[20] Zhang RX, Li L, Yuan L,etal. Hypoxic preconditioning protects cardiomyocytes against hypoxia/reoxygenation-induced cellapoptosis via sphingosine kinase 2 and FAK/AKT pathway[J]. Experimental and Molecular Pathology, 2016, 100(1): 51-58.
[21] Li XM, Zhao YD, Liu PH,etal. Senegenin Inhibits Hypoxia/Reoxygenation-Induced Neuronal Apoptosis by Upregulating RhoGDIα[J]. Molecular Neurobiology, 2015, 52(3): 1561-1571.
[22] Wang W, Jia LY, Wang TK,etal. Endogenous Calcitonin Gene-related Peptide Protects Human Alveolar Epithelial Cells through Protein Kinase C and Heat Shock Protein[J]. Journal of Biological Chemistry, 2005, 280(21): 20325-20330.
[23] Lau JK, Brown KC, Dom AM,etal. Capsaicin induces apoptosis in human small cell lung cancer via the TRPV6 receptor and the calpain pathway[J]. Apoptosis, 2014, 19(8): 1190-1201.
[24] Lin CH, Lu WC, Wang CW,etal. Capsaicin induces cell cycle arrest and apoptosis in human KB cancer cells[J]. BMC Complementary and Alternative Medicine, 2013,13:46.
[25] Reyes-Escogido Mde L, Gonzalez-Mondragon EG, Vazquez-Tzompantzi E. Chemical and Pharmacological Aspects of Capsaicin[J]. Molecules, 2011, 16(2): 1253-1270.
[26] Lee TH, Lee JG, Yon JM,etal. Capsaicin prevents kainic acid-induced epileptogenesis in mice[J]. Neurochemistry International, 2011, 58(6): 634-640.
[27] Jin JZ, Lin F, Huang H,etal. Capsaicin Mediates Cell Cycle Arrest and Apoptosis in Human Colon Cancer Cells via Stabilizing and Activating p53[J]. International Journal of Biological Sciences, 2014, 10(3): 285-295.
[28] Arnab Sarkar, Shamee Bhattacharjee, Deba Prasad Mandal. Induction of Apoptosis by Eugenol and Capsaicin in Human Gastric Cancer AGS Cells-Elucidating the Role of p53[J]. Asian Pacific Journal of Cancer Prevention, 2015, 16(15): 6753-6759.
[29] Maria Saveria Gilardini Montani, Donatella D’Eliseo, Mara Cirone,etal. Capsaicin-mediated apoptosis of human bladder cancer cells activates dendritic cells via CD91[J]. Nutrition, 2015, 31(4): 578-581.
[30] Lea V Weber, Klaudia Al-Refae, Gerhard W lk,etal. Expression and functionality of TRPV1 in breast cancer cells[J]. Breast Cancer-Targets and Therapy, 2016, 8: 243-252.
[31] Caterina MJ, Schumacher MA, Tominaga M,etal. The capsaicin receptor: a heat-activated ion channel in the pain pathway[J]. Nature, 1997, 389: 816-824.
[32] Bevan S, Hothi S, Hughes G,etal. Capsazepine: A competitive antagonist of the sensory neuron excitant capsaicin[J]. British Journal of Pharmacology, 1992, 107(2): 544-552.
[33] Wang LH, Wang DH. TRPV1 gene knockout impairs postishemic recovery in isolated perfused heart in mice[J]. Circulation, 2005, 112(23): 3617-3623.
[34] Cortright DN, Szallasi A. Biochemical pharmacology of the vanilloid receptor TRPV1[J]. Eur J Biochem, 2004, 271(10): 1814-1819.
[35] Alawi K, Keeble J. The paradoxical role of the transient receptor potential vanilloid 1 receptor in inflammation[J]. Pharmacology & Therapeutics, 2010, 125(2): 181-195.
[36] Thomas KC, Sabnis AS, Johansen ME,etal. Transient Receptor Potential Vanilloid 1 Agonists Cause Endoplasmic Reticulum Stress and Cell Death in Human Lung Cells[J]. J Pharmacol Exp Ther, 2007, 321(3): 830-838.
