肺部亚厘米磨玻璃结节的螺旋CT与病理对照分析
2018-05-03,,,,,,,
,,, ,, ,,
(1.解放军第306医院放射科,北京 100101;2.解放军第306医院病理科,北京 100101)
随着螺旋CT的广泛应用,尤其将低剂量CT作为高危人群肺部肿瘤的筛查手段以来,越来越多的肺部磨玻璃结节(ground glass nodule,GGN)被检出。目前认为,持续存在的肺磨玻璃结节与肺腺癌密切相关[1-2],但对于小于1.0 cm(亚厘米)GGN的理解,在病变性质的早期判断、是否需要穿刺活检、影像学特征与病理诊断的关系以及手术指征等方面存在不同观点,因而给临床决策造成一定困难[3-7]。现对我院2013年5月至2016年6月肺部亚厘米GGN病例进行回顾性分析,结合螺旋CT表现特征和病理结果进行对照分析,以期进一步提高对肺部亚厘米GGN病变的鉴别诊断准确率,为临床决策提供依据。
1 资料与方法
1.1 临床资料
选择本院于2013年5月至2016年6月行胸部CT扫描发现的30例患者中36个小于1.0 cm的GGN,入组病例的病理结果均经胸腔镜手术获取,2例由临床随访病灶吸收证实。其中单发结节25例,4例患者有2个病灶,1例有3个病灶,对病灶的CT表现和病理改变进行对照分析。患者年龄33~72岁,平均(49.54±8.75)岁,其中男12例,女18例。按病理性质将其分为良性组、浸润前组(包括不典型腺瘤样增生及原位腺癌)和浸润组(包括微浸润及浸润性腺癌)。本临床研究经解放军第306医院伦理学委员会审查同意。
1.2 方法
胸部CT采用Siemens definition-64排螺旋CT,均为平扫,重建层厚1 mm。CT征象分析数据包括病灶大小、形状、边缘、空泡征、邻近血管情况、支气管情况、与胸膜关系等。以上征象由2位具有10年以上影像科诊断经验的医师在未知病理结果的情况下测量。病理诊断采用2011年国际肺癌研究协会/美国胸科学会/欧洲呼吸学会分类标准[8]。胸腔镜手术切除标本经4%多聚甲醛固定,4 μm切片,HE染色,光镜下观察组织学变化。若光镜下无法判断肿瘤分类,则参考免疫组化染色予以明确。
1.3 统计学方法
采用SPSS 17.0软件进行分析。计量资料采用独立样本t检验,计数资料采用Pearsonχ2检验。期望值小于5时用确切概率法检验,用Spearman检验进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 不同病理类型GGN的CT征象
良性组与非良性组病变(浸润前组及浸润组)病灶的大小、形态、边界情况比较,差异无统计学意义(P>0.05);良性组与非良性组病灶邻近血管的改变在病变间的差异有统计学意义(P<0.05);浸润前组及浸润组病灶的大小与胸膜的关系及邻近血管的改变比较,差异有统计学意义(P<0.05),见表1。

表1 不同病理性质GGN的CT征象及诊断价值
2.2 病理结果
良性GGN 7例,其中肺泡上皮及血管增生伴碳末沉积1例,局部淋巴组织增生并碳末沉积1例,肺泡间质纤维组织增生及肺泡上皮增生3例(图1),1例3个月后复查消失,另有1例1周后复查消失;浸润前组25例,其中不典型腺瘤样增生6例(图2),原位腺癌19例(图3);微浸润腺癌3例(图4),浸润性腺癌1例。
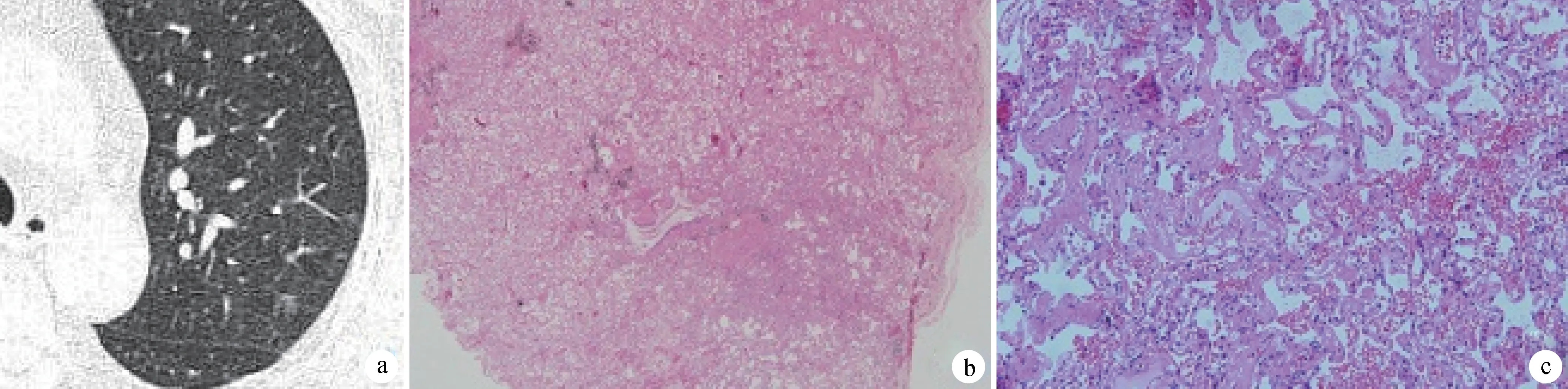
a:CT示左上肺病变形态不规则,未见空泡征及血管穿行征象; b:肺泡壁增厚(HE ×40); c:肺泡间质纤维组织增生,散在肺泡上皮细胞增生(HE ×200)
图1磨玻璃样良性结节
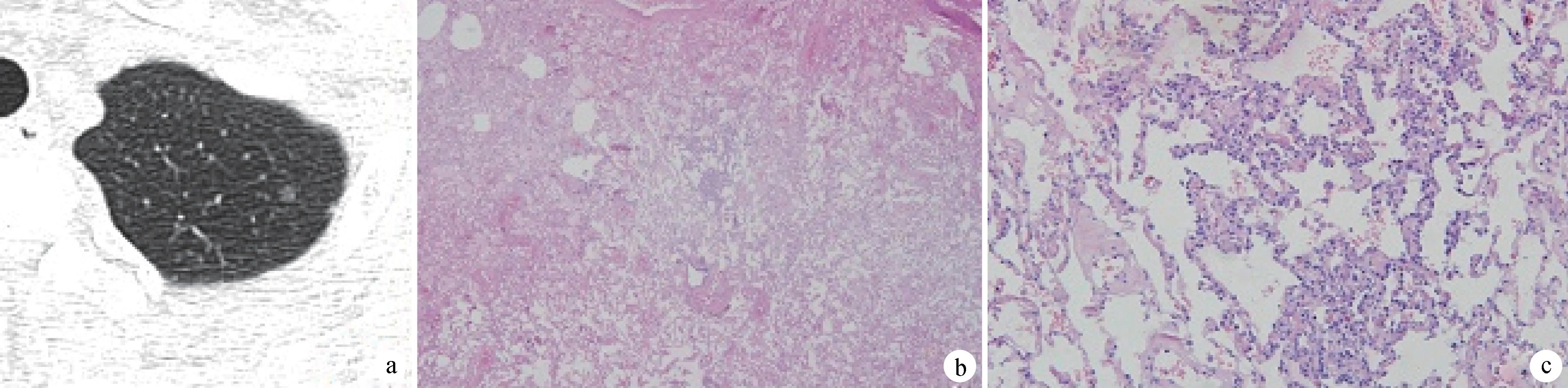
a:CT示左上肺微小磨玻璃结节,未见血管穿行及支气管改变; b:非典型腺瘤样增生(HE ×40); c:局部中央肺泡壁增厚和肺泡上皮数量增多(HE ×200)
图2磨玻璃样不典型腺瘤样增生
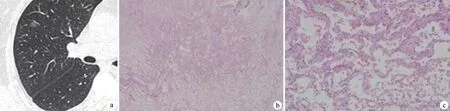
a:CT示右肺上叶磨玻璃结节,血管贴边,未伸入病灶; b:原位腺癌(HE ×40); c:肿瘤细胞沿着原有的肺泡壁连续排列增生,保留原有肺泡壁结构(HE ×200)
图3磨玻璃样原位腺癌
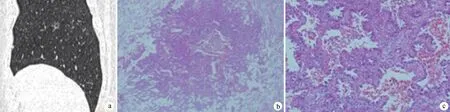
a:CT矢状位重建图像显示磨玻璃结节的空泡征及血管伸入征象; b:浸润性腺癌(HE ×40);c:肺泡组织结构破坏,肿瘤细胞拥挤重叠,大部分贴壁生长,局部间质浸润(HE ×200)
图4磨玻璃样浸润性腺癌
2.3 病例随访
2例患者分别在治疗观察1周和3个月后复查时病变消失,临床诊断为炎性病变;28例患者胸腔镜手术顺利恢复,随访1~4年,患者情况良好。
3 讨论
随着多排螺旋CT的应用,特别是近年来低剂量CT的筛查,肺部磨玻璃结节越来越多的被发现,多层螺旋CT的临床应用价值得到广泛认可[9]。正常情况下肺泡腔由气体填充,在某些病理改变如肺泡腔内液体潴留或肿瘤浸润时,局部肺组织密度增加致使单位像素内气体含量减少,即产生CT图像上的GGN[10]。GGN既可以是良性病变,如炎症或局灶性纤维化,也可以是癌前期病变,甚至可以是不同级别的腺癌。已有研究表明,持续存在的磨玻璃结节与腺癌密切相关[1-2];小于10 mm的肺内磨玻璃结节术后10年生存率可以达到97%[11]。显然,提升对亚厘米水平肺磨玻璃结节的诊断水平,对阻止或阻断肿瘤的进一步发展有重要意义,同时也可以避免部分不必要的手术。
亚厘米磨玻璃结节的腺癌往往处于早期,侵袭度较低,相较于传统的肺部实性结节或较大的磨玻璃结节恶性征象较少。从本组数据来看,磨玻璃结节的大小对浸润前病变和腺癌的鉴别有诊断意义。这一结论也与既往文献报道基本相符,即病灶的大小可作为诊断恶性病变的独立因素之一[12]。微浸润及浸润性腺癌一般较浸润前病变大,在本组病例中,浸润前组的平均最大径约(6.10±1.02)mm,而浸润组的平均最大径约(8.63±1.30)mm,2组比较差异具有统计学意义;小于6 mm的非良性磨玻璃结节以浸润前病变为主,尤以不典型腺瘤样增生居多;病灶大小在良性病变与浸润前病变及浸润组腺癌的鉴别诊断方面差异无统计学意义,本组病例中7例良性病变的磨玻璃影大小不一,大至9.89 mm,小至4.21 mm,未发现特殊相关性。本研究结果提示,在影像学和临床诊断过程中可将病灶大小作为诊断的重要依据。
通过对本组病例的观察及统计,血管穿行可以作为良性病变与浸润前病变的鉴别点,而穿行血管的异常增粗或粗细不均可以作为浸润前病变与浸润组的重要鉴别点。有学者认为,纤维化反应是肿瘤周边及肿瘤内部血管异常增多的主要原因[13];另有研究认为,外源性和/或内源性所致的肿瘤血管生成可使肿瘤周边血管向其趋向性生长,早期也可表现为血管的增粗[14]。本组7例经过复查或病理诊断为良性病变的磨玻璃影均未出现血管穿行征象,而25例浸润前组的磨玻璃影中有18例出现了血管穿行征象,浸润组腺癌中血管穿行的比例达72%,其中10例出现了血管异常增粗或粗细不均。分析认为,出现血管穿行则提示非良性病变可能大,如果穿行血管增粗或不均匀则提示微浸润或浸润性腺癌的可能性会大大增加。
胸膜凹陷征一直以来被作为恶性结节的CT征象。在本组36例磨玻璃结节中,仅有4例出现了胸膜凹陷征,病理均为微浸润腺癌或浸润性腺癌。本组另有2例胸膜下磨玻璃结节,1例与胸膜呈广基底相连,1例与胸膜间呈“刀切征”,分别在1周及3周后完全吸收。由此可以看出,胸膜凹陷征在磨玻璃结节的鉴别诊断中仍可以作为恶性征象的表现,而广基底相连或刀切征的出现则提示病变为良性可能大。但病变与胸膜的关系仅限于病变的发生部位距离胸膜较近的时候,这在一定程度上减弱了该征象诊断浸润型腺癌的敏感性,但其特异性却不容忽视。
空泡征是癌细胞侵犯肺泡,继而融合形成的小空腔,CT上表现为病变内的含气透光区,病理学上的空泡是被覆立方形肺泡上皮。良性病变通常以肺泡塌陷或肺泡内渗出为主,较少直接破坏肺泡结构。本组病灶中,良性病变中无一例出现空泡征,而浸润组腺癌空泡征的出现率明显较浸润前组高,由此可见,空泡征的出现提示病变恶性,尤其是微浸润或浸润性腺癌可能大。
既往有文献报道腺癌与支气管的关系,认为表现为磨玻璃影的腺癌更容易出现支气管的中断或扭曲[15-16]。本组病例均未见该征象,原因可能有以下两个方面:①该征象更容易出现在距离肺门更近的区域,越靠近肺的外带,支气管越细且分布稀疏,在肺内的分布方面近肺门处病变数量较少;②支气管的中断或扭曲征象多见于浸润性腺癌[17-19],本组病例磨玻璃影为亚厘米级别,浸润性腺癌相对较少,认为这是本组病例未显示支气管改变原因之一。
本组有2例患者在治疗随访过程中病灶完全吸收,证实为炎性病变。据文献报道,表现为GGN的炎性病变并不少见[20-22]。有学者主张在CT引导下对GGN进行穿刺活检从而达到病理诊断的目的[23]。但穿刺活检在病变小于1 cm时难度较大,反复调整穿刺针位置会增加对患者的损伤及并发症发生率[24],另外对于后续的手术及病理取材也会造成一定困难[25]。通过对肺部亚厘米GGN的螺旋CT与病理对照分析,笔者认为:①细致分析GGN的CT征象,即可初步判定病变的良恶性及侵袭性;②适时复查掌握其动态特征是诊治此类病变的重要策略,这样既不延误恶性病变,又能有效避免对炎症GGN的不必要手术;③不建议对肺内亚厘米GGN进行盲目穿刺活检术。
鉴于肺内磨玻璃结节的检出率越来越高,早期、准确的诊断不仅可以减轻患者的心理和生理负担,也可以节约大量的社会资源。本研究回顾性分析亚厘米磨玻璃结节的CT和病理对照,为临床对磨玻璃结节的处理提供了一定参考价值,但本研究纳入病例较少,尚有待进一步开展多中心大样本临床对照研究。
[参考文献]
[1] Kakinuma R,Muramatsu Y,Kusumoto M,et al.Solitary pure ground-glass nodules 5 mm or smaller:frequency of growth[J].Radiology,2015,276(3):873-882.doi:10.1148 / radiol.2015141071.
[2] 史志勇,孙 永,王 娟,等.多层螺旋CT对小于1cm肺局灶性磨玻璃结节的诊断价值[J].局解手术学杂志,2016,25(6):446-449.doi:10.11659/jjssx.10E015137.
[3] Zheng YF,Jiang LM,Mao WM,et al.Percutaneous computed tomography-guided lung biopsy of solitary nodular ground-glass opacity[J].J Cancer Res Ther,2015,Suppl:C231-323.doi:10.4103/0973-1482.162117.
[4] 林心琛,林征宇,严 媛.CT引导下经皮肺穿刺活检对肺局灶性磨玻璃影的诊断价值[J].医学影像学杂志,2017,27(6):1088-1090.
[5] 王 梅,曹捍波,许华权.MSCT对最大径≤1cm肺腺癌亚型分型的诊断价值[J].医学影像学杂志,2017,27(8):1466-1470.
[6] 赵 悦,王 瑞,陈海泉.肺部磨玻璃影的诊断与治疗进展[J].中国肺癌杂志,2016,19(11):773-777.doi:10.3779 / j.issn.1009-3419.2016.11.09.
[7] 钟 斌,吴奇勇,童继春,等.胸腔镜肺段或肺叶切除术治疗肺磨玻璃结节的比较研究[J].中国微创外科杂志,2017,17(1):62-64.doi:10.3969/j.issn.1009-6604.2017.01.017.
[8] Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society:international multidisciplinary classification of lung adenocarcinoma[J].Proc Am Thorac Soc,2011,8(5):381-385.doi:10.1093/ejcts/ezv316.
[9] 左玉强,冯平勇,孟庆春,等.纯磨玻璃密度肺腺癌病灶内容CT影像特点[J].实用医学杂志,2017,33(4):576-579.doi:10.3969/j.issn.1006-5725.2017.04.020.
[10] Park CM,Goo JM,Lee HJ,et al.Nodular ground-glass opacity at thin-section CT:histologic correlation and evaluation of change at follow-up[J].Radiographics,2007,27(2):391-408.doi:10.1148/rg.272065061.
[11] Sepesi B,Walsh GL.Surgical therapy of ground-glass opacities[J].Semin Diagn Pathol,2014,31(4):289-292.doi:10.1053/j.semdp.2014.06.006.
[12] Fan L,Liu SY,Li QC,et al.Multidetector CT features of pulmonary focal ground-glass opacity:differences between benign and malignant[J].Br J Radiol,2012,85(1015):897-904.doi:10.1259/bjr/33150223.
[13] Jin X,Zhao SH,Gao J,et al.CT characteristics and pathological implications of early stage(T1N0M0) lung adenocarcinoma with pure ground-glass opacity[J].Eur Radiol,2015,25(9):2532-2540.doi:10.1007 / s00330-015-3637-z.
[14] Fridman WH,Dieu-Nosjean MC,Pages F,et al.The immune microenvironment of human tumors:general significance and clinical impact[J].Cancer Microenviron,2013,6(2):117-122.doi:10.1007 / s12307-012-0124-9.
[15] 邢彦粉,江 森,陈燕清,等.肺内多发肿瘤性局灶性磨玻璃结节螺旋CT表现与病理对照分析[J].中华结核和呼吸杂志,2014,37(5):382-384.
[16] 高 丰,葛虓俊,李 铭,等.经多层螺旋CT探讨肺磨玻璃结节与支气管的关系[J].中华放射学杂志,2013,47(2):167-161.doi:10.3760/cma.j.issn.1005-1201.2013.02.013.
[17] 周 莹,刘士远,李 琼,等.临床ⅠA期周围型肺腺癌病理性脉管浸润与其薄层CT征象的相关性研究[J].中华放射学杂志,2015,49(4):259-263.doi:10.3760/cma.j.issn.1005-1201.2015.04.006.
[18] 左玉强,左晓玲,邢维明,等.肺纯磨玻璃密度不典型腺瘤样增生与微浸润腺癌的CT鉴别诊断[J].临床肺科杂志,2017,22(4):586-588.doi:10.3969/j.issn.1009-6663.2017.04.002.
[19] 李 铭,高 丰,郑向鹏,等.肺内亚厘米磨玻璃结节的CT诊断与鉴别[J].实用放射学杂志,2014,30(3):416-420.doi:10.3969/j.issn.1002-1671.2014.03.012.
[20] 刘凌霏,刘 佳,李文武,等.磨玻璃密度肺癌与炎症的HRCT鉴别诊断[J].中华肿瘤防治杂志,2015,22(9):692-695.doi:10.16073/j.cnki.cjcpt.2015.09.011.
[21] 赵宏宇,郝利国.64层螺旋CT薄层重建在老年肺局限磨玻璃密度影中的诊断价值[J].中国老年学杂志,2013,33(16):4047-4048.
[22] 陈群慧,叶晓丹,朱 莉,等.肺孤立性磨玻璃密度结节的超高分辨力CT表现及与病理的相关性[J].放射学实践,2014,29(1):57-60.
[23] 王小铭,黄显龙.CT透视引导下经皮肺穿刺活检对肺部磨玻璃样病变诊断价值的Meta分析[J].临床放射学杂志,2017,36(1):123-127.doi:10.13437/j.cnki.jcr.2017.01.034.
[24] 严高武,杨国庆,付泉水,等.CT引导下肺穿刺活检诊断肺部局灶性磨玻璃密度结节失败因素分析[J].川北医学院学报,2017,32(5):684-687.doi:10.3969/j.issn.1005-3697.2017.05.010.
[25] 李 铭,高 丰,吕凡真,等.肺微小磨玻璃结节标本充气下CT引导下穿刺定位[J].放射学实践,2014,29(4):444-446.doi:10.13609/j.cnki.1000-0313.2014.04.028.
