托出式胰后入路脾门淋巴结清扫在腹腔镜胃癌根治术中的临床应用
2018-05-03,,,,
, , ,,
(1.宜宾市第二人民医院胃肠外科,四川 宜宾 644000;2.宜宾市第二人民医院麻醉科,四川 宜宾 644000)
胃癌D2手术为进展期胃癌的标准术式,根据新版日本胃癌治疗指南[1],由于第10组淋巴结属于第2站淋巴结,行近端胃癌全胃切除时需常规进行清扫。但长期以来第10组淋巴结是否联合脾切除都存在着争议,且近年来有相关研究证实联合脾切除的第10组淋巴结清扫并没有改善患者总体生存情况,反而增加了相关术后并发症[2]。JCOG 0110随机对照实验指出,除非T2~T4的肿瘤直接侵犯脾或者肿瘤位于胃上部大弯侧,否则应采用保脾手术[3]。随着腹腔镜技术的发展,基于其微创、精细的优点,腹腔镜保脾全胃切除手术(laparoscopic spleen-preserving total gastrectomy,LSPTG )已被业内接受。但腹腔镜下脾门淋巴结的清扫,因脾门位置深在,血管走行复杂,腹腔镜操作技术难度较大,该方法仍较难广泛运用。开腹脾托出式脾门淋巴结清扫已被证实能克服上述困难,能多维度地完成脾门淋巴结清扫。但腹腔镜下的脾托出式脾门淋巴结清扫效果如何目前暂无相关报道。故我院整合腹腔镜技术与脾托出式的清扫技术方法,常规对近端胃癌行托出式胰后入路的脾门淋巴结清扫,并对该技术进行总结。本研究回顾性对比分析2014年6月至2017年1月宜宾市第二人民医院收治的84例进展期近端胃癌患者的临床资料,探讨该手术方式的可行性和安全性,并对相关解剖进行总结。
1 资料与方法
1.1 临床资料
采用回顾性队列研究方法,收集2014年6月至2017年1月宜宾市第二人民医院收治的84例进展期近端胃癌患者的临床病理资料。将44例采用经腹腔镜托出式胰后入路法的患者设为观察组,40例采用腹腔镜左侧入路法的患者设为对照组。肿瘤分期、分级采用美国癌症联合委员会第7版胃癌TNM分期标准。2组患者性别、年龄、BMI、肿瘤分期、分级等一般资料比较,差异无统计学意义(P>0.05),见表1。本研究通过我院伦理委员会审批,患者及家属签署手术知情同意书。

表1 2组患者一般资料比较
1.2 纳入标准和排除标准
纳入标准:①术前胃镜病理检查诊断为近端胃癌;②CT和超声未发现腹、盆腔种植性转移或肿瘤已侵及胃周器官,腹主动脉旁无淋巴结转移证据;③经过病理学R0切除和D2淋巴结清扫的腹腔镜全胃切除病例。排除标准:①术中证实为T4b肿瘤;②术前、术中诊断为远端转移;③术前接受了新辅助放化疗;④临床病史、病理资料不完整;⑤既往有胃、胰、脾相关手术史。
1.3 手术方法
84例患者手术均由同一组医师执行,观察组采用腹腔镜托出式胰后入路法。第1步:取平仰“大”字体位,采用常规5孔法,脐下戳孔建立气腹,置入观察镜,主刀位于患者左侧,助手位于患者右侧,扶镜手占位患者两腿之间。第2步:在胃大弯中间处沿横结肠剥离、切断胃结肠韧带,向左一直到结肠脾曲,剥离至小网囊左下角;向右到结肠肝曲,向上以结肠中血管为导向,拓展胃结肠间隙至胰十二指肠前间隙。分别于根部离断结扎胃网膜右动、静脉。自左向右于胰颈部游离胰腺被膜前叶。第3步:以胃十二指肠动脉为指导,游离十二指肠后间隙,并寻找肝总动脉、肝固有动脉,于胃右动脉与十二指肠上动脉第一支围成的三角形系膜切开,置入切割闭合器,幽门下2 cm处切断十二指肠。向左牵拉十二指肠近侧端,沿肝固有动脉向头侧游离,找到胃右动脉根部结扎、离断。第4步:以肝总动脉为指导,自右向左解剖,清扫胰上区淋巴结和脂肪组织,根部结扎切断冠状静脉和胃左动脉。第5步:切断胃左动脉后,以右侧膈肌脚为指引,游离胃后间隙,向上、向左扩展疏松间隙,直到食管腹段后侧,暴露左侧膈肌脚及胃底。第6步:裸化小弯,切断迷走神经前后干。自此已廓清第1、3、4d、5、6、8a、12a、7、9组淋巴结。第7步:离断脾结肠韧带,体位变为左高、头侧高15°~30°,利用重力降低结肠脾曲及小肠,胃及大网膜向头侧翻置于肝下。沿着胰腺下缘将小网膜腹膜切开,掀起胰腺,用电钩将其胰后疏松组织剥离。肠钳向上抬起胰腺,充分游离胰后无血管区,向中线至肠系膜下静脉汇入脾静脉处,向外至脾与后腹膜连接处,向头侧跨过左肾上腺前间隙至左膈下血管胃底支与胃后间隙相连。暂不切断脾与后腹膜连接,有利于胰腺后间隙暴露。最后结扎、切断左膈下胃底支,分别离断胃底与后腹膜连接,脾与后腹膜连接,至此胰体尾部及脾完全游离。反穿刺法置吻合器头于食道,切割闭合器切断腹段食道,拉出吻合器头。第8步:取剑突下正中纵行辅助切口7~8 cm,将全胃、大网膜、脾、胰腺体尾部托出腹腔外。第9步:助手握持脾,切开脾胃韧带,自下而上清扫胃网膜左血管及胃短血管周围脂肪组织及淋巴结并于根部切断上述血管。自脾门向近端脾叶血管清扫脾门前组脂肪及淋巴结,并可适度翻转脾及胰尾,清扫脾门后组淋巴结。沿脾动脉干向中线清扫,直至腹腔干。至此完成2、4sb、4sa、10、11组淋巴结清扫。最后消化道重建采用Roux-en-Y吻合。主要手术步骤见图1,对照组采用常规左侧入路腹腔镜胃癌根治术,方法参照文献[4]。

a: 显露胃后间隙; b:胰腺下缘进入胰后间隙;c:胰后间隙毗邻关系;d:左膈下动脉胃底支;e:腔镜下脾完全游离抬起;f:结扎胃网膜左血管,清扫4sb组淋巴结;g:清扫脾门后组;h:沿脾动脉向中线清扫11组淋巴结
图1腹腔镜托出式胰后入路脾门淋巴结清扫手术步骤
1.4 观察指标
观察指标包括手术时间,术中出血量,第10组淋巴结的清扫数量,术后首次下床活动时间,肛门排气时间,术后住院时间,术后并发症(肠梗阻、脾扭转、脾梗死、吻合口瘘、吻合口出血、胰瘘)。
1.5 随访
采用门诊或电话方式随访,了解患者生存情况,随访截止时间为2017年6月。
1.6 统计学分析

2 结果
2.1 手术情况
84例患者均顺利完成根治性全胃切除术(D2根治术),均成功保留脾,完成第10组淋巴结清扫,未中转开腹。观察组术中出血量与手术时间分别为(107.9±52.9)mL和(228.8±27.7)min,对照组术中出血量与手术时间分别为(153.1±72.2)mL和(244.7±31.3)min,观察组术中平均出血量及手术时间均少于对照组,2组差异有统计学意义(P<0.05)。观察组第10组淋巴结清扫数量为(5.0±2.2)枚,对照组第10组淋巴结清扫数量为(2.9±1.3)枚,观察组平均清扫量多于对照组,2组差异有统计学意义(P<0.05),见表2。
2.2 术后情况
观察组与对照组术后均能早期康复活动,观察组与对照组术后首次下床活动时间分别为(1.6±0.4)d和(1.5±0.4)d,术后肛门排气时间分别为(2.9±0.8)d和(2.6±0.5)d,术后住院时间分别为(7.5±1.4)d和(7.0±1.3)d。2组首次下床活动时间、术后肛门排气时间、术后住院时间比较差异无统计学意义(P>0.05),见表2。观察组术后发生并发症4例,其中麻痹性肠梗阻2例,腹腔脓肿2例,均经非手术治疗痊愈;对照组术后发生并发症5例,其中肠麻痹3例,吻合口漏1例,吻合口出血1例,吻合口出血经胃镜下钛夹止血成功,均保守治疗好转。无脾扭转、完全脾梗死、胰瘘等严重并发症。
2.3 随访情况
84例患者中,82例获得随访,随访时间为6~36个月,中位随访时间为15.5个月。随访中2组分别有1例因肿瘤腹膜种植性转移,癌性腹水死亡。
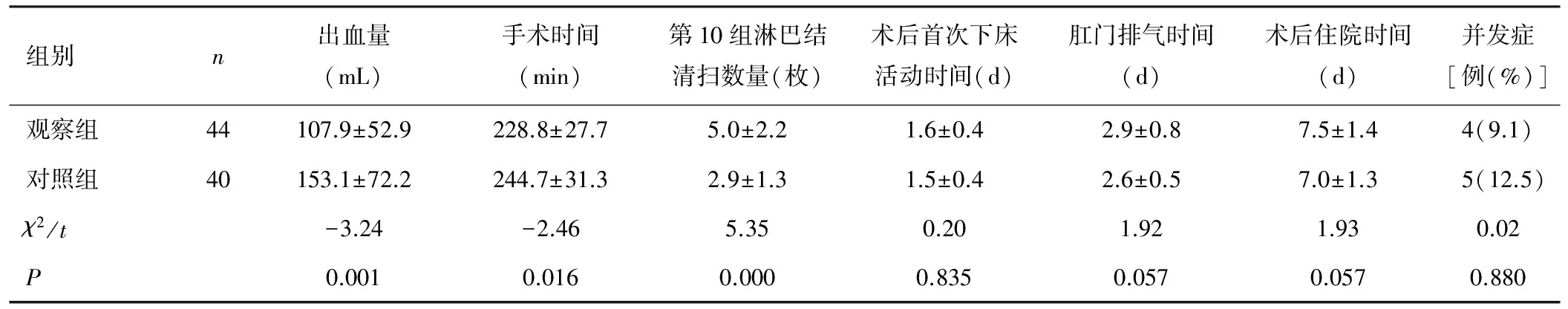
表2 观察组和对照组患者术中及术后情况比较
3 讨论
解剖学上描述胃的淋巴系统及研究胃癌淋巴结的转移规律是胃癌手术治疗的关键,以此为基础的胃癌D2根治术已成为胃癌手术的标准手术方式。胃上部尤其大弯侧的淋巴引流经脾胃韧带注入脾门和胰尾间的胰脾淋巴结[5],故近端胃癌脾门组淋巴结被认为是全胃切除的第2站淋巴,应作为常规的清扫范围。20世纪80年代日本学者广泛采用联合脾切除的胃癌扩大根治术以达到彻底清扫脾门淋巴结目的[6],但近年有研究发现切除脾的扩大根治术术后并发症多,且并未提高患者的总生存率[7-8]。因此,第4版日本胃癌治疗指南指出:除非T2~T4肿瘤直接浸润脾门或胃上部大弯侧,否则不作为脾切除术指征[9]。
随着腹腔镜技术的发展,因其微创、恢复快、良好的肿瘤清除率等优点,该技术已广泛运用于胃癌手术中[10-11]。但对于腹腔镜全胃切除脾门淋巴结清扫,因脾门位置深、血管变异多,周围组织结构复杂[11],学习曲线较长,就目前我国临床使用情况来看,仅中心级医院常规开展。根据清扫起点及清扫第10组、11组顺序方向的不同,腹腔镜下清扫方法分为右侧入路法、中位入路法、胰后入路法、左侧入路法[12-14]。左侧入路法在我国开展较早,流程规范,已有大量的临床研究证实其安全性[15],故目前临床较为常用。本次对照组即为腹腔镜左侧入路法。
我科就腹腔镜下保脾脾门淋巴结清扫手术进行长期解剖研究,结合李国新教授腹腔镜胰后入路的清扫方式以及既往开腹脾托出式脾门淋巴结清扫的临床实践[16],创造并常规开展了近端胃癌腹腔镜脾托出式第10组淋巴结清扫术。首先,该手术方法从解剖学上分析有其可行性及合理性。胃癌根治切除术包括切除胃及胃系膜淋巴组织。在胚胎发育过程中,胃及胃系膜均以胰腺为中心分布,脾及胰腺均发生于胃背侧系膜两叶之间。而在前肠旋转过程中,背侧系膜与脏器腹壁靠近,发生融合,形成充满疏松结缔组织的融合筋膜间隙,该间隙无血管,加之组织疏松,构成了天然的外科解剖平面。胰腺后筋膜与肾前筋膜之间的Toldt间隙就是该手术的解剖学基础,该间隙向右分离,可顺利进入腹主动脉前及脾门、脾后方。在本研究中,观察组胰后间隙平面向中线可扩展至肠系膜下静脉汇入脾静脉处,向头侧可分离至胃后间隙,切开胃底腹膜附着处可通向膈下间隙,向左可到脾与后腹膜附着处,后腹膜可完整游离脾。本研究显示,观察组手术时间少于对照组,主要节约了脾门淋巴结清扫的时间,其原因是左侧入路及其他入路的手术方式均是以血管为导向的淋巴结清扫,在沿单根主血管清扫时根据血管走行清扫是值得推荐的,但遇到集中性脾叶血管分布的时候,因脾叶血管之间间隙狭小,血管分布不在一个平面呈交错排列[17-18],加之脾位于左季肋区,暴露困难,主刀与助手操作杆指向同一方向,容易相互干扰,暴露困难。在缺乏立体纵深感的腔镜手术中,主刀需要在多个层次分离解剖,容易迷失方向,血管导向作用减弱。而托出式胰后入路脾门淋巴结清扫能很好地克服上述困难,腹腔镜游离时参考坐标为胰腺,胰腺因其解剖学特点位置恒定,即使面对肥胖患者,术中可通过胰腺特有的颜色和质地进行定位,能准确进入胰后间隙。进入胰后间隙后,由于衍生于胃背侧系膜后层后叶的胰腺后筋膜与Gerota筋膜有明显的滑动性,极易在腔镜手术中辨认[19],术中通过牵拉可随时调整辨认解剖层面。因此,遵循胰后入路的解剖平面,能很快完成脾及胰体尾部游离,脾一旦从标本口托出,腹腔镜脾门淋巴结清扫难点迎刃而解。其次,本研究中,观察组出血少于对照组,我们认为正是得益于绝大部分腹腔镜操作在胰后无血管间隙进行,以及托出式脾门淋巴结清扫的高效且出血可控。尤其肥胖患者,脾门区脂肪堆积,操作空间更加狭小,除患者脂肪堆积脾门暴露困难外,脾脆性高,腔镜下即使轻柔操作仍易导致脾的撕裂出血,进而引起腔镜视野解剖不清。而脾托出式清扫暴露清晰,并且可以充分利用人手对组织血管的触感,避免出血及脾撕裂伤。最后,托出式胰后入路脾门淋巴结清扫因可随意翻转脾,相对于其他入路的腹腔镜手术方法,在脾门后组的淋巴结清扫有着无可比拟的优势,能真正做到脾门淋巴结“立体”清扫[20],淋巴结清扫彻底且省时、简单。而采用左侧入路法时,除非胰尾与脾门有较长间隙,否则很难对脾门后组淋巴结进行清扫,因此观察组淋巴结清扫个数多于对照组及相关左侧入路文献报道的第10组淋巴结的清扫个数[21]。
经腹腔镜脾托出式保留脾脾门淋巴结清扫的手术方式,因其遵循外科解剖平面,故手术相对简单。但术中仍需要注意:①因胰腺特有质地,手术很容易进入胰后间隙,但在间隙拓展中,要始终以胰后筋膜为界,以防脾动、静脉的损伤。胰后筋膜是一层镜下失去光泽的筋膜[22],在脾静脉处明显,分离层面只要不超过该层面,就可避免脾动、静脉的损伤。②胰后筋膜间隙上界有左膈下动脉胃底支,该血管为突破胃底的唯一血管障碍,需切断并避免损伤出血。③脾与后腹膜附着处最后游离,此时脾四周悬空,可避免损伤脾。④向中线尽量游离胰腺,以肠系膜下静脉为界,胰腺的充分游离有利于后期脾托出切口;⑤托出脾及胰体尾部时,不用担心标本口过小不能托出,因脾在挤压下有一定的伸缩变形,只要把握力度,在充分肌松的情况下经7~8 cm的切口均可安全托出。⑥放回脾时,注意方向,避免扭转,正确放回脾,术后因脾很快粘连固定,目前未发现脾扭转病例。⑦因该手术后脾胰游离,脾胰后间隙易积液,术后引流管需安置脾后,这样可避免脾窝积液、积血导致脓肿形成。观察组中术后出现2例脾窝脓肿,考虑此原因导致,改进术中引流管安置位置后未出现。
目前,对于脾门淋巴结的清扫成为胃中上部癌研究的热点,由于脾门后组淋巴结清扫困难,现对于脾门后组淋巴结的研究极少,由于胃底大弯左侧及胃大弯上半淋巴结存在转移途径不同[23],我们推测脾门淋巴结的转移存在着前、后组的差异。国内有学者认为对脾门血管后方淋巴结清扫虽能提高第10组淋巴结清扫总数,但手术难度大,加之病例限制,在其后组清扫的病例中并没有发现阳性淋巴结,故持否定态度[11]。由于经腹腔镜脾托出式脾门淋巴结手术能很好地解决脾门血管背侧淋巴结组清扫的困难,可常规对脾门淋巴结进行亚组分型,进而可对脾门淋巴转移规律进行深入地探讨,为行更精准的腹腔镜下近端胃癌根治术打下基础,因此,该手术有进一步行前瞻性大样本研究的意义。
综上所述,经腹腔镜胰后入路脾托出式脾门淋巴结清扫术是基于良好解剖平面的手术方式,其结合了腹腔镜胃癌根治及开腹托出式脾门淋巴结清扫术的各自优点,能减少手术时间,降低手术出血量,增加脾门淋巴结的清扫率,不增加术后恢复时间,有较好的近期生存率,在技术上值得推广。
[参考文献]
[1] Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2014(ver.4)[J].Gastric Cancer,2017,20(1):1-19.doi:10.1007/s10120-016-0622-4.
[2] Lee KY,Noh SH,Hyung WJ,et al.Impact of splenectomy for lymph node dissection on long-term surgical outcome in gastric cancer[J].Ann Surg Oncol,2001,8(5):402-406.doi:10.1245/aso.2001.8.5.402.
[3] Sano T,Yamamoto S,Sasako M,et al. Randomized controlled trial to evaluate splenectomy in total gastrectomy for proximal gastric carcinoma:Japan clinical oncology group study JCOG 0110-MF[J].Jpn J Clin Oncol,2002,32(9):363-364.
[4] Wang JB,Huang CM,Zheng CH,et al.Laparoscopic spleen-preserving No.10 lymph node dissection for advanced proximal gastric cancer in left approach: a new operation procedure[J].World J Surg Oncol,2012,10:241.doi:10.1186/1477-7819-10-241.
[5] 韩方海,曹鸿峰,张肇达,等.胃癌手术中清扫No.10组及No.11组淋巴结与保留脾脏问题[J].中国普外基础与临床杂志,2003,10(2):176-178.doi:10.3969/j.issn.1007-9424.2003.02.037.
[6] Maruyama K,Okabayashi K,Kinoshita T.Progress in gastric cancer surgery in Japan and its limits of radicality[J].World J Surg,1987,11(4):418-425.doi:10.1007/bf01655804.
[7] Bonenkamp JJ,Hermans J,Sasako M,et al.Extended lymph-node dissection for gastric cancer[J].N Engl J Med,1999,340(12):956-958.doi:10.1056/NEJM199903253401210.
[8] Aoyagi K,Kouhuji K,Miyagi M,et al.Prognosis of metastatic splenic hilum lymph node in patients with gastric cancer after total gastrectomy and splenectomy[J].World J Hepatol,2010,2(2):81-86.doi:10.4254/wjh.v2.i2.81.
[9] Association JGC.Japanese gastric cancer treatment guidelines 2014(ver. 4)[J].Gastric Cancer,2017,20(1):1-19.doi:10.1007/s10120-016-0622-4.
[10] Bo T,Peiwu Y,Feng Q,et al.Laparoscopy-assisted vs. open total gastrectomy for advanced gastric cancer:long-term outcomes and technical aspects of a case-control study[J].J Gastrointest Surg,2013,17(7):1202-1208.doi:10.1007/s11605-013-2218-1.
[11]黄昌明,曹龙龙.进展期胃上部癌腹腔镜保脾脾门淋巴结清扫术的难点与争议[J].中华消化外科杂志,2017,16(8):787-790.doi:10.3760/cma.j.issn.1673-9752.2017.08.005.
[12] Hyung WJ,Lim JS,Song J,et al.Laparoscopic spleen-preserving splenic hilar lymph node dissection during total gastrectomy for gastric cancer[J].J Am Coll Surg,2008,207(2):e6-11.doi:10.1016/j.jamcollsurg.2008.04.027.
[13] 胡 林,李昌荣,李红浪.不同入路的脾门区淋巴结清扫在腹腔镜胃癌根治术中的应用进展[J].中华外科杂志,2015,53(5):392-395.doi:10.3760/cma.j.issn.0529-5815.2015.05.018.
[14] Okabe H,Obama K,Kan T,et al.Medial approach for laparoscopic total gastrectomy with splenic lymph node dissection[J].J Am Coll Surg,2010,211(1):e1-e6.doi:10.1016/j.jamcollsurg.2010.04.006.
[15] Huang CM,Zhang JR,Zheng CH,et al.A 346 case analysis for laparoscopic spleen-preserving no.10 lymph node dissection for proximal gastric cancer:a single center study[J].PloS One,2014,9(9):e108480.doi:10.1371/journal.pone.0108480.
[16] 李国新,牟廷裕,余 江,等.胰后入路保留胰脾的原位脾门淋巴结清扫在腹腔镜胃癌根治术中的应用[J].中华消化外科杂志,2012,11(1): 58-60.doi:10.3760/cma.j.issn.1673-9752.2012.01.017.
[17] 万相斌,任莹坤,韩广森,等.逆行腹膜后入路托出式脾门淋巴结清扫在胃癌根治术中应用价值[J].中国实用外科杂志,2009,29(10):839-841.doi:10.3321/j.issn:1005-2208.2009.10.017.
[18] 罗光辉,丁自海,李忠华,等.脾脏血管的应用解剖学研究进展与保脾治疗现状[J].广东医学,2011,32(2):256-259.doi:10.3969/j.issn.1001-9448.2011.02.052.
[19] 吴 涛,李国新,丁自海,等.腹腔镜下远端胃癌根治术中胃背系膜及系膜间隙的解剖形态特点[J].中国临床解剖学杂志,2007,25(3):251-254.doi:10.3969/j.issn.1001-165X.2007.03.006.
[20] 季加孚,李子禹.胃癌根治术中脾门淋巴结清扫的彻底性与脾脏损伤的风险[J].中国实用外科杂志,2008,28(6):508-509.doi:10.3321/j.issn:1005-2208.2008.06.031.
[21] Huang CM,Chen T,Lin JX,et al.The effects of laparoscopic spleen-preserving splenic hilar lymphadenectomy on the surgical outcome of proximal gastric cancer:a propensity score-matched,case-control study[J].Surg Endosc,2017,31(3):1383-1392.doi:10.1007/s00464-016-5126-0.
[22] 篠原尚,水野惠文,牧野尚彦,等.图解外科手术:从膜的解剖解读术式要点[M].第3版.沈阳:辽宁科学技术出版社,2013:98-99.
[23] 黄昌明,郑朝辉.腹腔镜胃癌根治术淋巴结清扫技巧[M].北京:人民卫生出版社,2015:1-180.
