经皮穿刺置管引流术在急性胰腺炎合并坏死感染中的治疗效果
2018-05-03,,,
, ,,
(厦门大学附属东南医院暨解放军第175医院急诊科,福建 漳州 363000)
急性胰腺炎(acute pancreatitis,AP)合并坏死感染时,经皮穿刺置管引流术(percutaneous catheter drainage,PCD)是最为常用的初始治疗手段之一。但是,目前国内外报道的PCD临床效果存在较大差异,PCD后仍需接受手术(内镜或开放)清创引流的比例为20%~50%,病死率为4%~29%[1-2]。造成以上差异的原因可能在一定程度上与国内外学者实施PCD过程中的技术策略不尽相同有关,比如PCD放置引流数目、引流管孔径、PCD次数、首次与后续PCD时间间隔等方面尚缺乏统一标准[3-4]。近来,有回顾性临床研究显示AP合并感染性坏死时采用积极的PCD策略,即早期、多次、多处调整引流管或更换大孔径引流管,比相对保守的PCD策略可以降低需要外科手术干预的比例,并可能有助于改善临床结局[5-6]。为进一步验证积极PCD策略的临床安全性和有效性,本研究开展了这项前瞻性临床对照研究。
1 资料与方法
1.1 临床资料
收集2016年1月至2017年11月我院经PCD治疗的70例AP合并坏死感染患者的临床资料。诊断标准参照2013版《中国急性胰腺炎诊治指南》[7]。纳入标准:①符合AP诊断标准,诊断为坏死性AP;②证实或可疑合并胰腺或胰周坏死感染;③接受PCD治疗。排除标准:①年龄小于18岁;②直接行内镜下微创引流或手术清创者;③所需临床和影像学资料不全者。最终纳入70例AP合并坏死感染患者,其中男48例、女22例,平均年龄(49.5±13.8)岁;病因学诊断:胆石症40例、酒精14例、高三酰甘油血症12例、其他4例。患者入院后,立即完善病史、体格检查、实验室检查和辅助检查,尽快作出病情评估和病因学诊断,治疗原则遵循2013版《中国急性胰腺炎诊治指南》[7],胆源性AP或伴有感染的中重度AP常规使用抗菌药物,胆源性AP早期行内镜下治疗。按照随机数字表法分为常规组和改良组,每组35例。2组患者人口学特征、病因学诊断、临床和影像学指标等一般资料比较,差异无统计学意义(P>0.05),见表1。本研究通过医院医学伦理委员会批准,患者或家属签署知情同意书。
1.2 首次PCD指征与总体原则
2组患者遵循同样的PCD指征,通过临床表现、CT或彩超影像学和实验室检查综合评估,证实或怀疑AP出现感染性液体积聚或/和感染性坏死时实施PCD治疗。患者在局部麻醉下,经彩超引导行PCD,根据彩超和CT影像学检查结果,综合考虑感染灶部位、范围、个数等情况,决定选择经腹膜后还是经腹腔路径穿刺。使用10.2 Fr穿刺针,采用扩张器逐级扩张针道,视感染灶范围、数目等情况决定放置1根或多根引流管,首次PCD原则上以放置小孔径(12~14 Fr)引流管为主。PCD临床效果评价标准:有效定义为PCD操作后患者病情稳定,即脓毒症无反复或加重、临床症状改善;临床无效定义为PCD操作后患者病情无改善或出现进展,即脓毒症反复或加重,临床症状无改善或进一步恶化。PCD后影像学评价:感染灶范围较前缩小75%以上为显效,感染灶范围较前缩小30%~75%为有效,感染灶范围较前缩小30%以下或较前增大为无效。
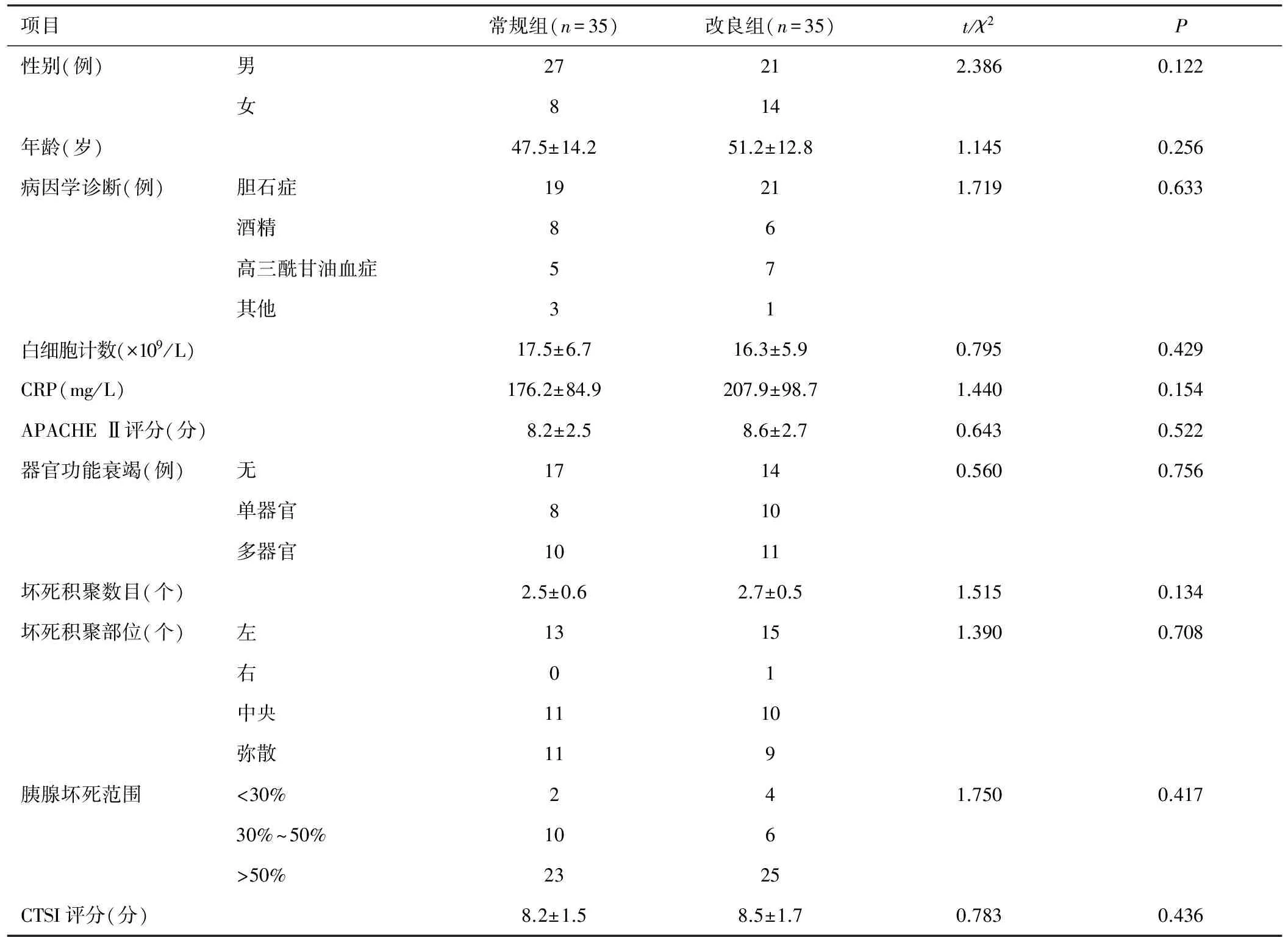
表1 2组基线资料比较(n=70)
1.3 分组干预
2组完成首次PCD后,视病情是否稳定和CT评估引流效果情况,采取不同的处理策略。常规组:①首次PCD后病情稳定,10~14 d后复查CT显示感染灶较前缩小75%以上者,不进一步处理;②首次PCD后病情持续恶化,或者尽管病情稳定但复查CT显示感染灶较前缩小75%以上者,则再行1次PCD(调整引流管位置或更换大孔径引流管);③再次PCD后临床和影像学有效,则不进一步处理,若仍PCD无效则直接改行手术清创引流(腹腔镜、肾镜或开放手术)。改良组:①首次PCD后病情稳定,7 d左右复查CT显示感染灶较前缩小75%以上者,不进一步处理;②首次PCD后病情持续恶化,或者尽管病情稳定但复查CT显示感染灶较前缩小75%以上者,则采取早期、多次、多处调整引流管或逐级更换大孔径引流管的积极策略,直至无效手术改行清创引流,原则上PCD总次数大于2次但不超过5次。改良组典型病例影像学资料见图1。
1.4 观察指标
观察指标有:①PCD相关指标,包括患者首次PCD相关指标(发病至首次PCD天数、首次PCD引流管孔径、首次PCD引流数目、首次PCD穿刺路径、引流液培养结果)、患者全部PCD相关指标(PCD总次数、前两次PCD间隔时间、引流管最大孔径、引流天数);②其他干预情况,统计2组患者经1次PCD治愈比例、最终需要手术清创引流干预的比例;③住院指标,统计2组患者自首次PCD后住院天数、再发多器官功能衰竭、ICU再入住率、出院30 d内再次住院率、病死率;④并发症情况,统计2组患者首次PCD后,发生需要干预(有创干预或输血治疗)的出血比例、胰瘘、肠瘘发生情况。
1.5 统计学处理
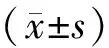
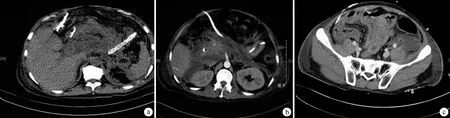
a:右上腹和左上腹分别放置Fr16和Fr20孔径引流管;b:右上腹放置Fr16孔径引流管;c:右下腹放置Fr12孔径引流管
2 结果
2.1 2组患者PCD相关指标比较
2组患者首次实施时间、穿刺路径、引流管孔径、放置引流数目、引流液培养结果等比较,差异均无统计学意义(P>0.05)。2组患者全部PCD比较,改良组接受PCD总次数、最终放置引流管的最大孔径显著高于常规组(P<0.05或P<0.01),改良组前两次PCD时间间隔显著短于常规组(P<0.01),但2组引流总天数差异无统计学意义(P>0.05),见表2。
2.2 2组患者PCD后接受其他干预和住院指标比较
改良组和常规组患者中经1次PCD治愈的比例分别为14.3%和11.4%,差异无统计学意义(P>0.05)。改良组患者PCD后需要接受手术清创干预的比例和再发多器官功能衰竭的比例显著低于常规组,差异均具有统计学意义(P<0.05)。2组在首次PCD后住院天数、ICU再入住、再住院及病死率方面,差异无统计学意义(P>0.05),见表3。
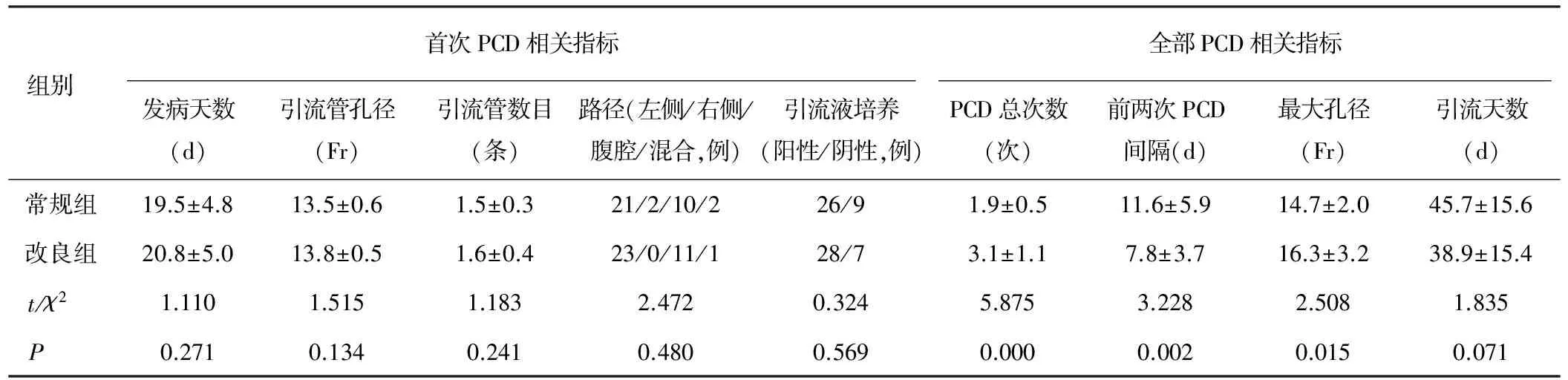
表2 2组患者PCD相关指标比较(n=35)
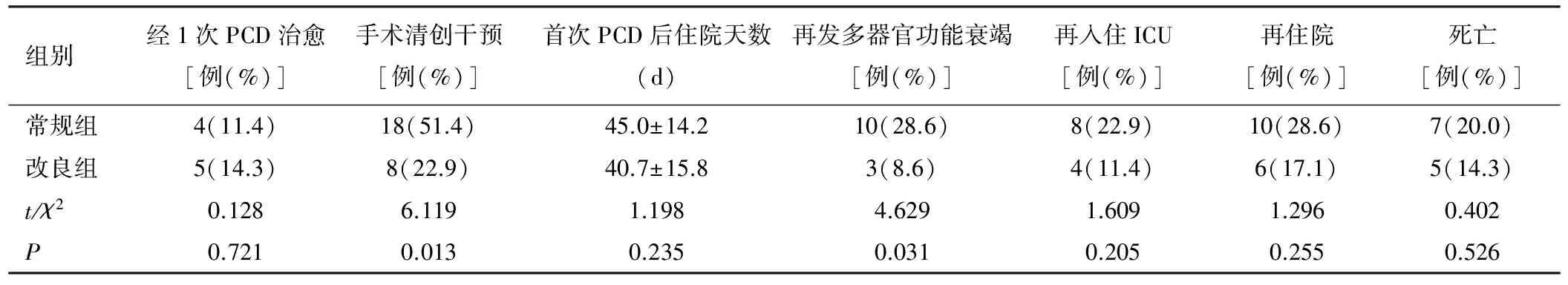
表3 2组患者PCD后接受其他干预和住院指标比较(n=35)
2.3 2组患者PCD后并发症指标比较
11例患者发生腹腔出血,其中6例经手术成功止血,5例经介入、输血和药物治愈。12例发生胰瘘,其中经非手术治愈8例、经内镜下治愈3例、经外科手术治愈1例。3例发生十二指肠瘘,经保守治疗治愈。2组患者PCD后出血、胰瘘、肠瘘等并发症发生情况比较,差异无统计学意义(P>0.05),见表4。
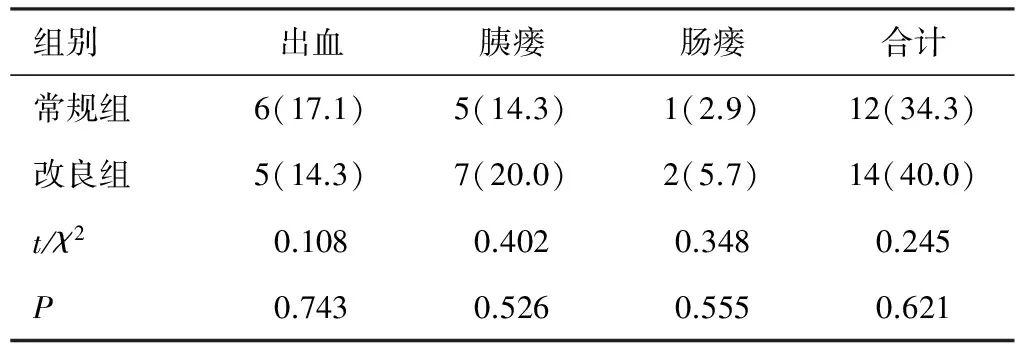
表4 2组患者并发症指标比较[n=35,例(%)]
3 讨论
目前,AP升阶梯治疗方案已在国际上得到认可和普遍推广,PCD被认为是AP升阶梯方案中重要的治疗措施之一。但是,目前国内外AP相关指南中也大多只提及AP局部并发症合并感染时首选PCD引流,当引流效果差时进一步行外科手术,可是在PCD技术策略方面缺乏具体描述,没有太多可供参考的细节内容[7-8]。2017年《浙江省重症急性胰腺炎诊治专家共识》中也仅指出首次PCD后若感染灶缩小范围小于75%或病情仍持续恶化,可在后续PCD时增加引流管孔径直至28~30 Fr[9]。
既往研究显示,影响PCD治疗效果的因素可能包括:性别、胰腺坏死范围、胰腺或胰周感染灶数目部位、感染灶内部构成成分及是否均质、器官功能衰竭、高CTSI评分等[10-11]。Sugimoto等[5]通过一项回顾性临床研究发现采取早期、积极的PCD策略显著降低了器官功能衰竭发生率、需要接受胰腺坏死清创引流术的比例和病死率,改善临床结局。有学者回顾性比对了42例接受积极PCD策略(多次PCD、逐级更换大孔径引流管)和75例采用标准PCD策略的急性坏死性胰腺炎继发感染患者的临床资料,虽然并未见积极PCD策略可以显著改善临床结局(病死率),但同样验证了积极PCD策略显著降低需要接受胰腺坏死清创引流手术的比例[6]。本研究采用前瞻性随机对照研究设计,发现早期、多次、多处调整引流或逐级更换大孔径引流管的积极PCD策略较常规的PCD策略而言,可以显著降低AP合并坏死感染患者外科手术干预率、再发多器官功能衰竭的风险。积极的PCD策略有助于早期控制AP感染性坏死,进而最大限度维护脏器功能,避免升阶梯的外科手术清创引流干预。
笔者认为,除了患者及感染灶本身的因素以外,PCD的不同策略,如引流时机、穿刺路径、引流数目、引流管孔径,首次PCD治疗效果不佳时后续PCD的时机、调整以及PCD的总次数等,也可能在不同程度影响PCD治疗效果。但是,目前尚缺乏相关内容的系统探讨,PCD操作相关的策略和细节内容仍未形成统一规范的标准。关于引流管孔径方面,国内外报道的PCD中使用型号从8~28 Fr不等,而目前最为常用的型号为14 Fr,来自于2010年《N Engl J Med》杂志的一项随机对照临床研究证据显示,使用14 Fr孔径引流管进行1~2次PCD可治愈35%(15/43)的急性坏死性胰腺炎继发感染,使其避免胰腺清创引流手术[12]。截至目前,这一PCD方案仍被目前视为标准策略。理论上引流管孔径越大,发生堵管的风险越低,液体、固体和碎屑样坏死物被彻底引流的可能性越大,但是既往研究并未发现引流管孔径是影响PCD治疗效果的因素[9],近期有学者的研究结果则支持使用大孔径引流管可以提高PCD治疗效果[6]。最近,一项针对87位国际胰腺疾病专家的调查显示,67%的专家认为增加PCD引流管孔径是提高效果的一种有利措施,58%的专家推荐在急性胰腺炎早期(发病14 d内)进行预防性干预以降低坏死感染的发生率,59%的专家推荐在急性胰腺炎中期(发病20 d内)出现临床可疑坏死感染时进行积极干预[13]。可见,近年来积极的PCD策略正在逐渐引起国内外学者的重视,目前国际前瞻性临床研究POINTER试验和TENSION试验均正在开展中,旨在对首次PCD治疗时机重新评估[14-16]。通常AP患者出现急性坏死物积聚时不推荐立即行PCD,而是要等待包裹性坏死形成后才考虑PCD,但这种做法并无循证医学证据。由于这一等待过程往往需要4周左右的时间,是否由此延误了最佳引流时机而导致病情进展,这些问题正在被重新审视[17-19]。本研究中,采用积极的PCD策略,通过早期(缩短前两次PCD时间间隔)、多次(PCD次数超出既往理念推荐的1~2次)、多处(多处放置引流)调整引流或逐级更换大孔径引流管,最终降低了需要接受胰腺坏死清创引流术的比例和再发多器官功能衰竭的比例,这与增加PCD总次数和引流管孔径以及缩短前两次PCD时间间隔有关。因此,笔者认为在AP合并坏死感染的PCD治疗中,可以尝试采取更为积极的策略,一方面要提早PCD干预时机,并及时通过CT等手段积极评估PCD效果,缩短PCD术后效果不佳时的观察等待时间,及时再行PCD,以期尽早控制坏死感染,减轻脓毒血症,改善患者临床症状;另一方面,首次PCD后,早期、多次、多处调整引流或逐级更换大孔径引流管的策略,1~2次PCD后效果不佳,仍然可以根据具体情况及时调整PCD策略后再行PCD,通常可以达到较好的PCD引流效果,降低外科手术干预率和再发器官功能衰竭的风险。通过积极的PCD策略尽早控制坏死感染、减轻病情严重程度、避免外科手术带来的创伤,进而对降低住院时间和改善预后具有潜在的意义[20-22]。
综上所述,AP合并坏死感染经PCD引流效果不佳时,通过采取早期、多次、多处调整引流管或逐渐更换大孔径引流这一改良的积极PCD策略,可以降低再发多器官功能衰竭和需要接受胰腺坏死清创引流的比例,且并未增加相关并发症风险。但是,本研究也存在一定局限性,比如病例数相对较少、仍属单中心研究,可能在一定程度上存在偏倚并影响研究结果,笔者建议今后开展多中心、前瞻性随机对照临床研究来进一步探讨PCD相关的策略和具体细节,以形成可供参考和推广的标准和规范。
[参考文献]
[1] van Baal MC,van Santvoort HC,Bollen TL,et al.Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis[J].Br J Surg,2011,98(1):18-27.doi:10.1002/bjs.7304.
[2] Kumar N,Conwell DL,Thompson CC.Direct endoscopic necrosectomy versus step-up approach for walled-off pancreatic necrosis:comparison of clinical outcome and health care utilization[J].Pancreas,2014,43(8):1334-1339.doi:10.1097/MPA.0000000000000213.
[3] Hollemans RA,Grinsven JV,Besselink MG,et al.Re:Better outcomes if percutaneous drainage is used early and proactively in the course of necrotizing pancreatitis[J].J Vasc Interv Radiol,2016,27(12):1936.doi:10.1016/j.jvir.2016.05.012.
[4] van Grinsven J,van Santvoort HC,Boermeester MA,et al.Timing of catheter drainage in infected necrotizing pancreatitis[J].Nat Rev Gastroenterol Hepatol,2016,13(5):306-312.doi:10.1038/nrgastro.2016.23.
[5] Sugimoto M,Sonntag DP,Flint GS,et al.Better outcomes if percutaneous drainage is used early and proactively in the course of necrotizing pancreatitis[J].J Vasc Interv Radiol,2016,27(3):418-425.doi:10.1016/j.jvir.2015.11.054.
[6] van Grinsven J,Timmerman P,van Lienden KP,et al.Proactive versus standard percutaneous catheter drainage for infected necrotizing pancreatitis[J].Pancreas,2017,46(4):518-523.doi:10.1097/MPA.0000000000000785.
[7] 中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(2013,上海)[J].中华胰腺病杂志,2013,13 (2) :73-78.doi:10.3760/cma.j.issn.1674-1935.2013.02.001.
[8] Banks PA,Bollen TL,Dervenis C,et al.Classification of acute pancreatitis-2012:revision of the Atlanta classification and definitions by international consensus[J].Gut,2013,62(1):102-111.doi:10.1136/gutjnl-2012-302779.
[9] 浙江省医学会重症医学分会.浙江省重症急性胰腺炎诊治专家共识[J].浙江医学,2017,39(14):1131-1150.
[10] Hollemans RA,Bollen TL,van Brunschot S,et al.Predicting success of catheter drainage in infected necrotizing pancreatitis[J].Ann Surg,2016,263(4):787-792.doi:10.1097/SLA.0000000000001203.
[11] Ke L,Li J,Hu P,et al.Percutaneous catheter drainage in infected pancreatitis necrosis:a systematic review[J].Indian J Surg,2016,78(3):221-228.doi:10.1007/s12262-016-1495-9.
[12] van Santvoort HC,Besselink MG,Bakker OJ,et al.A step-up approach or open necrosectomy for necrotizing pancreatitis[J].N Engl J Med,2010,362(16):1491-1502.doi:10.1056/NEJMoa0908821.
[13] van Grinsven J,van Brunschot S,Bakker OJ,et al.Diagnostic strategy and timing of intervention in infected necrotizing pancreatitis:an international expert survey and case vignette study[J].HPB(Oxford),2015,18(1):49-56.doi:10.1111/hpb.12491.
[14] Isrctn Registry.Postponed or immediate drainage of infected necrotizing pancreatitis(POINTER trial)[P/OL].http://dx.doi.org/10.1186/ISRCTN33682933(2015).
[15] van Brunschot S,van Grinsven J,Voermans RP,et al.Transluminal endoscopic step-up approach versus minimally invasive surgical step-up approach in patients with infected necrotising pancreatitis(TENSION trial):design and rationale of a randomised controlled multicenter trial[ISRCTN09186711][J].BMC Gastroenterol,2013,13:161.doi:10.1186/1471-230X-13-161.
[16] 芦 波,薛华丹,赖雅敏,等.感染性坏死对急性胰腺炎不良预后的影响[J].中华消化杂志,2017,37(4):244-248.doi:10.3760/cma.j.issn.0254-1432.2017.04.005.
[17] 吴 东,钱家鸣.急性胰腺炎合并感染性坏死的诊治策略[J].中华胰腺病杂志,2017,17(4):271-273.doi:10.3760/cma.j.issn.1674-1935.2017.04.017.
[18] Zerem E.Treatment of severe acute pancreatitis and its complications[J].World J Gastroenterol,2014,20(38):13879-13892.doi:10.3748/wjg.v20.i38.13879.
[19] Boumitri C,Brown E,Kahaleh M.Necrotizing pancreatitis:current management and therapies[J].Clin Endosc,2017,50(4):357-365.doi:10.5946/ce.2016.152.
[20] 杨栋梁,童智慧,柯 路,等.重症急性胰腺炎并发胰腺坏死感染经阶梯式引流模式治疗的患者病死原因及临床特点分析[J].医学研究生学报,2016,29 (11) :1197-1201.doi:10.16571/j.cnki.1008-8199.2016.11.017.
[21] Aparna D,Kumar S,Kamalkumar S.Mortality and morbidity in necrotizing pancreatitis managed on principles of step-up approach:7 years experience from a single surgical unit[J].World J Gastrointest Surg,2017,9(10):200-208.doi:10.4240/wjgs.v9.i10.200.
[22] Cao X,Cao F,Li A,et al.Predictive factors of pancreatic necrosectomy following percutaneous catheter drainage as a primary treatment of patients with infected necrotizing pancreatitis[J].Exp Ther Med,2017,14(5):4397-4404.doi:10.3892/etm.2017.5107.
