Notch信号通路在骨关节炎软骨细胞中的表达及意义
2018-05-03邓月
, , ,,,,,邓月
(四川省骨科医院上肢科,四川 成都 610041)
Notch信号通路是高度保守的细胞间信号传导通路,广泛存在于无脊椎动物及脊椎动物中。Notch信号通路通过配体与受体结合激活,调控细胞的增殖、分化与凋亡,决定细胞的命运,与多种组织、器官、系统的发育及多种疾病密切相关[1-2]。目前证实哺乳动物有4个Notch受体(Notch1~4)和5个Notch配体(Delta1、Delta3、Delta4、Jagged-1、Jagged-2)。骨关节炎(Osteoarthritis,OA)是最常见的退行性关节疾病,具有较高的发病率。有文献报道40岁以下人群的发病率约5%,60岁以上人群中高达50%的人在X射线上有OA表现,75岁以上人群中高达80%的人有OA症状[3-4]。OA晚期导致关节疼痛、畸形和功能障碍,严重影响患者的工作与日常生活,是成年人劳动力丧失的主要原因之一。我国骨关节炎患者可能超过5 000万[4]。Notch信号通路在OA软骨细胞增殖、分化、凋亡、基质合成及维持软骨细胞表型等方面起着十分重要的作用[1-2]。OA关节软骨中异常表达的Notch信号通路与其他OA致病因子共同作用于OA软骨及滑膜等组织,参与OA的整个病变过程[5-6]。但目前Notch配体及受体信号通路在OA中的作用地位及作用机制尚不明确,还需要进一步研究。
本文旨在通过细胞跨膜Notch配体4(delta-like ligand 4,DLL4)和γ-分泌酶抑制剂(DAPT)分别激活和抑制Notch信号通路后,观察体外培养的OA软骨细胞中Notch1、Notch3、Jagged-1、Jagged-2、HES5的表达情况,探索DLL与OA软骨细胞基质合成的关系及其可能的作用机制,从而探索Notch信号通路在骨关节炎病变进程中的作用及其可能的作用机制,为探索骨关节炎早期药物治疗提供理论依据。
1 资料与方法
1.1 临床资料
收集2017年我院8例因膝关节OA行膝关节置换患者的股骨髁软骨作为观察组,再选择1例因外伤行膝上截肢的正常股骨髁软骨作为对照组。收集患者一般资料,根据病史、X射线片、术中肉眼观察、术后镜下病理学等排除标本肿瘤、结核、感染、类风湿炎症、明显骨质疏松,同时排除有免疫系统疾病、糖尿病等全身性疾病患者。观察组8例,男2例,女6例,年龄57~85岁,平均68.1岁;左侧5例,右侧3例。对照组1例,男性,19岁。观察组及对照组取适量软骨组织块放入4%多聚甲醛固定,剩余部分放入DMEM低糖培养基等待细胞培养。培养液为无菌的DMEM低糖培养基(链霉素100 u/mL,青霉素100 u/mL)。细胞培养用100 ng/μL DLL4和20 μmol/L DAPT分别激活和抑制OA软骨细胞Notch信号通路,使用OA软骨细胞+PBS缓冲液作为对照。
1.2 细胞培养
1.2.1 原代培养 取剩余新鲜的软骨组织先后使用0.2%胰蛋白酶、0.2%Ⅱ型胶原酶低糖DMEM溶液、0.2%Ⅱ型胶原酶(sigma)溶液消化,再加入DMEM培养基(含20%胎牛血清,链霉素100 u/mL,青霉素100 u/mL)制成细胞悬液,转入培养皿中,再置于37 ℃、5%CO2饱和湿度培养箱中培养,一般4~6 h后软骨组织块消化完全。观察细胞生长情况,每3 d换液。
1.2.2 传代培养 原代培养细胞覆盖瓶底80%以上时,吸尽培养基,PBS清洗2次后加入0.25%胰蛋白酶,37 ℃、5%CO2孵育箱消化2~3 min,镜下观察待大部分细胞变圆漂浮时,加入20%含胎牛培养基终止消化,1 000 r/min离心3 min后加入适量20%胎牛DMEM培养基重悬,血球计数板计数,104/mL传代接种进入传代培养。同时进行细胞爬片,Ⅱ型胶原免疫组化染色行细胞鉴定。
1.2.3 细胞爬片 盖玻片放置于培养皿中,无菌0.1 mg/mL多聚赖氨酸溶液包被盖玻片后干燥备用,待1代软骨细胞爬满培养瓶80%时,消化收集细胞,所收集的细胞按104~105/mL接种,隔夜待细胞贴壁后按分组加入实验药物,观察细胞生长情况,培养5 d后终止培养待细胞学检测。分组情况如下:①正常组(正常软骨细胞);②OA组(OA软骨细胞+PBS缓冲液);③DAPT组(OA软骨细胞+DAPT 20 μmol/L);④DLL4组(OA软骨细胞+DLL4(DLL4)100 ng/μL)。
1.3 组织学检测
取材后软骨组织用4%多聚甲醛固定24 h后乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)脱钙,石蜡包埋后4 μm切片待组织学检查。分别使用HE染色、甲苯胺蓝染色观察软骨的形态变化。
1.4 免疫组化
免疫组化检测Notch-1、Jagged-1、Jagged-2、HES5、Notch-3在正常软骨细胞及OA软骨细胞中的表达情况。待1代细胞爬满培养瓶80%后,消化收集细胞,收集的细胞按104~105/mL接种于6孔板的盖玻片上,隔夜待细胞贴壁后按分组加入实验药物,培养5 d后终止培养,待下一步细胞学检测。实验步骤:培养5 d终止细胞培养,PBS清洗5 min,3次;4%多聚甲醛固定30 min;PBS清洗5 min,3次;3%H2O2(试剂A)孵育10 min;PBS清洗标本5 min,3次;山羊血清孵育(试剂B)37 ℃,30 min;相应的一抗孵育(滴度1∶200)4 ℃过夜,阴性对照滴加等量的PBS;PBS清洗5 min,3次;二抗工作液孵育37 ℃,30 min;PBS清洗5 min,3次;滴加辣根酶标记的链霉卵白素工作液孵育30 min;PBS清洗5 min,3次;DAB显色,3~10 min;自来水冲洗;苏木素复染,盐酸酒精分化,自来水冲洗。梯度酒精脱水、二甲苯透明、中性树胶封片。显微镜观察、读片,记录实验结果。
1.5 Western blot蛋白印记技术
细胞培养及实验处理:OA软骨细胞培养瓶弃培养基,漂洗细胞2次,去尽残留培养基。加入1X SDS样品缓冲液(每孔100 μL,每瓶500~1 000 μL),刮落细胞,转移到Ep管;蛋白裂解溶液的配制:Laemmli样品缓冲液950 μL,加入2-硫基乙醇50 μL,混匀;蛋白裂解:取收集的细胞,每 1X 细胞加入100 μL蛋白裂解液,反复吹打,使细胞充分裂解,样本经100金属浴变性,高速离心,-20 ℃保存。Western blot聚丙烯酰胺凝胶电泳:安装配好胶配制,定好分离胶位置,配制分离胶(12%)、浓缩胶,将已准备好的蛋白样品置于100金属浴中煮沸变形5 min,高速离心,备用。将配置好的胶放入电泳槽里,拔去梳子,加入电泳缓冲液,使之没过胶,用加样器吸取10 μL样品缓慢加入泳道,其中一空加预染的蛋白分子量Marker。将电泳装置与电源相连,恒压80 V 30 min,恒压110 V。蛋白膜转移:取出凝胶,去除浓缩胶成分,置于转膜缓冲液中,轻轻晃5 min,剪下与凝胶相同大小的PVDF膜,按梳子的齿列顺序用铅笔轻轻标记好泳道,甲醇中浸没10 s,然后放入转膜缓冲液中轻轻摇晃10 min。去除电泳转移夹,按阴极(黑色)、海绵垫、滤纸(3~4层)、凝胶、PVDF膜、滤纸、海绵垫、阳极(红色)的顺序做好,注意PVDF膜上的序号应与胶的泳道相对应,凝胶和PVDF膜之间不要有气泡。放置好后置于转移槽中,加入足量的转膜缓冲液,使其完全浸泡在转膜缓冲液中,并在转移槽的四周用碎冰覆盖,接上电源,恒流240 mA,2.5 h。转膜结束,去除PDVF膜,TBS溶液洗3次(每次5 min),凝胶可用考马斯亮蓝染色30 min,然后清水浸泡,观测转膜的效率。免疫杂交:将洗好的PDVF膜置于塑料盒中,加入适量的5%脱脂牛奶,置于摇床轻轻摇晃2 h。倒去封闭液,用TBS/T溶液洗3次(每次10 min)将膜置于封口袋,注意此过程戴手套,且尽量不用手接触PDVF膜,加入牛奶稀释的(浓度1∶1 000)的一抗,封口后置于摇床上室温缓慢摇晃孵育4~6 h或置于4 ℃过夜。将PDVF膜置于塑料盒中,TBS/T溶液洗3次,10 min。将膜置于封口袋,加入牛奶稀释的(浓度1∶5 000)辣根过氧化物酶标记的二抗(山羊抗兔),室温缓慢摇晃2 h。将PDVF膜置于塑料盒中,用TBS/T溶液洗3次(每次10 min)。化学发光法显带:配制ECL显色液配制,将显色液均匀地滴在PVDF膜上,使显色液与膜充分反应。将PVDF膜置于Bio-Rad凝胶成像仪成像。
1.6 评价方法
免疫组化结果评价方法:观察细胞染色强度A及阳性细胞率B。染色强度A得分方法:0(阴性),1(弱阳性,轻度黄色,棕黄色颗粒),2(中度阳性,棕黄色颗粒),3(强阳性,棕褐色)。阳性细胞率B得分计分方法:0计为0分,≤25%计为1分,25%~50%计为2分,≥51%计为3分。AXB得分计为总得分0~9分,总得分0分计为阴性,1~2分计为弱阳性,3~8分计为中度阳性,9分计为强阳性。
Western blot蛋白印记技术结果评价方法:利用Quantity one分析软件,在考虑到内参蛋白的灰度值后,对目的条带的灰度值进行分析比较。
1.7 统计学处理
2 结果
2.1 OA软骨的HE及甲苯胺蓝染色
OA软骨HE染色,关节软骨表层粗糙,软骨细胞数量减少,软骨细胞固缩,排列紊乱,放射层部分软骨细胞集簇成团,软骨基质内可见空的软骨陷窝,基质染色深浅不一。OA软骨甲苯胺蓝染色,表面不整齐,排列紊乱染色深浅不一,放射层颜色较正常软骨组织浅。
2.2 Notch1、Notch3、Jagged-1、Jagged-2、HES5的表达
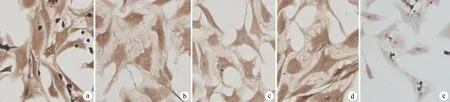
在正常软骨细胞组中,Notch-1呈弱阳性表达;Jagged-1、Notch-3呈阴性表达;HES5、Jagged-2有表达,但是很不明显(图1)。在OA软骨细胞组中,Notch1、HES5呈强阳性表达;Jagged-1、Jagged-2呈中度阳性表达;Notch-3呈弱阳性表达(图2)。在DAPT组软骨细胞中,Notch-1呈弱阳性表达,与OA组比较Notch-1表达量明显下调;Jagged-1仍呈中度阳性表达,较OA组染色变浅,表达量下调;Jagged-2呈强阳性表达,较OA组表达情况可能有上调或者不变;HES5仍呈强阳性表达,与OA组比较,HES5表达量下调;Notch-3仍呈弱阳性表达,较OA表达量下调(图3)。
在DLL组软骨细胞中,Notch-1染色深度明显加强,呈强阳性表达,与OA组比较Notch-1表达量明显上调;Jagged-1呈中度阳性表达,与OA组比较,Jagged-1表达量无明显变化;Jagged-2较OA组比较,染色明显加深,呈强阳性表达,表达上调;HES5仍呈强阳性表达,与OA组比较,染色变深,HES5表达上调;Notch-3仍呈弱阳性表达,与OA组比较Notch-3表达量无明显变化(图4)。
2.3 Western blot蛋白质印迹
免疫组化实验完成后,下一步Western blot技术半定量检测OA软骨细胞中Notch-1、Jagged-1、Jagged-2、HES5、Notch-3的表达情况。Nocth-1表达量:DLL组>OA组>DAPT组,OA软骨细胞中Notch-1大量表达,重组人Delta4蛋白干预后,Notch-1表达量显著上调,γ-分泌酶抑制剂DAPT干预后,Notch-1表达量明显下调,表达情况的变化与免疫组化结果类似。Jagged-1在DLL组以及OA组反应带着色相近,在DAPT组略有变浅并模糊,表明Jagged-1在OA软骨中大量表达,重组人Delta4蛋白干预后,Jagged-1表达含量未出现明显的下调或上调,γ-分泌酶抑制剂DAPT干预后,Jagged-1表达量有下调,这与免疫组化结果有相近之处。Jagged-2在3个组别中的反应条带未出现明显大的差异变化,免疫组化结果显示在OA软骨细胞组、DAPT组、DLL组中均成强阳性表达,Western blot检查结果与免疫组化结果基本相似。HES5表达量:DLL组>OA组>DAPT组,OA软骨细胞中HES5存在大量表达,重组人Delta4蛋白干预后,HES5表达量上调,γ-分泌酶抑制剂DAPT干预后,HES5下调,DAPT抑制HES5的表达。Notch-3的三个反应条带,PBS组与DLL组着色均模糊无明显差别,说明Notch-3在OA软骨细胞以及DLL干预后,表达量无明显变化,DAPT组无反应条带的出现,推测使用γ-分泌酶抑制剂DAPT干预,Notch-3明显下调,与免疫组化结果相似(见图5)。

a:Notch-1;b:Jagged-1;c:Jagged-2;d:HES5;e:Notch-3
a:Notch-1;b:Jagged-1;c:Jagged-2;d:HES5;e:Notch-3

a:Notch-1;b:Jagged-1;c:Jagged-2;d:HES5;e:Notch-3
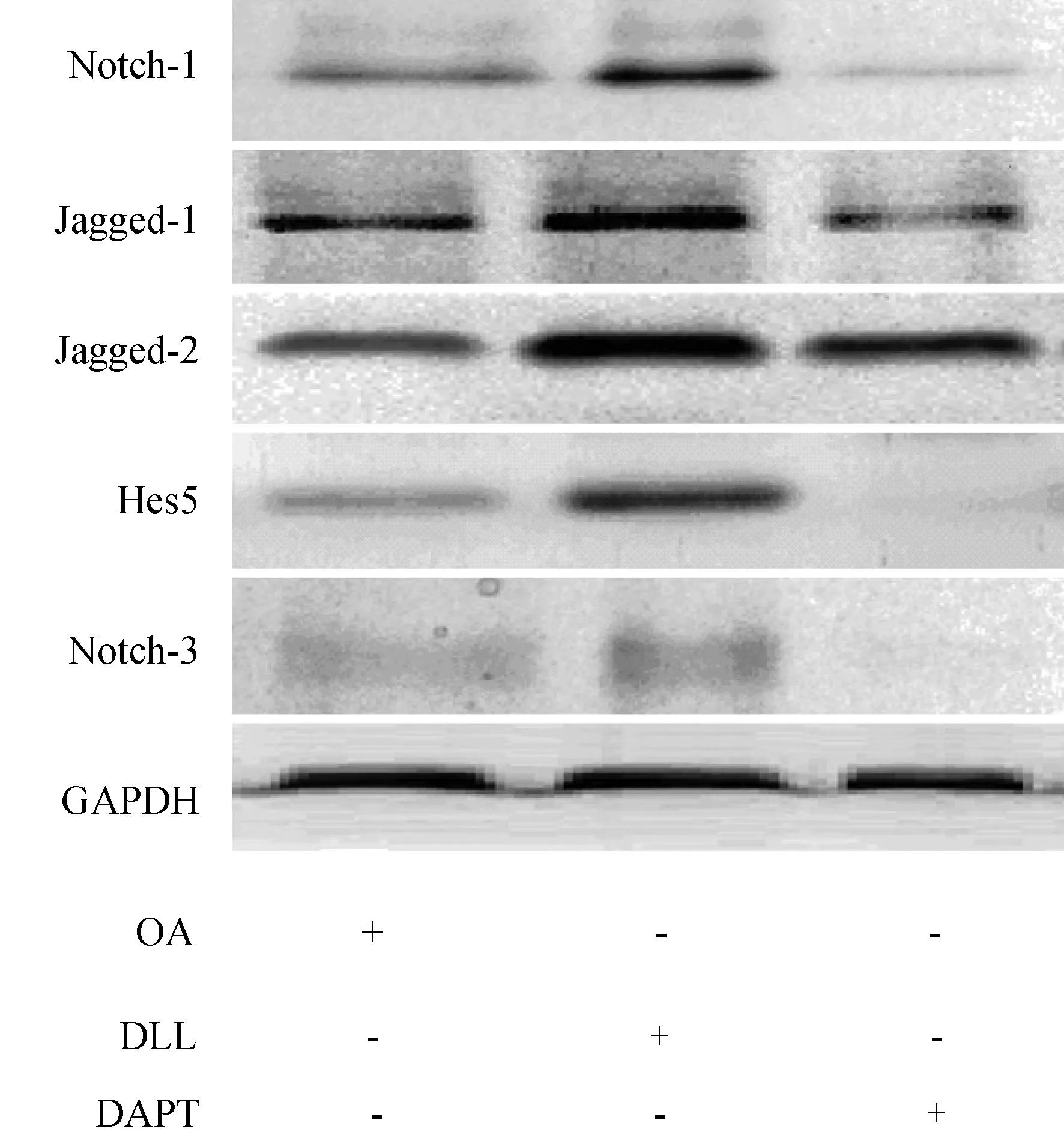
图5 Western blot蛋白印迹
3 讨论
原发性OA的病因不明,发病与年龄、性别、职业、种族、肥胖、遗传等多种因素有关[4,7]。OA发病机制目前尚不明确,多种信号通路、基因、细胞因子、趋化因子、蛋白酶等参与OA的病变过程[8],在软骨基质降解过程中存在着多种信号通路、基因、蛋白酶、细胞因子等生物学因素的参与。Notch信号通路在多种动物及人软骨发生、发育过程中表达并起着十分重要的作用[9]。Notch信号通路参与软骨的发生、发育,与软骨细胞的增殖、分化、凋亡密切相关[1,2,10-11]。Notch信号通路在OA软骨中的表达水平变化[6],说明Notch信号通路可能密切参与OA的病变过程。既往报道显示Notch信号通路在对软骨基质的合成代谢和分解代谢都起着重要作用[10]。Mirando等[11]和Liu等[12]的研究均显示,丢失了Notch信号通路的关节软骨表现出类似于OA的病理过程,提示Notch信号通路在关节软骨的表型维持上是必不可少的。Notch信号通路作用十分广泛,除了经典的DNA结合蛋白(C-promoter-binding factor-1,CBF1)依赖的信号传导途径外,还存在独立CBF1的Notch信号传导通路[13-14]。研究表明Notch同时抑制DLX4基因的表达和促进TNFRSF10C的表达,而DLX4抑制细胞凋亡,TNFRSF10C促进细胞凋亡[5]。OA中软骨集簇细胞中较多细胞Notch表达阳性[15]。还有学者认为Notch信号高表达可能是软骨细胞表型改变的结果[5,15-16]。本组结果发现Notch信号通路表达水平在OA中发生变化,软骨细胞表型改变,Notch-1、Jagged-1、Jagged-2、HES5大量表达。γ-分泌酶抑制剂DAPT干预Notch信号通路后,抑制OA软骨细胞中Notch-1、HES5、Jagged-1、Notch-3的表达,对Jagged-2的表达作用不明显。重组人Delta4蛋白干预Notch信号通路后,促进Notch-1、Jagged-2、HES5的表达增加,对Jagged-1、Notch-3作用不太明显。
Karlsson等[5]发现Notch-1、Jagged-1和HES5在OA软骨中表达范围较正常软骨中的表达范围明显扩大。Notch1阳性率与OA软骨Outerbridge分级相关,随着软骨退变的加重,浅层及中层软骨细胞Notch1阳性率增高,深层软骨细胞Notch1阳性率降低。同时发现,基质金属蛋白酶13(MMP13)与OA软骨细胞HES5表达呈正相关,阻断Notch信号可以下调MMP13的表达。本实验证实γ-分泌酶抑制剂DAPT可抑制OA软骨细胞中HES5的表达,提示DAPT可通过MMP13途径改变软骨基质代谢。Karlsson等[17]又通过软骨培养发现Notch-1、Notch-2、Notch-3、Jagged-1、Jagged-2、Delta-1和Delta4在单层培养中表达。三维培养中Notch-1、Notch-2、Notch-3、Jagged-1、Delta-1和HES5表达明显减少,并且无明确定位表达现象。Notch-2和Delta4在前7 d表达无明显下降,且在7~14 d时升高。最近一项研究同样显示Notch信号通路的另一重要配体HES1可以诱导MMP13等分解代谢因子[13]。Liu等[18]的实验证实Notch-1可分别于体内和体外独立激活包括IL-6在内的多种炎性因子参与OA病理过程。本次实验的DAPT与DLL均可对OA软骨中的Notch-1产生明显的作用,可能为潜在的治疗药物。
其他细胞因子也对Notch信号通路起调节作用,例如IL-1β和TNF-α抑制正常及OA软骨细胞Notch-3、Jagged-1、HES5的表达,其中IL-1β轻度抑制其表达,TNF-α明显抑制Notch-1表达。IL-1β明显增加Delta4的表达,TNF-α只轻度增加Delta4的表达[5]。本组结果显示,γ-分泌酶抑制剂DAPT能抑制Notch信号通路,Delta4蛋白能激动Notch信号通路,对软骨细胞基质代谢产生重要作用。Notch信号通路对OA的病理过程的影响十分复杂,具体作用机制还有待于进一步实验研究。
综上所述,Notch信号通路与OA软骨代谢密切相关,Notch信号通路可能对OA软骨细胞基质合成具有重要作用,弄清Notch信号通路作用机制,能为Notch信号的调节提供理论依据,有利于通过Notch信号通路的调控改善OA软骨细胞的代谢,减轻或延缓OA病变进展,为探索早期骨关节炎药物治疗提供理论依据。
[参考文献]
[1] Hardingham TE,Oldershaw RA,Tew SR.Cartilage,SOX9 and Notch signals in chondrogenesis[J].J Anat,2006,209(4):469-480.
[2] Karlsson C,Brantsing C,Svensson T,et al.Differentiation of human mesenchymal stem cells and articular chondrocytes:analysis of chondrogenic potential and expression pattern of differentiation-related transcription factors[J].J Orthop Res,2007,25(2):152-163.
[3] 周乙雄.骨关节炎——最常见的退行性关节疾病[J].中华关节外科杂志(电子版),2010,4(4):436-437.doi:10.3969/cma.j.issn.1674-134X.2010.04.001.
[4] 邱贵兴.骨关节炎流行病学和病因学新进展[J].继续医学教育,2005,19(7):68-69.doi:10.3969/j.issn.1004-6763.2005.07.020.
[5] Karlsson C,Brantsing C,Egell S,et al.Notch1,Jagged1 and HES5 are abundantly expressed in osteoarthritis[J].Cells Tissues Organs,2008,188(3):287-298.doi:10.1159/000121610.
[6] Geyer M,Grassel S,Straub RH,et al.Differential transcriptome analysis of intraarticular lesional vs intact cartilage reveals new candidate genes in osteoarthritis pathophysiology[J].Osteoarthritis Cartilage,2009,17(3):328-335.doi:10.1016/j.joca.2008.07.010.
[7] Loeser RF.Translational research in osteoarthritis-from molecules to animals to humans[J].J Musculoskelet Neuronal Interact,2008,8(4):301-302.
[8] 刘永刚,鲍隽君,邢自宝,等.骨性关节炎与细胞因子相关性研究进展[J].骨科,2010,1(2):105-107.doi:10.3969/j.issn.1674-8573.2010.02.020.
[9] 张衣北,陈安民,郭风劲,等.激活的Notch1信号系统抑制前软骨干细胞凋亡及其机制研究[J].中华小儿外科杂志,2006,27(11):592-595.doi:10.3760/cma.j.issn.0253-3006.2006.11.010.
[10] Kohn A,Dong Y,Mirando AJ,et al.Cartilage-specific RBPjκ-dependent and -independent Notch signals regulate cartilage and bone development[J].Development,2012,139(6):1198-1212.doi:10.1242/dev.070649.
[11] Mirando AJ,Liu Z,Moore T,et al.RBP-Jκ-dependent Notch signaling is required for murine articular cartilage and joint maintenance[J].Arthritis Rheum,2013,65(10):2623-2633.doi:10.1002/art.38076.
[12] Liu Z,Ren Y,Mirando AJ,et al.Notch signaling in postnatal joint chondrocytes,but not subchondral osteoblasts,is required for articular cartilage and joint maintenance[J].Osteoarthritis Cartilage,2016,24(4):740-751.doi:10.1016/j.joca.2015.10.015.
[13] Oldershaw RA,Hardingham TE.Notch signaling during chondrogenesis of human bone marrow stem cells[J].Bone,2010,46(2):286-293.doi:10.1016/j.bone.2009.04.242.
[14] Martinez Arias A,Zecchini V,Brennan K.CSL-independent Notch signalling:a checkpoint in cell fate decisions during development?[J].Curr Opin Genet Dev,2002,12(5):524-533.
[15] Hiraoka K,Grogan S,Olee T,et al.Mesenchymal progenitor cells in adult human articular cartilage[J].Biorheology,2006,43(3/4):447-454.
[16] Khan IM,Palmer EA,Archer CW.Fibroblast growth factor-2 induced chondrocyte cluster formation in experimentally wounded articular cartilage is blocked by soluble Jagged-1[J].Osteoarthritis Cartilage,2010,18(2):208-219.doi:10.1016/j.joca.2009.08.011.
[17] Karlsson C,Jonsson M,Asp J,et al.Notch and HES5 are regulated during human cartilage differentiation[J].Cell Tissue Res,2007,327(3):539-551.
[18] Liu Z,Chen J,Mirand AJ.et al.A dual role for NOTCH signaling in joint cartilage maintenance and osteoarthritis[J].Sci Signal,2015,8(386):ra71.doi:10.1126/scisignal.aaa3792.
