动态对比增强磁共振渗透性参数早期监测肝转移瘤贝伐单抗联合常规化疗治疗敏感性的价值
2018-05-03钱海峰
刘 东,钱海峰
湖州市中心医院放射科,浙江湖州 313000
ActaAcadMedSin,2018,40(2):256-263
肝脏是结肠癌最常见的转移器官,35%以上结肠癌患者在确诊时已经出现肝脏转移,另有约25%患者原发病灶切除后出现肝脏转移[1],目前治疗结肠癌肝转移瘤主要以全身化疗为主,而全身化疗仅对部分患者有效,个体化治疗是提高疗效的有效方法[2]。实体肿瘤疗效评价标准基于肿瘤形态学评估肝转移瘤化疗疗效,但单纯的形态学评价标准不能及时、准确地反映肿瘤血流灌注及坏死等的改变,也不能早期预测肿瘤化疗的疗效[3- 4]。多种磁共振功能成像技术可以提供定量、多参数数据早期反映病变组织代谢、肿瘤微血管和微环境的信息变化[5- 8],动态对比增强磁共振(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)就是其中之一,它通过动态监测对比剂在体内的吸收、代谢等药代动力学过程获得定量的渗透性参数,在细胞分子功能水平反映组织血管分布、血流灌注等生理信息的作用[9- 10]。因此,本研究旨在探讨3.0T磁共振渗透性参数在早期监测肝转移瘤化疗疗效及其敏感性的价值,为临床实施个体化化疗方案提供理论依据。
对象和方法
对象选取2015年7月至2017年8月浙江大学湖州医院临床多学科综合治疗协作组模式诊断为直结肠癌肝转移瘤拟联合化疗行磁共振检查的患者28例,其中男15例、女13例,年龄37~77岁,平均 (57.1±9.8)岁。所有患者均经手术病理证实为直结肠癌,肿瘤T分期:T2期4例、T3期11例、T4期13例。纳入标准:(1)原发肿瘤为直结肠癌,经病理或临床随访证实为肝转移瘤;(2)转移瘤靶病灶最大径大于1 cm。排除标准:(1)影像学检查发现有肝硬化、肝癌等肝脏原发肿瘤;(2)磁共振检查禁忌证;(3)DCE-MRI伪影较多,图像质量不能满足临床诊断。32例患者参加本研究,经穿刺活检病理证实24例,随访证实8例,总共临床诊断转移瘤236个病灶,其中肝左叶84个、右叶152个;病灶最大径0.4~5.2 cm,其中最大径大于1 cm的病灶数为92个;其中1例患者自动退出本研究、1例患者未进行化疗第1周期后磁共振检查、2例图像伪影不能满足临床诊断,最终28例患者纳入本研究。联合化疗方案:FOLFOX6方案(奥沙利铂、亚叶酸钙、5-氟尿嘧啶)+贝伐单抗,14 d后重复治疗,共6个疗程。所有患者均在化疗前1周内和化疗第1周期结束后、化疗结束后1周内进行磁共振检查,检查前均签署知情同意书。
检查方法采用美国GE公司Discovery MR 750 3.0T超导型磁共振仪,以32通道体部专用线圈进行扫描。扫描方位及序列包括:(1)自旋回波 T1加权像横断位:重复时间(repetition time,TR) 500 ms、回波时间 (echo time,TE) 20 ms,矩阵256×256,激励次数为2;(2)快速自旋回波 T2加权像横断位及冠状位:TR 3500 ms、TE 90 ms,矩阵256×256,激励次数为2,回波链长度为12;(3)多翻转角的T1蒙片:TR 3.2 ms、TE 1.5 ms,矩阵256×160,层厚4.0 mm,视野36 cm×36 cm,翻转角:3°、6°、9°、12°、15°;(4)T1加权动态对比增强扫描序列:翻转角:15°,其余参数同多翻转角的T1蒙片扫描。单次扫描时间8 s,共40期,动态对比增强扫描时间共320 s,在第2个动态增强时相结束后,采用高压注射器同步静脉注射小分子量钆双胺对比剂欧乃影(Omniscan,GE Healthcare),注射速率2.5 ml/s,注射剂量0.1 mmol/kg,并以相同速率注射生理盐水15 ml冲洗导管。
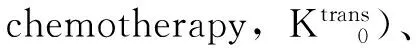
疗效评价参照2009年WHO公布的实体肿瘤疗效评价标准进行总体疗效评价,包括:(1)完全缓解:所有靶病灶消失,无新病灶出现;(2)部分缓解:靶病灶最大径之和减少≥30%;(3)疾病进展:靶病灶最大径之和至少增加≥20%,或出现新病灶。新病灶包括新出现的转移瘤和原来最大径小于1 cm,化疗期间明显增大的病灶;(4)疾病稳定:靶病灶最大径之和缩小未达到部分缓解,或增加未达到疾病进展。分组标准:结合实体肿瘤疗效评价标准和临床肿瘤标志物癌胚抗原、癌抗原199(CA19- 9)和甲胎蛋白的实验室检查结果分为高敏感组和低敏感组。高敏感组需同时满足下列2个条件:(1)靶病灶为完全缓解或部分缓解;(2)疗效确认:肿瘤标志物为阴性,4周后复查结果仍为阴性。低敏感组满足下列条件之一:(1)靶病灶为疾病进展;(2)靶病灶为疾病稳定,疗效确认:肿瘤标志物阳性或6周后复查进行性增高。

结 果
化疗前后两组靶病灶形态学指标的变化按照疗效评价标准,28例肝转移瘤化疗结束后,12例纳入高敏感组,总共靶病灶29个(均为部分缓解),16例纳入低敏感组,总共靶病灶35个(包括9例疾病进展21个、7例疾病稳定14个)。两组靶病灶的LD0、LD1值组间比较差异均无统计学意义(t=0.284,P=0.777;t=0.339,P=0.735);同时化疗第1周期后,两组靶病灶均无形态学改变,LD0、LD1值在化疗前后的组内比较,差异均无统计学意义(t=0.299,P=0.766;t=0.305,P=0.305)(表1)。

表 1 高敏感组和低敏感组最大径的比较(- ±s)Table 1 Comparison of maximal diameters compared between the hypersensitivity and hyposensitivity groups (- ±s)

间比较差异均无统计学意义 (P>0.05)(表2)。
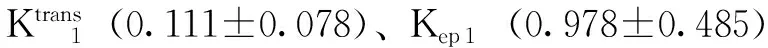
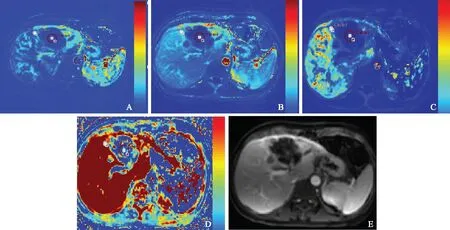
圈为感兴趣区
Circle represents region of interest
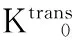
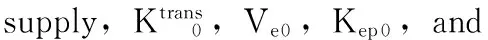
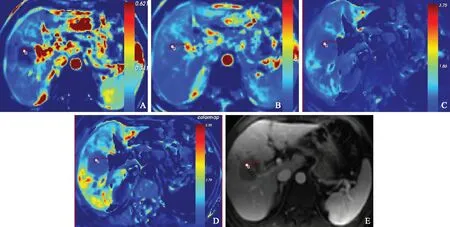
圈为感兴趣区
Circle represents region of interest
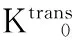


表 2 高敏感组和低敏感组靶病灶动态对比增强磁共振成像渗透性参数的比较(- ±s)Table 2 Comparisons of permeability parameters of dynamic contrast-enhanced magnetic resonance imaging between the hypersensitivity and hyposensitivity groups (- ±s)
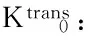
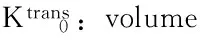
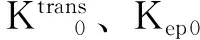
讨 论
磁共振的多序列、多模态成像技术在近年来被应用于监测肝脏肿瘤经肝动脉化学栓塞术、放化疗疗效的评估[2- 7,12],其中DCE-MRI通过对比剂注入血管前、血管中及血管后连续扫描靶病灶,反映出小分子对比剂在肿瘤不成熟新生血管向血管外细胞外间隙(extravascular-extracellular space,EES)的渗透情况[3,13],得到对比剂在血管内和EES的分布信息,获得药物代谢动力学参数,进一步拟合出对比剂在靶病灶的时间浓度变化曲线,得到靶病灶的渗透性参数。因此,本研究主要利用DCE-MRI渗透性参数在肝转移瘤靶病灶化疗敏感性预判和早期监测渗透性参数的变化。

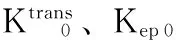
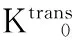
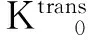
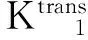
Ve值代表对比剂在EES内的分布容积分数,反映EES的大小。有研究认为在肿瘤治疗后肿瘤细胞减少,细胞密度减低,造成EES的增宽,Ve值增加[14]。本研究化疗第1周期后高敏感组与低敏感组的Ve1值无变化,但组内比较差异均无统计学意义,这可能是由于在化疗早期,部分肿瘤细胞凋亡早期出现细胞肿胀,无法使EES出现明显改变。
本研究也存在一些局限性。首先,本研究的样本量偏少,同时DCE-MRI由于目前尚无统一的技术标准和模型选择,因此无法得到该模型下大样本数据,结果还需大样本来证实;第二,部分肝转移瘤病例是临床随访证实的,对统计结果可能存在偏倚,需对照病理结果分析渗透性参数;第三,虽然化疗前高敏感组和低敏感组的Ktrans值有差异,但两组病例中存在一定的重叠,因此结合其他磁共振检查序列如扩散加权成像等可以更好地预测化疗疗效。最后,不同机型和扫描条件(患者心脏每搏输出量、注射方法等)均可造成DCE-MRI结果的稳定性、可重复性的减低。
综上,磁共振动态对比增强的渗透性参数有助于早期预测直结肠癌肝转移瘤化疗疗效,其中Ktrans值可作为治疗前化疗敏感性的监测指标。
[1] Kim JH. Chemotherapy for colorectal cancer in the elderly[J].World J Gastroenterol,2015,21(17):5158- 5166. DOI:10.3748/wjg.v21.i17.5158.
[2] Mainenti PP,Romano F,Pizzuti L,et al. Non-invasive diagnostic imaging of colorectal liver metastases[J]. World J Radiol,2015,7(7):157-169. DOI:10.4329/wjr.v7.i7.157.
[3] O’Connor JP,Rose CJ,Jackson A,et a1. DCE-MRI biomarkers of tumour heterogeneity predict CRC liver metastasis shrinkage following bevacizumab and FOLFOX- 6[J]. Br J Cancer,2011,105(1):139- 145.DOI:10.1038/bjc.2011.191.
[4] 陈娟,尹化斌. 肝脏DCE-MR技术及其在肝恶性肿瘤血管靶向治疗中的应用[J]. 世界华人消化杂志,2014,22(32):4928- 4933.DOI:CNKI:SUN:XXHB.0.2014- 32- 008.
[5] 王亚婷,朱艳,郭莉莉,等.磁共振扩散加权成像在预测乳腺癌肝转移早期疗效中的作用[J].中国临床医学影像杂志,2017,28(3):180-183.DOI:CNKI:SUN:LYYX.0.2017- 03- 009.
[6] Matsushima S,Sato T,Nishiofuku H,et al. Equivalent cross-relaxation rate imaging and diffusion weighted imaging for early prediction of response to bevacizumab-containing treatment in colorectal liver metastases-preliminary study [J].Clin Imaging,2017,41(1):1- 6. DOI:10.1016/j.clinimag.2016.08.013.
[7] 王小玲,赵振华,王伯胤,等. MRI功能成像对肝动脉化疗栓塞治疗肝细胞肝癌的疗效评价[J]. 临床放射学杂志,2017,36(5):700-704.DOI:CNKI:SUN:LCFS.0.2017- 05- 025.
[8] Granata V,Fusco R,Catalano O,et al. Early assessment of colorectal cancer patients with liver metastases treated with antiangiogenic drugs:the role of intravoxel incoherent motion in diffusion-weighted imaging [J]. PLoS One,2015,10(11):e0142876.DOI:10.1371/journal.pone.0142876.
[9] 何为,刘毅,刘剑羽,等. 3.0 T MR 动态增强扫描定量分析诊断前列腺癌的价值[J]. 中华放射学杂志,2014,48(3):215-218.DOI:10.3760/cma.j.issn.1005-1201.2014.03.011.
[10] Sung HB,Gong YJ,Young MH,et al. Usefulness of tissue permeability factor in differentiating benign and malignant pulmonary lesions on dynamic contrast-enhanced MRI [J]. Korean J Radiol,2013,69(1):57- 65. DOI:10.3348/jksr.2013.69.1.57.
[11] 钱海峰,李凤琪,胡春洪. 增强磁共振成像与胆胰管成像对胰腺导管内乳头状黏液性肿瘤良恶性鉴别的比较[J]. 中国医学科学院学报,2014,36(1):98- 101.DOI:10.3881/j.issn.1000- 503X.2014.01.018.
[12] Yuan Z,Li WT,Ye XD,et al. Novel functional magnetic resonance imagine biomarkers for assessing response to therapy in hepatocellular carcinoma[J]. Clin Transl Oncol,2014,16(5):599- 605. DOI:10.1007/s2094- 13- 1147- 5.
[13] Ng CS,Wei W,Bankson JA,et al. Dependence of DCE-MRI biomarker values on analysis algorithm[J]. PLoS One,2015,10(7):e0130168.DOI:10.1371/joumal.pone.0130168.
[14] 刘丽,邵天朋,曹建民,等. 动态对比增强MRI 对结肠癌肝转移瘤TACE治疗前后微循环灌注改变及近期疗效评价[J].介入放射学杂志,2016,25(6):501- 505.DOI:CNKI:SUN:JRFS.0.2016- 06- 009.
[15] O’connor JP,Carano RA,Clamp AR,et al. Quantifying antivascular effects of monoclonal antibodies to vascular endothelial growth factor:insights from imaging[J]. Clin Cancer Res,2009,15(6):6674- 6682. DOI:10.1158/1078- 0432.CCR- 09- 0731.
[16] Dennis V,Hanneke WM,Jack JA,et al. Chemotherapy response monitoring of colorectal liver metastases by dynamic Gd-DTPA enhanced MRI perfusion parametersand 18F-FDG PET metabolic rate[J]. J Nucl Med,2009,50(11):1777- 1784. DOI:10.2967/jnumed.109.064790.
[17] Kim HS,Kim CK,Park BK,et al.Evaluation of therapeutic response to concurrent chemoradiotherapy in patients with cervical cancer using diffusion-weighted MR imaging[J].Magn Reson Imaging,2013,37(1):187- 193. DOI:10.1002/jmri.23804.
[18] Hirashima Y,Yamada Y,Tateishi U,et al. Pharmacokinetic parameters from 3-Tesla DCE-MRI as surrogate biomarkers of antitumor effects of bevacizumab plus FOLFIRI in colorectal cancer with liver metastasis[J]. Int J Cancer,2012,130(10):2359- 2365. DOI:10.1002/ijc.26282.
