分次部分脾动脉栓塞治疗青少年脾功能亢进
2018-05-03宋晓军陈跃鑫刘昌伟刘志丽郑月宏
刘 端,邵 江,陈 宇,刘 暴,宋晓军,陈跃鑫,刘昌伟,叶 炜,曾 嵘,刘志丽,郑月宏
中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
ActaAcadMedSin,2018,40(2):194-200
脾功能亢进症在青少年患者中并不常见,但可继发于很多先天性疾病(如球形红细胞症、镰刀形红细胞性贫血等)、感染性疾病以及门脉高压。脾功能亢进症(以下简称脾亢)可造成的严重后果是血细胞减少;脾亢还可以加重门脉高压患者的食管胃底静脉曲张,是引起食管胃底静脉出血的重要因素之一;同时脾亢还会加重门脉高压所致的腹水和消化道淤血症状。脾亢的患者常伴有血小板减少,多数患者代偿良好,可不出现任何症状。而对于重症患者,血小板数量可下降至50 000/mm3以下,患者凝血功能受到严重影响,出血风险增加[1]。增大的脾脏除了可以滞留和破坏血小板外,还对白细胞造成一定程度的破坏,降低患者免疫功能。目前治疗血小板减少症常用的方法包括脾脏切除术和部分脾栓塞术(partial splenic artery embolization,PSE)。PSE手术风险低,且适当保留了脾脏功能,因而越来越受到国内外学者认同,逐渐取代了脾切除术[1- 3]。但是目前常用的PSE手术方式可造成一定比例的严重术后并发症,如脾栓塞术后综合征、间歇性发热、腹痛、恶心、呕吐、脾脓肿、脾破裂、肺炎、内脏出血、难治性腹水以及胸膜腔积液等[3]。有报道显示,术后并发症的发生率与每次栓塞量成正相关[4]。为进一步降低脾栓塞的并发症风险,本院血管外科主张少量、多次、间歇性地进行脾栓塞,以期达到最佳的栓塞效果和最小的手术风险。本研究主要通过观察本院应用这一理念所治疗的患者,总结其治疗效果,以便对临床治疗起到一定的指导作用。
对象和方法
对象选取北京协和医院血管外科2010年5月至2016 年2月应用分次治疗的方法进行超选择性脾动脉栓塞术治疗的肝硬化脾功能亢进患者8例,其中男性3例、女性5例,首次治疗时平均年龄(21.9±6.6)岁(14~32岁)。所有患者术前均有血小板减少症,血小板计数(14~43)×109/L,平均(27.6±8.7)×109/L;并伴有白细胞减少症,术前白细胞计数(1.7~3.3)×109/L,平均2.4×109/L;部分患者伴有轻度贫血,术前血红蛋白94~129 g/L,平均108.8 g/L。术前骨髓穿刺涂片结果均提示骨髓增生活跃,排除骨髓衰竭综合征。所有患者术前均有出血倾向,有过多次皮肤紫癜、内脏出血、反复感染病史,其中患者4与患者5曾有多次输血治疗病史。术前患者肝功能Child-Pough分级,3例为A级、4例为B级、1例为C级(表1)。术前腹部查体、血常规、CT等检查证实脾脏重度增大、脾功能亢进。
手术方法及围手术期处理术前明确患者手术指征:(1)血小板低于50×109/L达半年以上;(2)持续溶血性贫血,长期药物治疗效果不佳;(3)脾肿大明显,造成明显压迫症状;(4)粒细胞极度减少并有反复感染史[5- 6]。术前均向患者或监护人告知手术方式及相关风险,患者签署知情同意书后方进行手术。所有患者均进行部分脾动脉栓塞手术治疗,手术分2~3次进行(表1),手术间歇时间1~2个月。每次栓塞前均行胸部正侧位片、血常规及腹部B超等检查,在上一次栓塞的基础上评估疗效并评估下一次手术的必要性。只有在患者疼痛完全缓解、白细胞高峰期过后处于稳定状态,评估患者仍符合手术指征,才进行下一步的栓塞治疗。所有患者的PSE手术均由同一位血管外科医师完成(具有10年以上的介入血管外科经验)。每次栓塞手术围手术期应用抗生素预防感染。
局麻(2 ml 2%利多卡因)后经股总动脉穿刺,置入7F鞘管。应用5F Cobra导管(Cook Group Incorporated,Bloomington,Indiana,USA;or Terumo Medical Corporation,Tokyo,Japan)选入脾动脉近端,造影以显示脾动脉分支及脾脏血供。多数患者脾动脉在脾门处分支为2支或2支以上,少数患者在脾门之前也可分出小支供应脾的上下极。尽可能地将Cobra导管推进至离脾门最近的位置,采用微导丝、微导管进行超选进入脾脏内部脾动脉分支,优先选择下极动脉(已有PSE病史的患者选择最靠近下极的脾动脉分支)。通过微导管超选择性地向脾动脉分支注入弹簧圈、聚乙烯醇粒子或明胶海绵颗粒,在脾动脉的终末支进行栓塞(具体栓塞材料取决于患者个人意愿)。为防止脾脏栓塞后发生大量的胸腔积液渗出及严重的脾栓塞后综合征,每次栓塞手术均选择最靠下的一支或多支脾动脉分支。栓塞量的把握标准是保证每次手术栓塞量占整个脾脏的20%~40%(图1B、2B),但在最后一次栓塞后,累积栓塞量将大于栓塞前脾脏的70%[7]。脾脏栓塞比例的评估方法,根据Ou等[8]报道的评估方法,即目标分支血管的直径占所有分支血管直径和的比例,评估该分支血管血流的比例即为脾脏栓塞量的比例。
患者每次术后恢复进食以前均给予静脉补液。适当给予阿片类药物或非甾体类消炎药(nonsteroidal antiinflammatory drug,NSAID)类药物,包括患者自控型镇痛泵,对患者进行镇痛、控制发热。
术后随访患者每次PSE手术前后均查胸片正侧位,以检查是否出现胸腔积液。每次手术前后,手术后1周、2周、1个月、3个月、半年、1年均复查腹部B超、血常规、肝肾功能。手术前、手术后3个月、1年均复查腹部增强CT。以后每年复查血常规、肝肾功能、腹部B超及增强CT。
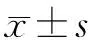
结 果
一般情况所有患者手术均获成功,术后无脾脓肿、脾破裂、胰腺坏死、脓毒症、感染性休克等严重并发症。所有患者术后均出现发热(最高38.8℃)、左上腹疼痛,但均在术后1周内恢复。6例患者发热、疼痛症状仅应用NSAID类药物治疗可得到缓解,2例患者需静脉或口服阿片类药物治疗。
术后随访所有患者术后均得到随访,术后随访时间24~62个月,平均(43.1±11.9)个月。随访期间血小板、白细胞数量稳定增加,并且血小板计数维持在100×109/L以上,白细胞计数维持在4×109/L以上(表2)。术后2例患者复查胸片提示少量局灶性胸腔积液,1个月后复查发现自行缓解。3例腹水患者术后3个月CT血管成像显示腹水完全缓解。所有患者术前CT、PSE前造影均能看到脾脏明显增大,脾脏边缘较钝(图1A、2A)。在第1次PSE术后造影中,可见到脾脏外周组织栓塞后显影减少,栓塞面积为20%~40%(图1B),而PSE术后1个月随诊的CT可见到脾脏下极外周明显脾梗死灶,脾脏体积缩小,脾脏边缘变锐(图2B)。第2次PSE术后造影可见脾脏下极、中部的外周组织在栓塞后均已无显影,此时脾周栓塞已达70%~80%(图1C)。术后1年患者复查CT,可见脾脏外周梗死灶明显瘢痕化,脾脏体积明显缩小(表1、图2C)。

表 1 患者基本信息及PSE手术前后情况Table 1 Demographic and clinical characteristics of the patients before and after PSE procedures
PSE:部分脾动脉栓塞;与治疗前比较,at=8.47,aP<0.001
PSE:partial splenic artery embolization;at=8.47,aP<0.001 compared with preoperative level

A.术前造影提示脾脏明显增大;B.第1次PSE手术后造影,脾脏外周组织栓塞后显影减少,栓塞面积为20%~40%;C.第2次PSE手术造影,脾脏下极、中部的外周组织在栓塞后已无显影,脾周栓塞达70%~80%
A.the preoperative radiography shows splenomegaly;B.the splenogram after the first PSE session shows decreased development of splenic peripheral tissue after embolization,and the embolization area accounted for 20%- 40%; C.after the 2nd PSE session,the peripheral tissue in the lower and middle parts of the spleen had no development after embolization,and the perisplenic embolization area accounted for 70%- 80%
图1手术造影图
Fig1The radiography during operations

A.术前1周上腹部CT提示脾脏明显增大,脾脏边缘较钝;B.第1次PSE术后1个月复查,CT提示脾脏下极外周明显脾梗死灶,脾脏体积缩小,脾脏边缘变锐;C.术后1年复查,CT提示脾脏外周梗死灶明显瘢痕化,脾脏体积缩小
A.CT scan of the upper abdomen 1 week before the first PSE session,showing the splenomegaly and the blunt edge of the spleen;B.follow-up CT scan 1 month after the 1st PSE session shows that the splenic inferior pole was significantly infarcted,the volume of the spleen was reduced,and the edge of the spleen became sharper;C.follow-up CT scan 1 year after PSE sessions indicates that the splenic infarct was markedly scarring and the spleen shrank
图2手术前后CT
Fig2CT scan before and after PSE sessions
实验室检查结果所有患者在完成介入栓塞手术全部疗程之后1周,血小板均恢复正常值。术后1个月血小板数量有轻度下降,但在术后1年及之后的长期随访期间仍维持在正常范围之内。最后随访日血小板计数与术前比较,差异具有统计学意义(t=39.042,P<0.001)(表2)。白细胞的数量在术后1周内增加明显,术后2周开始有所下降,但术后1个月均已恢复正常。之后的随访过程中患者的白细胞均高于第1次栓塞术前,并始终处于正常范围。最后随访日白细胞计数与术前比较差异具有统计学意义(t=12.350,P<0.001)(表2)。肝功能方面,丙氨酸氨基转移酶和天门冬氨酸氨基转移酶在手术前后变化幅度较小,各时间点检测值之间差异无统计学意义(方差检验值依次是:F=0.34,P=0.849;F=0.13,P=0.97)(表2)。
讨 论
作为一种微创技术,PSE已被用于治疗脾功能亢进症达30余年,其疗效得到多数学者的肯定[9]。与脾切除术相比,PSE手术具有许多优点,如手术创伤小、操作时间短、无需输血、仅需要局麻就可以完成手术等。最重要的是,PSE手术保留部分脾脏组织,因而脾脏功能尚存[9- 10]。目前PSE已经被广泛应用于治疗放化疗前的全血细胞减少症、消化道静脉曲张性的出血、伴随肝功能不全、腹水的重度门脉高压症等[2]。

表 2 分次PSE手术前后患者化验指标(- ±s)Table 2 Laboratory test results of patients before and after PSE operations(- ±s)
与治疗前比较,at=12.350,aP<0.001;bt=39.042,bP<0.001
at=12.350,aP<0.001;bt=39.042,bP<0.001 compared with preoperative level
青少年脾功能亢进的主要原因包括感染(如E-B病毒、巨细胞病毒感染等)、免疫系统失调、红细胞非正常破坏性疾病。此外,血液系统肿瘤、门脉高压等也可以导致青少年患者出现脾功能亢进。此类疾病在免疫功能正常的成人中并不常见;与成人常见的肝性脾脏增大相比,青少年患者脾功能亢进往往经过栓塞治疗后症状恢复更为显著[11]。且青少年患者处于发育阶段,如不及时治疗将影响身心发育,故进行栓塞治疗的愿望更为强烈。
PSE手术可以明显改善患者血小板、白细胞减少症的病情。其疗效与脾脏的栓塞量成正相关,只有在栓塞50%以上才能达到持续的治疗效果;青少年患者的脾脏功能恢复能力明显较成年人快,如果栓塞程度过小的话,患者在1~2年内脾脏即可恢复原栓塞前大小,出现脾亢复发[4];而PSE相关的并发症也随着栓塞量的增加而增加,当栓塞量达到70%以上时,患者术后发生脾脓肿、脾破裂、胸腔积液、脓毒症等严重并发症的风险明显增高。患者在围手术期常伴随肝肾功能不全、贫血等基础疾病,术后抵抗力明显下降,因此容易发生以上各种并发症,甚至死亡。又因为青少年患者免疫系统多处于发育阶段,炎症反应更为激烈,所以其并发症发生率较成人更高。因此,对于青少年脾亢患者进行PSE治疗,掌握其栓塞量的难度更高,对预后影响也更大[9]。根据目前文献报道,PSE手术栓塞量在50%以下时,其严重并发症发生率为0;栓塞量50%~70%的患者并发症发生率为8.8%;而栓塞量70%以上的患者并发症发生率达50%[4]。基于以上数据,目前多数学者主张PSE手术时栓塞量最好是在50%~70%,这样既可以尽可能地治疗脾亢,同时又不至于过多地发生严重并发症[4,11]。
对于重度青少年脾功能亢进患者,一次性栓塞50%~70%可能难以达到理想的治疗效果,而由于患者的代偿能力更低,其发生并发症的风险也更高[7]。本研究采用少量、多次栓塞的方法,将PSE手术分为2~3次完成,每次栓塞量为20%~40%。每次栓塞后间歇1~2个月,待患者疼痛缓解、血小板有所恢复、白细胞短暂的高峰期过后,再次评估栓塞治疗效果,发现血常规指标尚不达标、仍有栓塞治疗指征,才进行下一次的栓塞治疗,最终总栓塞量达到患者脾脏的70%以上[3,7],根据这个PSE栓塞理念,患者每次栓塞量小,发生并发症的风险降低,恢复快;在间歇期患者恢复以后,再次进行同样手术。随着栓塞量的逐渐增加,患者血细胞数量、肝肾功能逐渐恢复、手术耐受力逐渐增强,最终达到栓塞70%以上的治疗目标,同时将患者并发症发生率降到最低。需要注意的是,手术中每次栓塞量根据经验决定,栓塞一定量的脾脏之后,在间歇期会有一部分的脾脏功能恢复,脾脏继续出现部分增大,因此最终的栓塞量不能简单累加。多次、反复栓塞,目标是在最终栓塞之后,与最初栓塞之前进行对比,达到栓塞70%以上,并在复查时检测患者血小板、白细胞、血红蛋白恢复至正常范围或正常低限。
本研究随访结果表明,少量、多次的PSE治疗方式让患者血小板、白细胞数量明显增加,腹水消退,并在随访期间手术效果持续维持,无反复现象。这与患者经过少量、多次的PSE术后,栓塞量达到70%以上有着密不可分的关系。
另一方面,本研究患者的并发症发生率明显降低,术后无手术相关并发症,无脾脓肿、脓毒症、脾破裂等严重并发症,无患者死亡。仅2例(25%)患者术后胸片提示少量胸腔积液,但并不伴有肺不张、肺部感染,术后1个月内复查发现该并发症自行缓解。
此外,本研究与传统PSE方法一样[3],所有患者均发生了发热、左上腹疼痛等轻微并发症,其发生率基本相似。但发热均能控制在39℃以内,并且该并发症均在1周内得到缓解。腹痛症状多数患者(6例)能够耐受,口服NSAID类药物即可缓解,少数患者(2例)疼痛较重,通过静脉或口服阿片类镇痛药物能够缓解。笔者将患者并发症少、恢复快的原因归结于,本研究患者虽然栓塞总量较大,但每次栓塞量仅30%左右,单次脾脏坏死面积较小,患者在有限的代偿能力下也能很快恢复。
介入用栓塞材料可以根据患者自身的意愿进行选择。本研究患者采用弹簧圈、聚乙烯醇或明胶海绵颗粒。有研究提示应用不同的栓塞材料进行栓塞,最终栓塞结果的差异无统计学意义[12]。
在评估患者术后血细胞反应的过程中,本研究发现血小板在第1次栓塞之后的第1个星期就有明显升高,这种升高现象一直持续到第2周。这一现象与文献中报道相符。据文献报道,血小板往往在PSE术后第1~2周呈升高趋势,而在第2周之后轻度下降,并保持平稳[7]。本研究在每次栓塞之后,患者血小板均有一定程度的升高,并在最后一次栓塞之后升高至正常状态。在术后1、2年随访时,血小板数量较术后1个月复查稍有减低,但仍处于正常。
综上,少量、多次进行部分脾动脉栓塞术,并在围手术期注意预防患者发生感染,在治疗脾功能亢进方面效果不亚于单次栓塞,而并发症在一定程度上有所减少,值得进一步推广。但本研究限于病例数量,故该手术的疗效是否确切、安全性是否具有明显的优势,尚有待于扩大研究。
[1] Wang YB,Zhang JY,Zhang F,et al. Partial splenic artery embolization to treat hypersplenism secondary to hepatic cirrhosis:a meta-analysis[J]. Am Surg,2017,83(3):274- 283. DOI:10. 2214/AJR. 15. 14637.
[2] Cai M,Huang W,Lin C,et al. Partial splenic embolization for thrombocytopenia in liver cirrhosis:predictive factors for platelet increment and risk factors for major complications[J]. Eur Radiol,2016,26(2):370- 380. DOI:10. 1007/s00330- 015- 3839- 4.
[3] Ozturk O,Eldem G,Peynircioglu B,et al. Outcomes of partial splenic embolization in patients with massive splenomegaly due to idiopathic portal hypertension[J]. World J Gastroenterol,2016,22(43):9623- 9630. DOI:10. 1016/j. jcf. 2006. 10. 001.
[4] Zhu K,Meng X,Qian J,et al. Partial splenic embolization for hypersplenism in cirrhosis:a long-term outcome in 62 patients[J]. Dig Liver Dis,2009,41(6):411- 416. DOI:10. 1016/j. dld. 2008. 10. 005.
[5] Bazeboso JA,Tshilolo LM,Mbongo CL,et al. Partial splenic embolization in a child with sickle cell disease and hypersplenism[J]. J Vasc Interv Radiol,2016,27(11):1738- 1739. DOI:10. 1016/j. jvir. 2016. 06. 026.
[6] Wu T,Sun R,Huang Y,et al. Partial splenic embolization of patients with hypersplenism by transradial or transfemoral approach:a prospective randomized controlled trial[J]. Acta Radiol,2016,57(10):1201- 1204. DOI:10. 1177/0284185115622076.
[7] Araten DJ,Iori AP,Brown K,et al. Selective splenic artery embolization for the treatment of thrombocytopenia and hypersplenism in paroxysmal nocturnal hemoglobinuria[J]. J Hematol Oncol,2014,7(3):27. DOI:10. 1186/1756- 8722- 7- 27.
[8] Ou MC,Chuang MT,Lin XZ,et al. A novel method for the angiographic estimation of the percentage of spleen volume embolized during partial splenic embolization[J]. Eur J Radiol,2013,82(8):1260- 1265. DOI:10. 1016/j. ejrad. 2013. 01. 013.
[9] Ahuja C,Farsad K,Chadha M. An overview of splenic embolization[J]. AJR Am J Roentgenol,2015,205(4):720- 725. DOI:10. 2214/AJR. 15. 14637.
[10] Zhu J,Chen X,Hu X,et al. A comparative study of surgical splenectomy,partial splenic embolization,and high-intensity focused ultrasound for hypersplenism[J]. J Ultrasound Med,2016,35(3):467- 474. DOI:10. 7863/ultra. 15. 03050.
[11] Zhu S,Chang S. Clinical application value of preoperative selective partial splenic embolization before splenectomy plus portal-azygous disconnection[J]. Int J Clin Exp Pathol,2015,8(8):9574- 9579.
[12] Masada T,Tanaka T,Sakaguchi H,et al. Coils versus gelatin particles with or without intraarterial antibiotics for partial splenic embolization:a comparative evaluation[J]. J Vasc Interv Radiol,2014,25(6):852- 858. DOI:10. 1016/j. jvir. 2013. 12. 563.
