圣·约翰草提取物片对创伤后应激障碍模型小鼠恐惧和焦虑行为的改善作用
2018-05-02刘谦东李硕硕周陆军樊双义
文 浩,刘谦东,李硕硕,周陆军,樊双义
(1.安徽医科大学解放军307临床学院神经内科,北京 100071;2.日照市人民医院急诊科,山东日照 276800;3.军事医学研究院军事认知与脑科学研究所,北京 100850)
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指个体经历或目睹自然灾害、战争、车祸或性侵等威胁生命的重大突发事件后延迟出现的精神症状[1]。主要有以下4类表现:侵入性症状(对痛苦事件的不断回忆及噩梦)、逃避行为(刻意回避引起创伤事件的情景和刺激)、消极的情感状态(愧疚、自责)和易激惹状态(易受惊吓、易兴奋)[2]。近年来,PTSD患病率随社会突发事件的增多而升高。有研究表明,经历应激事件之后,PTSD的终生患病率为6%~9%[3],部分PTSD患者还有明显的自杀倾向[4],严重影响了患者的生活质量,给社会和家庭带来了沉重的负担[5-6]。目前,PTSD的治疗以药物干预和心理治疗为主,选择性5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂(selective serotonin reuptake inhibitors,SSRI) 如 舍 曲 林(sertraline)和帕罗西汀,常作为临床治疗PTSD的一线药物,有一定疗效,但因其副作用较多[7],费用比较昂贵,患者依从性较差,常常达不到理想的效果[8-9]。因此,寻找安全有效的药物治疗PTSD具有重大的临床意义。
贯叶连翘(Hypericum perforatum),又名圣·约翰草(St.John′s wort,SJW),属藤黄科金丝桃属植物,SJW提取物片(extract of SJW tablets,ESJWT)主要有效成分为金丝桃素和贯叶金丝桃素(含量不低于总量的3%),具有多重抗抑郁作用,能有效抑制突触间隙5-HT、去甲肾上腺素(norepinephrine,NE)和多巴胺(dopamine,DA)的重吸收[10],临床上常用于焦虑、抑郁患者的治疗,目前已取得了确切的疗效[11];同时还具有抗炎和止痛作用[12-13]。治疗焦虑和抑郁时,ESJWT与SSRI类药物疗效相当,并且具有安全性高、副作用小和经济实惠等优点[14-15],但目前尚无应用于PTSD治疗的报道。因此,本研究通过短暂电击制备的PTSD模型小鼠,观察ESJWT对PTSD模型小鼠焦虑和恐惧行为的作用,同时检测小鼠血清NE和5-HT水平的变化,探讨ESJWT抗PTSD的作用,为临床防治PTSD提供相关依据。
1 材料与方法
1.1 药品、试剂和主要仪器
ESJWT片(商品名:路优泰,进口药品注册证号:Z20090005,德国威玛舒培博士药厂,每300 mg提取物中,贯叶金丝桃素含量≥9 mg,总金丝桃素含量≥0.4 mg),将ESJWT片常规粉碎,使用相应体积生理盐水混匀放入均质器进行振荡,按小鼠平均体质量配置成6 g·L-1的混悬液,放入4℃冰箱备用;盐酸舍曲林片(国药准字:H10980141,辉瑞制药有限公司)。小鼠NE和5-HT ELISA试剂盒(上海酶联生物有限公司)。
LE104E/02电子天平(上海METTLER TOLED有限公司);DW-40L508医用低温(-80℃)保存箱(中国海尔公司);Precellys均质器(法国Bertin Technologies公司);Microfuge 20R高速冷冻离心机(美国 Beckman Coulter公司);Spark 10M多功能酶标仪(瑞士Tecan公司);动物行为学分析系统(上海吉量软件科技有限公司)。
1.2 实验动物、分组和给药
雄性C57BL/6小鼠48只,SPF级,8~10周龄,体质量20~28 g,购自北京斯贝福生物技术有限公司,许可证号:SCXK(京)2016-0002。实验前将小鼠适应性喂养1周,每笼5~6只,温度20~24℃,湿度40%~60%,人工控制昼夜节律光线,小鼠自由进食、饮水。将所有小鼠随机分为4组,每组12只,分别为正常对照组(生理盐水,ig),模型组(生理盐水,ig),舍曲林治疗组(15 mg·kg-1,ig),ESJWT治疗组(25 mg·kg-1,ig),其中ESJWT治疗组所用药物剂量参考程启润等[16]贯叶连翘提取物相关治疗的最低有效剂量。所有小鼠每天给药1次,每次实验前1 h给药,持续到实验结束。
1.3 PTSD模型小鼠的制备
适应饲养过程中每天轻抓、抚摸小鼠2~3次,建模前1 h给予小鼠药物处理,每天1次,并提前1 h置于实验室适应环境,减少实验中的应激反应。参考姬雅君等[17]PTSD小鼠建模方法,连续2 d给予C57BL/6小鼠足底不可逃避的电流刺激(电击箱适应5 min,电流0.8 mA,,电击15次,间隔10 s,持续10 s);正常对照组小鼠置于电击箱中10 min,不给予任何刺激。实验过程中无小鼠死亡。
1.4 小鼠体质量测定
第1,7,13和19天测定小鼠体质量,观测小鼠体质量在实验过程中的变化。
1.5 小鼠行为学实验
1.5.1 僵住实验
第3,8和15天,将所有药物处理小鼠在实验室环境下适应1 h,分别放入电击箱中自由活动5 min,不给予任何刺激,记录其僵住时间百分比(除呼吸外其他肌肉活动消失的时间/总实验时间),该指标主要反映小鼠重新接触刺激环境的条件恐惧。所有行为学实验均在9∶00~15∶00进行,测量完毕后用75%乙醇将电击箱擦拭干净,清理干净粪便、尿液及异味。
1.5.2 旷场实验
第16天,小鼠药物处理后,在实验室环境下适应1 h。实验时将小鼠置于旷场箱(50 cm×50 cm×20 cm的银色金属敞箱)边缘,记录小鼠5 min内进入中央区域的次数及时间(以小鼠躯干中心进入为准)。
1.5.3 高架十字迷宫实验
高架十字迷宫由2条金属开臂和闭臂组成,每条开臂为30 cm×5 cm,周围无遮挡;每条闭臂为30 cm×5 cm×15 cm。迷宫离地90 cm。第17天,将药物处理的小鼠在实验室环境下适应1 h后,分别放于迷宫中央,面向开臂。记录小鼠进入开臂的次数及时间(以小鼠躯干中心进入为准)。观测小鼠焦虑状态,保持测试安静,同时避免垂直强光照射。
1.5.4 爬梯实验
实验所用爬梯为内置5阶2.5 cm高楼梯的透明玻璃箱。第18天,将药物处理小鼠在实验室环境下适应1 h后,背对台阶放于玻璃箱底部,记录5 min内小鼠爬梯数(四肢均爬上台阶)及站立次数(两前肢均抬离台阶,后肢伸直)。
1.6 记录小鼠在僵住实验中排便的数量
第3,8和15天,记录每只小鼠在5 min僵住实验过程中的粪便数量。
1.7 ELISA法测定小鼠血清NE和5-HT含量
所有行为学实验结束后,将各组小鼠ip给予1%戊巴比妥钠(10 mL·kg-1)麻醉,心脏取血0.5 mL。使用高速冷冻离心机(4℃,1000×g)离心10 min,取血清,暂不使用的血清存于-80℃冰箱;参照试剂盒说明书方法使用ELISA试剂盒测量小鼠血清NE和5-HT含量。
1.8 统计学分析
所有行为学数据使用动物行为观测系统进行记录,数据分析应用SPSS17.0软件,计量资料以x±s表示,使用单因素方差分析(one-way ANOVA)及Studentt检验对实验数据进行分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 ESJWT对PTSD模型小鼠体质量的影响
模型组小鼠体质量在第1~13天变化不大,之后才开始缓慢增加,其余各组小鼠体质量随时间延长逐渐升高(图1)。整个实验过程中,与正常对照组比较,模型组小鼠体质量平均增长量有下降趋势,但差异无统计学意义;与模型组比较,舍曲林组小鼠体质量平均增长量无显著性差异,ESJWT组小鼠体质量平均增长量明显升高(P<0.01)。

Fig.1 Effect of extract of St.John′s wort tablets(ESJWT) on body mass of post-traumatic stress disorder(PTSD)model mice after short foot-shocks.PTSD Mouse model was established with inescapable short electric foot-shocks(2 d;15 times each day;intensity:0.8 mA;duration:10 s;interval:10 s).From the first day before the electric foot-shock procedure,the mice were ig given sertraline(Ser,15 mg·kg-1)or ESJWT(25 mg·kg-1),once a day,for 18 d.n=12.**P<0.01,compared with model control group.
2.2 ESJWT对PTSD模型小鼠行为的影响
2.2.1 ESJWT对PTSD小鼠僵住时间百分比的影响
与正常对照组比较,模型组小鼠在第3,8和15天僵住时间百分比显著增加(P<0.01),表明建模成功;与模型组比较,在第3,8和15天,舍曲林组和ESJWT组小鼠僵住时间百分比均明显降低(P<0.01)(图2)。
2.2.2 ESJWT对PTSD模型小鼠进入旷场中央区域的次数和滞留时间的影响
与正常对照组相比,模型组小鼠进入旷场中央区域的次数及时间均显著降低(P<0.01);与模型组相比,舍曲林组小鼠进入旷场中央区域的次数和时间均显著增加(P<0.01),ESJWT组小鼠进入旷场中央区域的次数和时间也显著增加(P<0.01)(图3)。

Fig.2 Effect of ESJWT on freezing time of PTSD model mice after short foot-shocks.See Fig.1 for the mouse treatment.The percentage of freezing time of the mice was assessed on the 3rd,8thand 15thdays after electric foot-shocks procedure.,n=12.**P<0.01,compared with normal control group;##P<0.01,compared with model control group.

Fig.3 Effect of ESJWT on behavior of PTSD model mice after short foot-shocks.See Fig.1 for the mouse treatment.The number(A)and time(B)of central entries spent in the open field test on the 16thday after short foot-shocks.x±s,n=12.**P<0.01,compared with normal control group;##P<0.01,compared with model control group.
2.2.3 ESJWT对PTSD模型小鼠进入高架十字迷宫开臂的次数和滞留时间的影响
与正常对照组比较,模型组小鼠进入开臂的次数和时间均显著降低(P<0.01);与模型组相比,舍曲林组小鼠进入开臂的次数和时间均显著增加(P<0.01),ESJWT治疗组小鼠进入开臂的次数无显著性差异,但进入开臂的时间增加(P<0.05)(图4)。
2.2.4 ESJWT对PTSD模型小鼠爬梯和站立次数的影响
各组小鼠爬梯次数无显著性差异。与正常对照组比较,模型组小鼠站立次数明显增多(P<0.01);与模型组比较,舍曲林组和ESJWT治疗组小鼠站立次数均明显减少(P<0.01)(图5)。

Fig.4 Effect of ESJWT on behavior of PTSD model mice after short foot-shocks.See Fig.1 for the mouse treatment.The open arm entries(A)and time(B)of the elevated plus maze test of the mice were assessed on the 17thday after electric foot-shocks proceduren=12.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
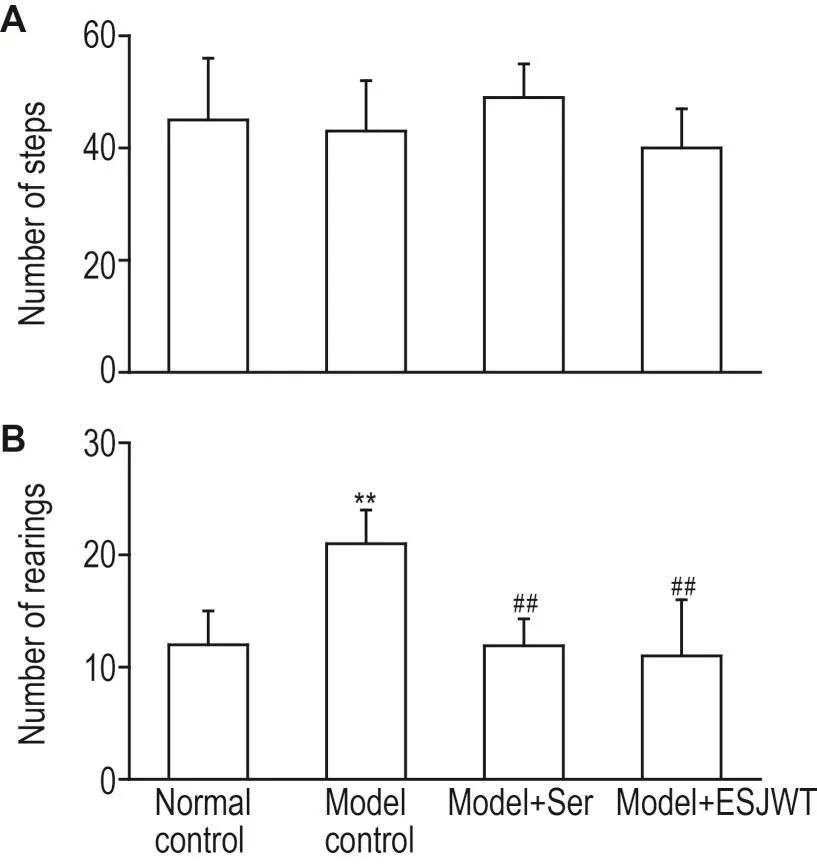
Fig.5 Effect of ESJWT on behavior of PTSD model mice after short foot-shocks.See Fig.1 for the mouse treatment.The number of steps(A)and rearing(B)was record⁃ed by the staircase test at the 18th day after electric foot-shocks procedure.n=12.**P<0.01,compared with normal control group;##P<0.01,compared with model control group.
2.3 ESJWT对PTSD模型小鼠在僵住实验中排便数量的影响
在僵住实验过程中,与正常对照组比较,第3,8和15天,模型组小鼠粪便量显著增加(P<0.01),第3和8天舍曲林组小鼠粪便量也显著增加(P<0.01);与模型组比较,舍曲林组小鼠粪便量无显著性差异,ESJWT组小鼠在第3,8和15天粪便量显著降低(P<0.01)(图6)。

Fig.6 Effect of ESJWT on number of fecal pellets of PTSD model mice during freezing behavior test.See Fig.1 for the mouse treatment.n=12.**P<0.01,compared with normal control group;##P<0.01,compared with model group.
2.4 ESJWT对PTSD模型小鼠血清NE和5-HT含量的影响
与正常对照组相比,模型组、舍曲林组和ESJWT治疗组小鼠血清NE和5-HT含量均无显著性差异(表1)。

Tab.1 Effect of ESJWT on serum contents of norepi⁃nephrine(NE)and 5-hydroxytryptamine(5-HT)of PTSD model mice after short foot-shocks
3 讨论
本研究结果显示,短暂电击所致PTSD模型小鼠表现出明显的焦虑、恐惧等PTSD样行为,表明短暂电击是比较简便有效的建模方式。僵住实验中小鼠不动时间百分比主要反映PTSD模型小鼠恐惧记忆的强弱,舍曲林组和ESJWT治疗组小鼠僵住时间百分比较模型组均显著降低,表明ESJWT与舍曲林作用相似,可有效预防PTSD模型小鼠恐惧记忆的产生。旷场实验、高架十字迷宫实验和爬梯实验均能反映PTSD模型小鼠的焦虑程度,其中小鼠进入旷场中央区域以及进入高架十字迷宫开臂的次数与时间越少,表明小鼠越焦虑;爬梯实验中小鼠站立的次数越多也表明小鼠越焦虑[18]。本研究结果显示,与模型组相比,ESJWT治疗组小鼠进入旷场中央区域的次数与时间均显著增加,进入高架十字迷宫开臂的时间也明显增加,同时爬梯实验中站立的次数显著降低,其作用与舍曲林相近,表明ESJWT能有效改善PTSD模型小鼠的焦虑行为。因此,行为学实验可见,ESJWT能有效缓解短暂电击所致PTSD模型小鼠的恐惧记忆与焦虑行为,疗效与舍曲林相当。
研究表明,PTSD模型小鼠除存在恐惧记忆与焦虑行为外,往往伴随着体质量减轻、摄食减少、粪便量增多等表现[19-20]。本研究结果显示,短暂电击所致PTSD模型小鼠体质量在实验前后无明显变化,但在僵住实验中,模型小鼠粪便量显著增加;与模型组相比,舍曲林组小鼠粪便量无显著性差异,而ESJWT治疗组小鼠粪便量显著降低。粪便量通常反映PTSD模型小鼠的恐惧反应与紧张程度,表明ESJWT能有效缓解PTSD模型小鼠的恐惧反应与紧张状态。ESJWT有效改善模型小鼠的PTSD样行为,可能与其多重抗抑郁作用有关。
ESJWT有效成分为金丝桃素和贯叶金丝桃素,能够从多个方面改善PTSD模型小鼠焦虑和抑郁等行为。①能有效抑制突触间隙5-HT,NE和DA等单胺类神经递质的再摄取,或直接与神经递质受体结合,提高突触间隙神经递质浓度[21];②ESJWT具有与抗抑郁药物去甲丙咪嗪相同的作用,能够降低大鼠胶质瘤细胞β2肾上腺素能的敏感性,同时还能减少细胞膜表面β1肾上腺素受体的密度并抑制下游的信号传导,发挥其抗抑郁的作用[22];③ 能够调节下丘脑-垂体-肾上腺素轴(hypo⁃thalamic-pituitary-adrenal axis,HPA),具有对抗抑郁患者HPA亢进的作用[21];④ 动物实验发现,ESJWT能通过激活阿片类依赖途径或抑制蛋白激酶C提高动物的疼痛阈值,发挥止痛作用[13];同时还具有抗氧化应激、抗炎等作用,能够减轻模型小鼠神经系统的损害,并间接改善小鼠的焦虑、抑郁状态。此外,大量的临床研究发现,在抑郁症的治疗中,ESJWT与SSRIs类药物有相同的疗效,且安全性更高[14]。同时从经济角度出发,ESJWT的成本更低,患者的依从性更好[15],这或许为临床防治PTSD提供了一种新的思路。
研究表明,PTSD患者体内单胺类神经递质NE和5-HT的变化可能与PTSD的发病机制有关,NE和5-HT的含量与PTSD焦虑行为存在着直接的联系,其中NE还参与PTSD患者恐惧记忆的巩固[23-24]。Spivak等[25]研究发现,PTSD患者血浆NE和5-HT含量较正常人会发生明显变化,NE含量升高且5-HT含量下降。本研究对PTSD模型小鼠血清NE和5-HT的含量进行了检测。研究结果显示,各组小鼠血清NE和5-HT含量无显著性差异。据报道,在动物体内一些药物与神经递质的浓度存在着周期性变化,不同时间点检测可能会出现不同的结果[26]。Yehuda等[27]认为,PTSD模型小鼠的行为及体内神经递质的改变与建模方式有关,小鼠在经历应激事件之后,为避免机体进一步损害会进行稳态调节,使体内神经递质水平维持正常。这些可能是导致本研究结果出现差异的主要原因。另外,Wilson等[28]在大鼠海马与前额叶皮质中也发现了5-HT含量下降、NE含量升高的现象,这与血浆中的变化一致。但由于本研究并未检测脑内单胺类神经递质含量的变化,因此二者之间的联系仍待进一步探讨。
综上所述,ESJWT可明显改善PTSD模型小鼠行为的变化。由于其在临床应用中较SSRI类药物更加经济实惠、安全有效,这为PTSD的防治提供了一种新的策略,但应用于临床治疗仍需要更多的研究进行验证。目前,ESJWT抗PTSD的作用机制尚不明确,有研究者认为PTSD小鼠体内炎症水平的升高可能与PTSD的发病机制有关[29],而ESJWT具有一定的抗炎作用[12]。因此,本课题组将对ESJWT对PTSD炎症水平的影响进行进一步研究。
参考文献:
[1]Fares J,Gebeily S,Saad M,Harati H,Nabha S,Said N,et al.Post-traumatic stress disorder in adult victims of cluster munitions in Lebanon:a 10-year longitudinal study[J/OL].BMJ Open,2017,7(8):e017214(2017-08-18).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5724068/
[2] Jorge RE.Posttraumatic stress disorder[J].Con⁃tinuum(Minneap Minn),2015,21(3 Behavioral Neurology and Neuropsychiatry):789-805.
[3]Kessler RC,Chiu WT,Demler O,Merikangas KR,Walters EE.Prevalence,severity,and comorbidity of 12-month DSM-Ⅳ disorders in the National Comor⁃bidity Survey replication[J].Arch Gen Psychiatry,2005,62(6):617-627.
[4] Sareen J,Houlahan T,Cox BJ,Asmundson GJ.Anxiety disorders associated with suicidal ideation and suicide attempts in the National Comorbidity Survey[J].J Nerv Ment Dis,2005,193(7):450-454.
[5]Schnurr PP,Lunney CA,Bovin MJ,Marx BP.Posttraumatic stress disorder and quality of life:extension of findings to veterans of the wars in Iraq and Afghanistan [J].ClinPsycholRev,2009,29(8):727-735.
[6]Sareen J,Afifi TO,McMillan KA,Asmundson GJ.Relationship between household income and mental disorders:findings from a population-based longi⁃tudinal study[J].Arch Gen Psychiatry,2011,68(4):419-427.
[7] Tucker P,Potter-Kimball R,Wyatt DB,Parker DE,Burgin C,Jones DE,et al.Can physiologic assess⁃ment and side effects tease out differences in PTSD trials? A double-blind comparison of citalo⁃pram,sertraline,and placebo[J].Psychopharma⁃col Bull,2003,37(3):135-149.
[8] Amos T,Stein DJ,Ipser JC.Pharmacological interventions for preventing post-traumatic stress disorder(PTSD)[J/OL].CochraneDatabase Syst Rev,2014,(7):CD006239(2014-07-08).http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD006239.pub2/abstract;jsessionid=6C460EFBC0A 074E33EA7B2C1C2EAC52E.f04t01#pdf-section
[9]Friedman MJ,Marmar CR,Baker DG,Sikes CR,Farfel GM.Randomized,double-blind comparison of sertraline and placebo for posttraumatic stress disorder in a department of veterans affairs setting[J].J Clin Psychiatry,2007,68(5):711-720.
[10] Müller WE.Current St John′s wort research from mode of action to clinical efficacy[J].Pharmacol Res,2003,47(2):101-109.
[11] Ng QX,Venkatanarayanan N,Ho CY.Clinical use ofHypericum perforatum(St John′s wort)in depres⁃sion:A meta-analysis[J].J Affect Disord,2017,210:211-221.
[12] Hohmann MS,Cardoso RD,Fattori V,Arakawa NS,Tomaz JC,Lopes NP,et al.Hypericum perforatumreduces paracetamol-induced hepatotoxicity and lethality in mice by modulating inflammation and oxidative stress[J].Phytother Res,2015,29(7):1097-1101.
[13] Galeotti N.Hypericum perforatum(St John′s wort)beyond depression:A therapeutic perspective for pain conditions[J].J Ethnopharmacol,2017,200:136-146.
[14] Cui YH,Zheng Y.A meta-analysis on the efficacy and safety of St John′s wort extract in depression therapy in comparison with selective serotonin reuptake inhibitors in adults[J].Neuropsychiatr Dis Treat,2016,12:1715-1723.
[15] Solomon D,Ford E,Adams J,Graves N.Potential of St John′s wort for the treatment of depression:the economic perspective[J].Aust N Z J Psychiatry,2011,45(2):123-130.
[16] Cheng QR,Fang HM,Li FQ,Song SS,Zhang LJ.The protective effect ofHypericum perforatum.L on acute immunological liver injury in mice[J].Acta Univ Med Anhui(安徽医科大学学报),2015,50(4):477-481.
[17] Ji YJ,Zhang LM,Sun SZ,Li YF,Wang HL,Zhang YZ.Effect of dizocilpine on behavior of post-traumatic stress disorder model mice induced by short electric foot-shocks[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(3):371-376.
[18] Zhang LM,Qiu ZK,Zhao N,Chen HX,Liu YQ,Xu JP,et al.Anxiolytic-like effects of YL-IPA08,a potent ligand for the translocator protein(18 kDa)in animal models of post-traumatic stress disorder[J].Int J Neuropsychopharmacol,2014,17(10):1659-1669.
[19] Harris RB,Mitchell TD,Simpson J,Redmann SM Jr,Youngblood BD,Ryan DH.Weight loss in rats exposed to repeated acute restraint stress is inde⁃pendent of energy or leptin status[J].Am J Physiol Regul Integr Comp Physiol,2002,282(1):R77-R88.
[20] Saur L,Baptista PP,Bagatini PB,Neves LT,de Oliveira RM,Vaz SP,et al.Experimental posttraumatic stress disorder decreases astrocyte density and changes astrocytic polarity in the CA1 hippo⁃campus of male rats[J].Neurochem Res,2016,41(4):892-904.
[21] Schmidt M,Butterweck V.The mechanisms of action of St.John′s wort:an update[J].Wien Med Wochenschr,2015,165(11-12):229-235.
[22]Jakobs D,Hage-Hülsmann A,Prenner L,Kolb C,Weiser D,Häberlein H.Downregulation of β1-adren⁃ergic receptors in rat C6 glioblastoma cells by hyperforin and hyperoside from St John′s wort[J].J Pharm Pharmacol,2013,65(6):907-915.
[23]Goddard AW,Ball SG,Martinez J,Robinson MJ,Yang CR,Russell JM,et al.Current perspectives of the roles of the central norepinephrine system in anxietyand depression[J].DepressAnxiety,2010,27(4):339-350.
[24] Southwick SM,Paige S,Morgan CA 3rd,Bremner JD,Krystal JH,Charney DS.Neurotransmitter alterations in PTSD:catecholamines and serotonin[J].Semin Clin Neuropsychiatry,1999,4(4):242-248.
[25] Spivak B,Vered Y,Graff E,Blum I,Mester R,Weizman A.Low platelet-poor plasma concentrations of serotonin in patients with combat-related post⁃traumaticstressdisorder[J].BiolPsychiatry,1999,45(7):840-845.
[26] Hageman I, Andersen HS, Jørgensen MB.Post-traumatic stress disorder:a review of psychobiology and pharmacotherapy[J].Acta Psychiatr Scand,2001,104(6):411-422.
[27] Yehuda R,Antelman SM.Criteria for rationally evaluating animal models of posttraumatic stress disorder[J].Biol Psychiatry,1993,33(7):479-486.
[28] Wilson CB, Ebenezer PJ, McLaughlin LD,Francis J.Predator exposure/psychosocial stress animal model of post-traumatic stress disorder modulates neurotransmitters in the rat hippocampus and prefrontal cortex[J/OL].PLoS One,2014,9(2):e89104(2014-02-14).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3925189/
[29]Michopoulos V,Powers A,Gillespie CF,Ressler KJ,Jovanovic T.Inflammation in fear-and anxietybased disorders:PTSD,GAD,and beyond[J].Neuropsychopharmacology,2017,42(1):254-270.
