墨西哥黄唇鱼鱼肉胶原肽促进小鼠伤口愈合作用
2018-05-01来梦婕陈玉峰楚秉泉
来梦婕,陈玉峰,张 英,楚秉泉
(浙江大学生物系统工程与食品科学学院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程研究中心,浙江杭州 310058)
伤口愈合是由多种细胞、细胞因子参与的复杂且耗能的过程[1]。营养不良与饮食摄入不足可显著延缓一般性手术及慢性伤口的恢复。伤口愈合时,为了维持自身内环境稳定,机体会产生局部或全身性炎症反应,导致基础代谢率增高,能量消耗增加,机体易出现负氮平衡[2]。负氮平衡的持续加剧将直接导致体内蛋白质的大量流失。Kumar等[3]发现胶原蛋白作为细胞外基质重要组成成分,外敷可促进伤口愈合,如Chikazu等[4]研究证明深海胶原蛋白凝胶敷料对糖尿病小鼠切除型伤口愈合非常有用,Zhang等[5]发现口服鲑鱼皮肽具有促进创伤型大鼠伤口愈合的潜力。
加利福尼亚湾石首鱼(Totoabamacdonaldi),又称麦氏托头石首鱼、加州犬型黄花鱼,属硬骨鱼纲、鲈形目、石首鱼科,其最大可长至2 m重至100 kg,或者更甚,是该科最大型的海洋鱼类,为墨西哥加利福尼亚湾的特有鱼种[6]。其鱼鳔与中国黄唇鱼(Bahabaflavolabiata)的鱼鳔形态相似且名贵[7],加湾石首鱼也因此被称为“墨西哥黄唇鱼”。自上世纪60年代以来,因过度捕捞及栖息地生态变化,自然资源频临衰竭[6]。自然捕获的墨西哥黄唇鱼基本停留在“杀鱼取鳔”的原始阶段,由于其鱼肉口感粗糙,经济价值不高,常被直接丢回大海,造成水域污染和资源浪费。近年来,随着人工繁殖和增殖放流技术的突破,养殖墨西哥黄唇鱼取鳔后鱼体的综合利用和高值转化受到关注。
本研究以墨西哥黄唇鱼肉为原料,利用复合酶法首次制得口服易吸收的寡肽,运用小鼠皮肤创伤模型,探索其对伤口愈合的促进作用,以期开发一种能够显著促进伤口愈合的高品质口服胶原肽功能食材,为取鳔后墨西哥黄唇鱼肉的高值转化提供技术支撑。
1 材料与方法
1.1 材料与仪器
墨西哥黄唇鱼冻品 浙江黄唇渔生物科技有限公司;碱性蛋白酶(10万IU)、复合风味蛋白酶(1.4万IU) Novozymes公司;L-甲硫氨酸(纯度>99%)、核糖核酸酶A(纯度>99%) Sigma公司;成骨生长肽(纯度>97%)、胸腺五肽(纯度>90%) 杭州中肽生物有限公司;雄性ICR小鼠SPF级,体重(25±2) g,合格证号SCXK(沪)2012-0005 上海斯莱克实验动物有限责任公司;羟脯氨酸试剂盒 南京建成科技有限公司;VEGF多克隆抗体、兔抗bFGF和HRP-山羊抗兔二抗 Servicebio公司。
JYL-C022E型多功能料理机 九阳股份有限公司;HHS21-Ni6型电热恒温水浴锅 北京长安科学仪器厂;LGJ-200F型冷冻干燥机 北京博医康实验仪器有限公司;L-8900型全自动氨基酸分析仪 日本日立公司;208型凝胶渗透色谱仪 WATERS公司;RM2016型病理切片机 上海徕卡仪器有限公司;722E型可见分光光度计 上海光谱仪器有限公司;NIKON ECLIPSE TI-SR型倒置荧光显微镜 日本尼康公司。
1.2 实验方法
1.2.1 墨西哥黄唇鱼肉胶原肽(TMCP)的制备 冷冻的鱼体解冻后用流水洗净,绞碎制成鱼糜,密封袋分装,冰冻备用。根据王岩等[8]利用双酶法制备鲢鱼水解肽的工艺参数及前期实验优化,制备步骤如下:将鱼糜分散于蒸馏水中,料∶水比为 1∶2 (g/mL),加热至50 ℃后,调节pH为7.0,加入1.0%的复合酶(碱性蛋白酶∶复合风味蛋白酶=1∶2),酶解时间为4 h,待反应结束后,至沸水浴中加热20 min使酶失活,然后将酶解液在10000 r/min下离心10 min,取上清液,冷冻干燥,制得TMCP 冻干粉。
1.2.2 TMCP的氨基酸组成分析 根据 GB/T 5009.124-2016《食品安全国家标准食品中氨基酸的测定》[9]方法进行TMCP的前处理,氨基酸分析仪测定其氨基酸种类及含量。
1.2.3 TMCP的分子量分布测定 采用Waters凝胶色谱系统测定TMCP的分子量分布范围,色谱条件为:凝胶柱:TOSOH TSK gel G2000 SWXL(7.8 mm×30 cm),波长:220 nm;流动相:乙腈-水-三氟乙酸(三者体积比10∶90∶0.1);进样量:40 μL;柱温:40 ℃;流速:0.6 mL/min[10]。
1.2.4 小鼠皮肤创伤模型的构建 实验小鼠经1%戊巴比妥钠麻醉后,剃去背毛,经常规皮肤消毒,在脊柱中部左右两侧相同位置盖上圆形印章(直径为8.0 mm),无菌条件下用手术剪沿印记边缘剪去皮肤,制造出圆形全层皮肤伤口。造模后进行单笼饲养,并将造模当天记为第0 d。
1.2.5 动物分组与实验 取40只体重为(25±2) g的小鼠,随机分为4组,每组10只,分别为空白对照组、胶原肽低剂量组(TMCP_L,0.66 g/kg·bw)、中剂量组(TMCP_M,1.33 g/kg·bw)、高剂量组(TMCP_H,2.0 g/kg·bw)。空白对照组给予等体积溶剂(去离子水)灌胃。术后次日起,每日灌胃。分别于造模后的第7 d和第14 d分批处死动物(每组每批各5只)。每次处死后的小鼠分别切取其左右两侧伤口边缘3.0 mm的全层皮肤组织,右侧固定于4%多聚甲醛24 h以上,制成石蜡切片,用于HE染色分析、Masson染色分析和免疫组织化学染色分析;左侧用于测定羟脯氨酸含量。造模及取样部位见图1。

图1 小鼠皮肤创伤模型示意图Fig.1 Sketch map of the wound healing in mice
1.2.6 伤口愈合率测定 每日观察伤口变化情况,每隔2 d给小鼠伤口拍照,采用毫米方格坐标纸记数法计算小鼠的伤口面积,观察时间为0~14 d。伤口完全愈合即创面完全上皮化的标准:愈合面积大于原始伤口面积的95%(即伤口面积小于原始伤口面积的5%)[11]。
伤口愈合率(%)=(初始创面面积-未愈合创面面积)/初始创面面积×100
1.2.7 伤口组织病理学分析(HE染色) 将1.2.5中制得的组织切片用甲苯-无水酒精脱去石蜡,然后经过100%、70%、50%、20%、0%的乙醇洗涤,切片入Harris苏木素染3~8 min,自来水洗,1%的盐酸乙醇(70%乙醇做溶剂)分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗。切片入伊红染液中染色1~3 min。脱水封片后在显微镜下观察伤口愈合过程中的病理变化。
1.2.8 胶原含量分析(Masson染色) 将1.2.5中制得的组织切片同1.2.7步骤做脱蜡处理。用weigert铁苏木素染料(weigert铁苏木素A、B液等比例混和)染5~10 min,流水稍洗。1%盐酸酒精分化,流水冲洗数分钟。丽春红酸性品红染液染5~10 min,流水稍冲洗。磷钼酸溶液处理约5 min,不用水洗,直接用苯胺蓝染液复染15 min。1%冰醋酸处理30 s,95%酒精脱水多次。无水酒精脱水,二甲苯透明,中性树胶封固。在显微镜下观察伤口愈合过程中胶原沉积的变化,胶原纤维呈蓝色,肌纤维、纤维素呈紫红色。每个样本随机找5个不同的视野拍摄照片,使用Image-Pro Plus 6.0图像分析软件计算胶原含量。
1.2.9 伤口组织的羟脯氨酸含量测定 作为胶原蛋白特异性的基本成分,羟脯氨酸的含量可以作为伤口组织中胶原含量的重要指标[12]。依据羟脯氨酸试剂盒(碱水解法)操作方法,组织水解后调节pH为6.5,加入20 mg活性炭,混匀,在3500 r/min下离心10 min,取上清液1 mL,与检测液按要求混匀,3500 r/min下离心10 min,取上清液,550 nm处测定吸光度,计算羟脯氨酸含量。
羟脯氨酸含量(μg/mg湿重)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品含量(5 μg/mL)×水解液总体积(10 mL)/组织湿重(mg)
1.2.10 免疫组织化学染色法分析 1.2.5中制得的组织切片经抗原修复和血清封闭后,在切片上滴加VEGF多克隆抗体(稀释度1∶200)和兔抗bFGF(稀释度1∶300),4 ℃过夜,次日滴加山羊抗兔二抗(稀释度1∶200)及抗生物素蛋白-生物素过氧化物酶复合物,DAB显色,苏木素复染,阳性细胞呈棕黄色。每组内每张切片随机挑选3个400倍视野进行拍照,拍照时尽量让组织充满整个视野,保证每张照片的背景光一致[13]。应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,分析得出每张照片阳性的积分光密度值(Integrated Optical Density,IOD)。
1.3 数据处理

2 结果与分析
2.1 墨西哥黄唇鱼胶原肽(TMCP)的氨基酸组成分析
从TMCP中检测出22种氨基酸,包括8种必需氨基酸、2种半必需氨基酸、8种非必需氨基酸和4种特殊氨基酸,氨基酸组成较为全面。根据表1,TMCP中必需氨基酸占氨基酸总量的比值(WEAA/WTAA)为40.04%,必需氨基酸与非必需氨基酸的比值(WEAA/WNEAA)为81.91%。根据FAO/WHO的理想模式,质量较好的蛋白质其组成氨基酸的WEAA/WTAA为40%左右,WEAA/WNEAA在60%以上[14]。因此,TMCP的氨基酸组成符合FAO/WHO评价标准,为营养价值较高的优质蛋白源。

表1 TMCP的氨基酸组成及含量Table 1 Amino acids composition and contents of TMCP
在TMCP的氨基酸测定中检出了4种特殊氨基酸,且具有相当高的含量(牛磺酸0.74%、γ-氨基丁酸1.03%、鸟氨酸0.37%、羟脯氨酸1.24%)。牛磺酸在脑神经细胞发育过程中起重要作用;γ-氨基丁酸在临床上主要用于降血压及恢复脑细胞功能;鸟氨酸参与体内氨态氮的排出和尿素形成;羟脯氨酸在许多蛋白质中含量很低或没有,但是胶原蛋白的主要组成部分,占了25%以上[7]:与区又君等[7]报道的野生黄唇鱼鳔中的氨基酸组成相类似,推测其肌肉及其水解物也应具有与鱼鳔相似的保健功能和药用价值。
2.2 TMCP的分子量分布
凝胶色谱系统分析结果见图2,经碱性蛋白酶与复合风味蛋白酶酶解得到的TMCP峰形良好,分散度小,分子量均一,测定得其平均分子量(Mw)为837 Da,是约由5~8个氨基酸组成的寡肽。张宁等[15]通过胃炎大鼠模型发现胶原肽平均分子量1 kDa的吸收率>3 kDa的吸收率>20 kDa的吸收率,推测平均分子量837 Da寡肽受胃消化过程影响小,可通过运载体直接进入血液,吸收速度快。本文采用独特的酶解技术制备得到的TMCP寡肽分子量小于1 kDa,极易被人体吸收。

图2 TMCP分子量测定的凝胶色谱图Fig.2 Results from gel permeation chromatography measurement
2.3 TMCP对小鼠伤口愈合率的影响
由图3可知,随着造模后愈合时间的增加,各组小鼠的创面面积均逐渐减小,伤口愈合率随之升高。造模后第4 d起,TMCP处理组的伤口愈合率均高于空白对照组,并在造模后的第2、4、6 d,呈现出一定的剂量依赖关系,且低(0.66 g/kg)剂量从第4 d起即已表现出极好的促进愈合作用;在造模后第2周,TMCP处理组间的伤口愈合率无显著差异,在造模后第14 d均完全愈合(伤口愈合率达到95%),与空白对照组存在极显著差异(p<0.01)。造模后第6 d,TMCP处理组的伤口愈合率极显著高于空白对照组(p<0.01)。说明TMCP可以加速伤口愈合,尤其是在愈合前期表现出极好的促进效果。

图3 TMCP对小鼠伤口愈合的影响Fig.3 The effect of TMCP on the wound healing of mice
2.4 TMCP对小鼠皮肤伤口组织病理变化的影响
伤口愈合是一个复杂的生物学过程,有多种细胞和组织成分参与,包括成纤维细胞增殖、胶原分泌、新生血管生成、表皮细胞增殖和伤口的上皮化等[1]。TMCP对小鼠伤口组织病理变化的影响见图4。造模后第7 d,空白对照组小鼠皮肤伤口组织中有大量炎症细胞浸润(炎症细胞在反应灶聚集,多为核圆形,着色深),少量新生血管(多为卵圆形,多在创面处),表皮组织尚未形成;TMCP_L组伤口组织中有较多炎症细胞浸润,新生血管丰富,少量成纤维细胞(多为突起的纺锤形或星形的扁平状结构)[16]开始分泌胶原纤维;TMCP_M组伤口组织中有少量炎症细胞,少量成纤维细胞,大量胶原纤维生成,表皮组织逐渐形成;TMCP_H组伤口组织中有少量炎症细胞,较多成纤维细胞,大量胶原纤维生成,并有毛囊等皮肤附属器产生,表皮组织逐渐形成。

图4 造模后第7 d小鼠皮肤伤口组织病理切片观察(HE,×100)Fig.4 Representative micrographs of H&E stained wound tissues in mice at day 7(HE,×100)注:a为空白对照组;b为TMCP_L组;c为TMCP_M; d为TMCP_H组;I为炎症细胞;V为血管; F为成纤维细胞;E为表皮。
如图5,造模后第14 d,空白对照组仍有较多炎症细胞浸润,肉芽组织(初始阶段的纤维结缔组织)[16]新鲜,新生较多胶原纤维;TMCP_L组有少量炎症细胞浸润,成纤维细胞生成大量胶原纤维,表皮组织基本形成;其余两组基本无炎性渗出物,大量成纤维细胞和胶原纤维出现,且胶原纤维排列有序,肉芽组织较对照组成熟,创口边缘均有较厚的新生表皮。

图5 造模后第14 d小鼠皮肤伤口组织病理切片观察(HE,100×)Fig.5 Representative micrographs of H&E stained wound tissues in mice at day 14(HE,×100)注:A为空白对照组;B为TMCP_L组;C为TMCP_M组; D为TMCP_H组;I为炎症细胞; V为血管;F为成纤维细胞;E为表皮。
组织病理学分析结果表明,中、高剂量组的TMCP能够趋化诱导炎症细胞,刺激成纤维细胞增殖和分化并伴随新的毛细血管和表皮组织的生长,表明TMCP可以促进上皮组织重塑过程。
2.5 TMCP对小鼠伤口组织中胶原含量的影响
TMCP对小鼠皮肤伤口组织中胶原含量的影响如表2所示。随着造模后天数的增加,各组中胶原纤维均逐渐增多。造模后第7、14 d,TMCP处理组胶原含量与空白对照组相比均有极显著差异(p<0.01);且TMCP三个剂量组间也存在显著差异(p<0.05),胶原含量呈现剂量依赖关系。伤口愈合过程中,纤维细胞通过沉积和降解胶原蛋白分子,使胶原纤维有序排列重构胶原化的真皮结构[17]。曾有文献[18]报道,在体外NIH/3T3成纤维细胞模型中,刺参多肽能显著提高I型胶原的分泌量。

表2 TMCP对小鼠伤口组织中胶原含量的影响Table 2 The effect of TMCP on the collagen content in wound tissue
2.6 TMCP对小鼠伤口组织中羟脯氨酸含量的影响
由于羟脯氨酸在胶原蛋白中占13.4%,是胶原蛋白特征性成份之一[19],因此可以通过检测羟脯氨酸的含量进一步反映胶原蛋白的量。TMCP对小鼠伤口愈合过程中羟脯氨酸含量的影响见表3。可知,随着愈合天数的增加,伤口组织中的羟脯氨酸含量也随之增加。第7、14 d时,TMCP_M组与TMCP_H组伤口组织中的羟脯氨酸含量差异不显著(p>0.05),但均极显著高于空白对照组(p<0.01)。第14 d时,TMCP_L组与TMCP_M组伤口组织中的羟脯氨酸含量差异不显著(p>0.05),但均高于空白对照组。这与半定量分析胶原含量的结果较一致。

表3 TMCP对小鼠伤口组织中羟脯氨酸含量的影响Table 3 The effect of TMCP on the Hydroxyproline content in wound tissue
2.7 免疫组织化学染色分析结果
2.7.1 TMCP对小鼠皮肤伤口组织中VEGF表达的影响 血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)[20]是目前研究发现功能最强大、作用范围最广的促血管生成因子,能够促进血管内皮细胞增殖、分化、迁移,从而促进新生血管形成[21]。TMCP对小鼠伤口组织中VEGF表达的影响见表4、图6,随着造模后天数的增加,伤口组织中的VEGF表达量呈增加趋势。造模后第7、14 d,TMCP处理组中VEGF表达均极显著高于对照组(p<0.01),且在愈合前期,TMCP处理组的VEGF表达量约两倍于空白对照组。实验表明,TMCP在伤口愈合前期对VEGF的表达具有极其显著的促进作用,这与王毅等[22]、Lee等[23]对创伤愈合中VEGF表达的生物动力学变化的研究结果一致。

表4 TMCP对小鼠伤口组织中VEGF表达的影响Table 4 The effect of TMCP on the expression of VEGF in wound tissue

图6 TMCP对小鼠伤口组织中VEGF表达的影响(400×)Fig.6 The effect of TMCP on the expression of VEGF in wound tissue(400×)注:图中箭头所指的棕黄色颗粒为阳性信号;图7同。
2.7.2 TMCP对小鼠皮肤伤口组织中bFGF表达的影响 伤口创面中碱性成纤维细胞生长因子(Basic Fibroblast Growth Factor,bFGF)的高表达,有助于伤口愈合过程中肉芽组织的增生[24]。TMCP对小鼠伤口组织中bFGF表达的影响见表5、图7,随着造模后天数的增加,伤口组织中的bFGF表达量呈增加趋势。造模后第7 d,TMCP_L组中bFGF表达显著高于空白对照组(p<0.05),中、高剂量组极显著高于对照组(p<0.01)。造模第14 d,对照组及TMCP_L组的bFGF表达量均上升,而中、高剂量组的表达量小幅上涨。从实验结果来看,TMCP在整个伤口愈合期对bFGF的表达均有促进作用,Sadanori等[25]发现在早期损伤阶段bFGF可通过激活ERK通路诱导成纤维细胞增殖与DNA合成,这与TMCP中、高剂量组成纤维细胞在愈合前期大量生成的结果相近。

表5 TMCP对小鼠伤口组织中bFGF表达的影响Table 5 The effect of TMCP on the expression of bFGF in wound tissue
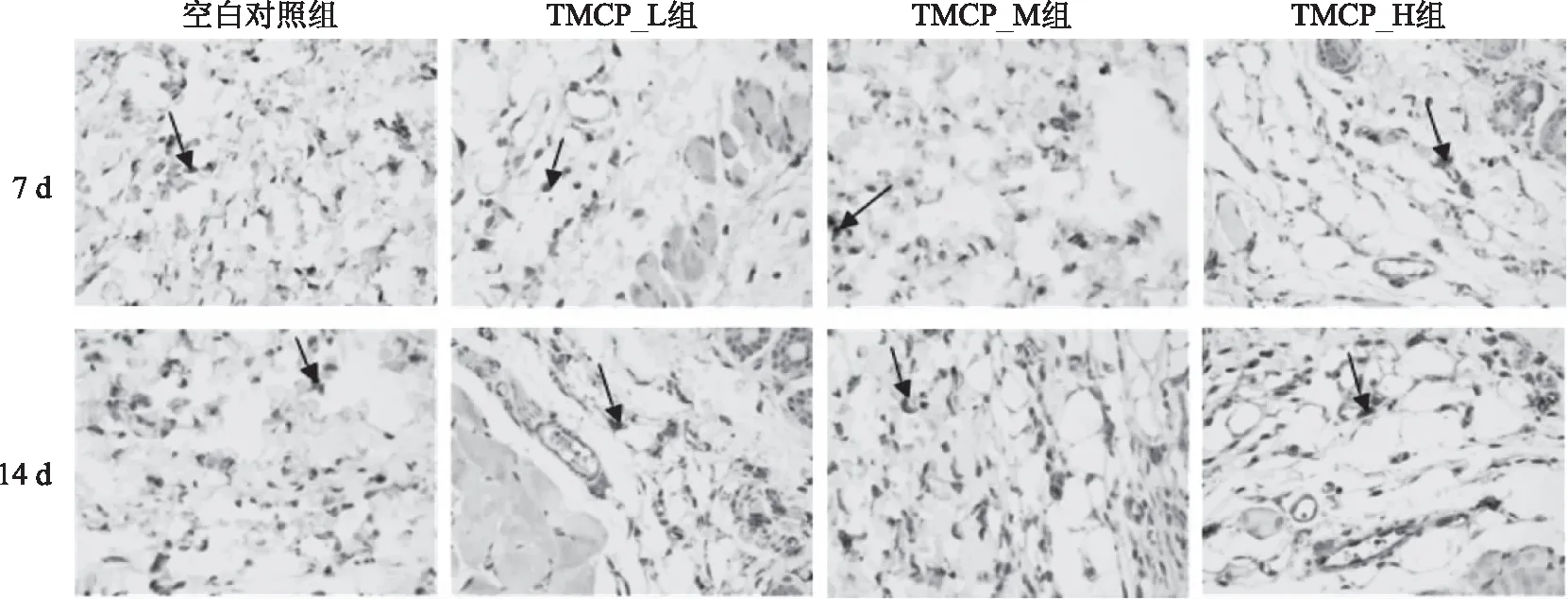
图7 TMCP对小鼠伤口组织中bFGF表达的影响(400×)Fig.7 The effect of TMCP on the expression of bFGF in wound tissue(400×)
因此推测,TMCP通过提高bFGF和VEGF的表达从而加快细胞增殖和血管生成,是其促进小鼠伤口愈合的机制之一。
3 结论与讨论
本研究经复合酶解处理墨西哥黄唇鱼肉,得到数均分子量为837 Da的寡肽(TMCP),氨基酸组成分析为营养价值较高的优质蛋白源,其中有相当高含量的牛磺酸、γ-氨基丁酸、鸟氨酸和羟脯氨酸。利用小鼠伤口愈合模型,结合伤口愈合率、病理组织切片观察、胶原及羟脯氨酸含量测定和bFGF、VEGF生长因子表达等指标,TMCP在所试剂量(0.66~2.0 g/kg)范围内都表现出良好的促进小鼠皮肤伤口愈合的作用,并在造模后的第一周内表现出一定的剂量依赖关系,初步探索表明墨西哥黄唇鱼胶原肽(TMCP)对促进伤口恢复有极大潜力。从全过程综合指标分析来看,中剂量与高剂量的效果相当。后续新产品研发中的整体动物实验建议参照TMCP中剂量水平(1.33 g/kg)来优化产品组方及进行相关的生物学效应和作用机制研究。
近年如何促进伤口愈合速度并提高愈合质量一直是研究的热点。目前,相当一部分难愈合慢性创伤或溃疡多继发于糖尿病和老年病等,这可能与患者皮肤的特殊微环境和体内免疫应答功能障碍有关[26]。糖尿病患者体内高糖环境更会不断促进炎症反应的发生,约有25%的糖尿病患者终生伴有糖尿病足部溃疡,其中,20%的患者由于不当的治疗或护理导致严重溃烂感染而被迫截肢[27]。TMCP的氨基酸组成含量丰富,特别是其含有4种极具药用价值的特种氨基酸,可期望用于调节免疫应答及改善体内微环境。因此,TMCP对慢性难愈创面的辅助治疗作用有待进一步研究。此外,由于口服营养品需要消化吸收时间,为了缩短伤口出血和凝血时间,临床上需要与敷料配合使用,这也为墨西哥黄唇鱼加工副产物鱼鳞、鱼皮等开发提供了思路。随着对墨西哥黄唇鱼研究的不断深入,其在医药及保健领域的应用会越来越广泛。
[1]Pereira R F,Bártolo P J. Traditional therapies for skin wound healing[J]. Advances in Wound Care,2016,5(5):208.
[2]Badjatia N,Monahan A,Carpenter A,et al. Inflammation,negative nitrogen balance,and outcome after aneurysmal subarachnoid hemorrhage[J]. Neurology,2015,84(7):680-687.
[3]Kumar N S S,Nazeer R A,Jaiganesh R. Wound healing properties of collagen from the bone of two marine fishes[J]. International Journal of Peptide Research andTherapeutics,2012,18(3):185-192.
[4]Chikazu D,Taguchi T,Koyama H,et al. Improvement in wound healing by a novel synthetic collagen-gel dressing in genetically diabetic mice[J]. Asian Journal of Oral and Maxillofacial Surgery,2010,22(2):61-67.
[5]Zhang Z,Wang J,Ye D,et al. Oral administration of marine collagen peptides from Chum Salmon skin enhances cutaneous wound healing and angiogenesis in rats[J]. Journal of the Science of Food and Agriculture,2011,91(12):2173-2179.
[6]Valenzuelaquionez F,Deandamontaez J A,Gilberthorvath E,et al. Panmixia in a critically endangered fish:the totoaba(Totoabamacdonaldi)in the Gulf of California[J]. Journal of Heredity,2016,107(6):496-503
[7]区又君,廖锐,李加儿,等.野生黄唇鱼Bahabaflavolabiata肌肉和鳔营养成分的分析与评价[J]. 海洋学报中文版,2010,3(3):113-120.
[8]王岩.鲢鱼蛋白水解物的双酶法制备工艺优化[J]. 中国调味品,2014(7):84-87.
[9]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. GB/T 5009.124-2016食品安全国家标准食品中氨基酸的测定[S]. 国家标准化管理委员会,2016.
[10]贾建萍,周彦钢,鲁健章,等. 三文鱼皮胶原肽的制备及其抗氧化活性的研究[J]. 中国食品学报,2010,10(4):94-99.
[11]屈建业.活体损伤的长度面积测量[J].法律与医学杂志,1994,1(1):24.
[12]Sharma S,Sikawar M S. Wound healing activity of ethanolic extract of leaves of Eclipta alba[J]. Pharmacognosy Magazine,2008,4(13):108-111.
[13]Werner S,Grose R. Regulation of wound healing by growth factors and cytokines[J]. Physiological Reviews,2003,83(3):835.
[14]庄平,宋超,章龙珍,等. 黄斑篮子鱼肌肉营养成分与品质的评价[J]. 水产学报,2008,32(1):77-83.
[15]张宁,康跻耀,高建萍,等. 胶原蛋白肽分子量对吸收过程的影响研究[J]. 生物学杂志,2013,30(2):10-13.
[16]裘莹,宋伯根. 病理学实习彩色图谱与学习指导[M]. 北京:清华大学出版社,2014.
[17]梁彩莉. 新型促伤口愈合药物的药效学评价及机制研究[D]. 天津:南开大学,2015.
[18]宋淑亮,王欢,梁浩,等. 海参肽的分离纯化及其对NIH/3T3细胞胶原蛋白分泌的影响[J]. 现代食品科技,2017(3):22-28.
[19]杨秀颖,杜冠华. 组织羟脯氨酸含量微量测定方法及应用[J]. 中国药理学通报,2004,20(7):836-837.
[20]Mangoni M L,Mcdermott A M,Zasloff M. Antimicrobial peptides and wound healing:biological and therapeutic considerations[J]. Experimental Dermatology,2016,25(3):167.
[21]Gopalakrishnan A,Ram M,Kumawat S,et al. Quercetin accelerated cutaneous wound healing in rats by increasing levels of VEGF and TGF-β1[J]. Indian Journal of Experimental Biology,2016,54(3):187.
[22]王毅,田野,王东,等. 血清VEGF、Ang-1和G-CSF动态变化对急性颅脑损伤预后的影响[J]. 中华神经外科杂志,2016,32(6):579-583.
[23]Lee E Y,Xia Y,Kim W S,et al. Hypoxia-enhanced wound-healing function of adipose-derived stem cells:increase in stem cell proliferation and up-regulation of VEGF and bFGF[J]. Wound Repair and Regeneration,2009,17(4):540-547.
[24]陈佳,罗成群. 碱性成纤维细胞生长因子(bFGF)与创伤愈合[J]. 中国烧伤创疡杂志,2005,17(1):74-76.
[25]Akita S,Akino K,Hirano A. Basic fibroblast growth factor in scarless wound healing[J]. Advances in Wound Care,2013,2(2):44.
[26]Herman W H. The economic costs of diabetes:is it time for a new treatment paradigm[J]. Diabetes Care,2013,36(4):775.
[27]朱万博. 糖尿病患者创面难愈机制及治疗研究进展[J]. 中国糖尿病杂志,2016,24(12):1135-1139.
