植物乳杆菌SCS2不同受试物对小鼠血糖及氧化应激的影响
2018-05-01蒋丽施刘蜀坤
孟 晓,蒋丽施,陈 艳,刘蜀坤
(成都中医药大学公共卫生学院,四川成都 611137)
乳酸菌作为公认安全(GRAS)的食品级微生物,具有几乎无毒副作用、性质稳定温和、效果明显持久的特点,且兼具缓解乳糖不耐症、治疗腹泻、调节宿主的肠道菌群、抑制肠道中促癌酶活性、免疫调节等多种生理活性和有益功能,已成为相关领域研究人员关注的热点[1-3]。值得关注的,国内外研究者观察到乳酸菌作为一种安全有效的生物效应调节剂,还具有改善氧化应激的作用[4-7]。而氧化应激已被证实是以高血糖水平为特征的Ⅱ型糖尿病进程中起关键作用的致病因素[8]。
有研究结果显示,与模型组相比,低剂量(108CFU/mL)植物乳杆菌NCU116(LactobacillusplantarumNCU116)能够显著降低糖尿病(雄性Wistar)大鼠的血糖水平,其血清中过氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(CAT)的活性显著提高,丙二醛(malonaldehyde,MDA)含量显著降低[4]。此外,Ejtahed等[5]通过让高血糖患者食用含有嗜酸乳杆菌La5(LactobacillusacidophilusLa5)和双歧杆菌Bb12(BifidobacteriumBb12)的酸奶6周,发现与食用普通酸奶的患者相比,其空腹血糖水平均显著下降,机体红细胞中SOD和GSH-Px活性以及总抗氧化能力显著提高,而血清中MDA含量也显著低于所有受试对象的平均水平。同样的,也有研究发现,低剂量(2.0×108CFU/mL)干酪乳杆菌Zhang(LactobacilluscaseiZhang)可以改善高脂膳食动物(雄性Wistar大鼠)的氧化应激水平,提高其血清和肝脏中SOD和GSH-Px等抗氧化酶活性,降低MDA水平[6]。上述研究结果均提示乳酸菌在改善机体氧化应激水平方面表现出积极的作用,但目前仍不能明确乳酸菌改善氧化应激的功能组分及其作用机制。
在前期研究中已经证实来源于发酵香肠的1株植物乳杆菌(LactobacillusplantarumSCS2,L.plantarumSCS2)能够显著降低STZ诱导的高血糖模型小鼠血糖水平,提高其葡萄糖耐受能力;同时,还能够改善由于高血糖引起的如小鼠体重减轻、血浆中K+丢失,Na+和Cl-含量升高以及肝糖原含量升高等问题[9]。但其发挥作用的关键因子及其与氧化应激的关系尚不清楚。因此,本文以链脲佐菌素(Streptozocin,STZ)结合高脂高糖饲料诱导的高血糖模型小鼠为研究对象,L.plantarumSCS2发酵液上清液、菌体悬浮液和细胞内容物悬浮液为受试物,研究灌胃不同受试物对实验小鼠体重、空腹和餐后2 h血糖、葡萄糖耐受能力、血清中MDA含量和SOD、GSH、GSH-Px活性等指标的影响,并分析L.plantarumSCS2降血糖作用的关键因子及其与氧化应激的关系,为进一步研究L.plantarumSCS2的降血糖作用机制提供理论基础和数据支撑。
1 材料与方法
1.1 材料与仪器
L.plantarumSCS2 分离自四川发酵香肠,成都中医药大学公共卫生学院实验中心保藏;4周龄SPF级KM雄性小鼠[SCXK(川)2015-030]、基础饲料和高糖高脂饲料 四川成都达硕实验动物有限公司;STZ 上海阿拉丁生化科技股份有限公司;MRS(De Mann,Rogosa and Sharpe)培养基、氯化钠等 均为分析纯,四川成都科龙化工试剂厂;MDA和SOD酶联免疫分析(ELISA)试剂盒 上海远慕生物科技有限公司;GSH和GSH-Px ELISA试剂盒 上海酶联生物科技有限公司。
HH·B11-BS-Ⅱ型电热恒温培养箱 上海跃进医疗器械有限公司;立式压力蒸汽灭菌器 致微(厦门)仪器有限公司;SW-CJ-2FD型洁净工作台 苏州安泰空气技术有限公司;血糖仪 勤立生物科技股份有限公司;H2050R-1型高速冷冻离心机 湘仪离心机仪器有限公司;YCD-EL200型冰箱 中科美菱低温科技有限责任公司。
1.2 实验方法
1.2.1 不同受试物的制备 取斜面保存L.plantarumSCS2菌株,加入5 mL、0.85%灭菌生理盐水,振摇混匀制成菌悬液,以1%接种量(V∶V)接种于MRS液体培养基,在36 ℃条件下培养18 h,用0.85%灭菌生理盐水调整菌悬液浓度为108CFU/mL。将上述发酵液离心处理5 min(3000×g,5 ℃),收集上清液备用;沉淀菌体用0.85%灭菌生理盐水制成菌体悬浮液备用。采用上述方法重新获取相同浓度菌体悬浮液,在冰浴条件下超声间歇处理(超声功率400 W,时间间隔5 s)30 min,3000×g,5 ℃ 离心5 min,收集上清液作为细胞内容物备用[10-11]。
1.2.2 实验分组和高血糖模型小鼠的建立 60只4周龄SPF级雄性KM小鼠用完全随机法分为5组,即普通组(NG)、模型组(MG)、菌悬液组(TG1)、发酵液上清液组(TG2)和内容物组(TG3)。实验小鼠以基础饲料适应性喂养3周后,MG、TG1、TG2和TG3组小鼠禁食不禁水12 h,采用70 mg/kg bw STZ连续3 d进行腹腔注射,造模期间投喂高脂高糖饲料,持续1周[12-13]。1周后测定小鼠体重与血糖水平,空腹血糖水平≥7.0 mmol/L,餐后2 h血糖水平≥11.0 mmol/L为造模成功[14-15]。TG1、TG2、TG3组小鼠从第5周开始分别灌胃浓度为108CFU/mL的L.plantarumSCS2菌悬液、发酵液上清液和细胞内容物。NG和MG组小鼠从实验开始灌胃灭菌生理盐水,直至第9周实验结束。其中,灭菌生理盐水、菌悬液、发酵液上清液和细胞内容物灌胃量均为10 mL/kg bw[4]。
1.2.3 血糖水平测定 第3周开始至结束期间每周测定一次空腹与餐后2 h血糖。测定血糖之前小鼠禁食不禁水12 h,采取尾部血液测定其空腹血糖值;投喂食物之后2 h采取小鼠尾部血液,用血糖仪测定其餐后2 h血糖值。
1.2.4 葡萄糖耐受能力测定 小鼠造模成功后第7 d和实验结束前(第9周),对各组每只小鼠进行口服葡萄糖耐受量测定。测定前小鼠禁食不禁水12 h,以2 g/kg bw葡萄糖溶液对实验小鼠进行腹腔注射,测定其0、15、30、60、90、120 min时的血糖水平,绘制葡萄糖耐受量变化曲线[16],计算各组小鼠2 h血糖值的曲线下面积(area under curve,AUC)。
1.2.5 血清中MDA、SOD、GSH和GHS-Px水平测定 实验结束后,采用摘眼球取血法采集实验小鼠血样,离心10 min(3000×g,4 ℃),取血清,采用ELISA试剂盒和酶标仪检测实验小鼠血清中MDA、SOD、GSH和GHS-Px水平。
1.3 数据处理
数据均采用SPSS 22.0统计软件(IBM SPSS公司)进行单因素方差分析(Tukey法),p<0.05表示具有统计学意义。实验结果以平均值±标准差形式表示。
2 结果与分析
2.1 L. plantarum SCS2不同受试物对实验小鼠体重的影响
由图1可以看出,除NG小鼠外,MG、TG1、TG2和TG3小鼠在造模成功后(第4周~第5周)体重均呈现下降趋势。但TG1和TG3小鼠体重在第6周后有所上升,其中TG1小鼠体重上升不显著(p>0.05),而TG3小鼠体重上升趋势显著(p<0.05)。在第9周时TG3小鼠体重已达到(37.2±2.0) g,但MG和TG2小鼠体重则显著(p<0.05)下降。该结果表明L.plantarumSCS2细胞内容物能够显著缓解高血糖模型小鼠体重减轻的病症。

图1 实验小鼠体重变化Fig.1 Change of body weight in mice
2.2 L. plantarum SCS2不同受试物对实验小鼠血糖水平的影响
从图2可以看出,除NG组小鼠外,MG、TG1、TG2和TG3小鼠的空腹血糖水平在造模成功后(第4周)均迅速上升,经过了2周的不同受试物灌胃后,从第6周开始TG1和TG3小鼠空腹血糖值均有所下降,其中TG1小鼠空腹血糖值下降不显著(p>0.05),TG3小鼠空腹血糖值下降显著(p<0.05),当实验结束时,TG3小鼠空腹血糖值为(9.2±1.4) mmol/L,而MG和TG2小鼠空腹血糖值则显著上升(p<0.05)。该结果表明L.plantarumSCS2细胞内容物能够有效降低高血糖模型小鼠的空腹血糖。

图2 实验小鼠空腹血糖水平变化Fig.2 Change of fasting blood glucose in mice
从图3可以看出,除NG小鼠外,造模成功后,MG、TG1、TG2和TG3小鼠的餐后2 h血糖值均快速上升。经过2周灌胃后,从第6周开始,TG3小鼠餐后2 h血糖值显著下降(p<0.05),实验结束时为(11.6±1.1) mmol/L,而TG1和TG2小鼠餐后2 h血糖值无显著下降(p>0.05)。该结果表明L.plantarumSCS2细胞内容物对高血糖模型小鼠在餐后2 h血糖升高的症状有改善作用。

图3 实验小鼠餐后2 h血糖水平变化Fig.3 Change of 2 h postprandial blood glucose in mice
2.3 L. plantarum SCS2不同受试物对实验小鼠口服葡萄糖耐受能力的影响
从图4A可以看出,经过120 min后,除NG小鼠外,其作各组小鼠血糖水平仍未恢复到正常水平。从图4B也可以看出,MG、TG1、TG2和TG3小鼠的2 h血糖AUC值显著高于NG小鼠(p<0.05),且上述四组小鼠的2 h血糖AUC值无显著差异(p>0.05),说明MG、TG1、TG2和TG3小鼠的葡萄糖耐受能力降低。而从图5A可以看出,经过第5周的灌胃实验后,各组小鼠口服葡萄糖15 min后,其血糖水平均处于最高值,但随着时间的延长,TG1和TG3小鼠血糖水平开始下降,特别是TG3小鼠血糖水平下降趋势显著(p<0.05),当120 min时其血糖值为(8.7±1.3) mmol/L。同样,从图5B中可以看出,与MG小鼠相比,TG3小鼠的2 h血糖AUC值有显著降低趋势(p<0.05)。该结果表明L.plantarumSCS2细胞内容物能够改善高血糖模型小鼠的葡萄糖耐受能力。
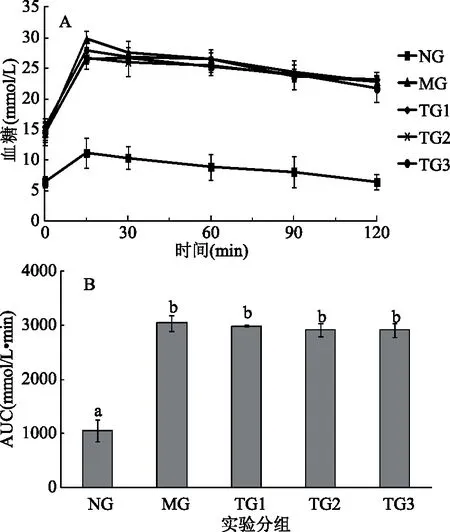
图4 造模成功后第7 d实验小鼠的口服葡萄糖耐受能力及2 h血糖值AUCFig.4 Oral glucose tolerance of mice on the seventh day after modeling and AUC of blood glucose in 2 h注:A为造模成功后第7 d不同受试物对实验小鼠口服葡萄糖耐受能力的影响,B为造模成功后第7 d不同实验组小鼠2 h血糖值的AUC;B中不同字母表示各数据间有显著差异(p<0.05)。

图5 实验第9周实验小鼠口服葡萄糖耐受能力及2 h血糖值AUCFig.5 Oral glucose tolerance of mice at the ninth week and AUC of blood glucose in 2 h注:A为实验第9周不同受试物对实验小鼠口服葡萄糖耐受能力的影响,B为实验第9周不同实验组小鼠2 h血糖值的AUC;B中不同字母表示各数据间有显著差异(p<0.05)。
从上述结果可以看出,经过第5周的灌胃实验,不同灌胃组实验小鼠之间在体重、血糖水平和葡萄糖耐受能力等方面均表现出显著差异。与MG小鼠相比,TG3小鼠的体重、空腹和餐后2 h血糖水平以及葡萄糖耐受能力均有显著改善(p<0.05),该结果与前期研究结果基本相符[9],这可能是由于L.plantarumSCS2自身能够产生一些具有特定生物活性的物质,如SOD、GPX、过氧化氢酶、金属硫蛋白等,有利于其为宿主提供必需氨基酸、维生素,矿物元素等营养物质,从而控制体内葡萄糖代谢过程中相关产物的分解与合成,使得机体的血糖平衡得以维持[3];TG1小鼠的体重、空腹血糖水平以及葡萄糖耐受能力虽有所改善,但与MG小鼠相比变化不显著,分析原因可能是由于L.plantarumSCS2菌体经过实验小鼠胃肠道的复杂环境后定植在肠道黏膜上的数量较少,不能够较好地通过维持肠道微生态平衡的方式,调节实验小鼠的免疫系统,改善其机体的免疫潜能从而起到调节血糖的作用[1,3];而TG2小鼠各项指标均无显著改善,可能是由于L.plantarumSCS2发酵液上清液中所含物质不具备调节血糖的能力或是L.plantarumSCS2代谢产物含量不足所致。
2.4 L. plantarum SCS2不同受试物对实验小鼠血清中MDA、SOD、GSH和GSH-Px含量的影响
从图6可以看出,MG小鼠血清中MDA水平最高,这可能与MG小鼠血糖水平长时间处于较高值有关。与MG小鼠相比,TG1、TG2和TG3小鼠血清中MDA水平均有所降低。该结果表明,L.plantarumSCS2细胞内容物能够降低实验小鼠血清中MDA水平,且该结果与TG3小鼠血糖水平的降低存在一定联系。

图6 实验小鼠血清中MDA水平变化Fig.6 Change of MDA levels in serum of mice注:不同字母表示各数据间有显著差异(p<0.05)。
从图7可以看出,与NG小鼠相比,MG小鼠血清中SOD、GSH和GSH-Px水平均显著降低(p<0.05)。而与MG小鼠相比,TG3小鼠血清中SOD、GSH和GSH-Px水平均显著增加(p<0.05),而TG1和TG2小鼠血清中SOD、GSH和GSH-Px水平无显著变化(p>0.05)。说明L.plantarumSCS2细胞内容物可能够通过降低实验小鼠血清中MDA水平,提高SOD、GSH和GSH-Px水平的方式改善其机体的氧化应激,从而达到降低自身血糖水平的目的。

图7 实验小鼠血清中SOD,GSH和GSH-Px水平变化 Fig.7 Change of SOD,GSH and GSH-Px levels in mice注:同一抗氧化酶指标中不同字母表示各组间有显著差异(p<0.05); GSH和GSH-Px抗氧化酶水平单位为×103 pg/mL。
3 讨论
目前,关于乳酸菌抗氧化和调节机体氧化应激的机制主要有以下三种假说:
乳酸菌自身具有调节氧化应激的抗氧化酶或其形成的代谢产物具有调节氧化应激的功能;乳酸菌或其代谢产物通过调节细胞信号转导的方式调控氧化还原平衡调节因子的表达水平从而发挥对氧化应激的调节作用;乳酸菌通过对肠道菌群的调节作用而发挥对氧化应激的调节作用[1]。本文的研究结果表明,灌胃L.plantarumSCS2细胞内容物组小鼠血清中SOD、GSH和GSH-Px等抗氧化酶水平均升高,同时MDA水平降低,而SOD、GSH和GSH-Px恰好是机体Kelch样环氧氯丙烷相关蛋白-1-核转录因子E2相关因子2-抗氧化反应元件(Keap1-Nrf2/ARE)信号通路调控的氧化应激应答系统中几种重要的抗氧化酶[17-18],这一结果初步证实了第二种假说,这可能是由于L.plantarumSCS2产生的一些抗氧化剂类的物质如SOD、GSH-Px、GSH、阿魏酸等,具有调节氧化应激的作用[1]。但在L.plantarumSCS2细胞内容物中具体起到调节作用的关键因子及其作用机制还需要进一步研究。
4 结论
L.plantarumSCS2细胞内容物能够降低高血糖模型小鼠的空腹和餐后2 h血糖水平,提高其对于葡萄糖的耐受能力;同时,也能够显著提高其血清中SOD、GSH和GSH-Px水平(p<0.05),降低血清中MDA水平的趋势。这表明L.plantarumSCS2细胞内容物中可能含有能够改善机体氧化应激的关键因子,其可能通过调节Nrf2介导的Keap1-Nrf2/ARE信号通路诱导SOD、GSH和GSH-Px等抗氧化酶表达水平上升,从而调节机体氧化应激水平,且该变化可能与实验小鼠高血糖水平及其引起的相关症状的改善有一定联系,其确切的机制还待进一步研究明确。
[1]陈卫,田丰伟,赵鑫,等. 乳酸菌干预氧化应激的研究进展[J]. 中国食品学报,2012,12(11):1-7.
[2]Lahtinen S,Ouwehand AC,Salminen S,et al. Lactic acid bacteria:microbiological and functional aspects[M]. New York:CRC Press,2011.
[3]范文娅,吴正钧,郭本恒. 乳酸菌的降血糖作用研究进展[J]. 天然产物研究与开发,2012,24(9):1323-1329.
[4]李川. 植物乳杆菌NCU116的益生功能及其作用机制[D].南昌:南昌大学,2015.
[5]Ejtahed HS,Mohtadi-Nia J,Homayouni-Rad A,et al. Probiotic yogurt improves antioxidant status in type 2 diabetic patients[J]. Nutrition,2012,28(5):539-543.
[6]Zhang Yong,Du Ruiting,Wang Lifeng,et al. The antioxidative effects of probioticLactobacilluscaseiZhang on the hyperlipidemic rats[J].European Food research and Technology,2010,231(1):151-158.
[7]顾品品,邢家溧,王刚,等. 几种体外评价乳酸菌无细胞提取物抗氧化活性方法的比较研究[J]. 食品工业科技,2015,36(23):84-88.
[8]Fu Jingqi,Hou Yongyong,Xue Peng,et al. Nrf2 in Type 2 diabetes and diabetic complications:Yin and Yang[J]. Current Opinion in Toxicology,2016,1:9-19.
[9]Xiao Meng,Yu Qian,Lishi Jiang,et al. Effects ofLactobacillusplantarumSCS2 on blood glucose level in hyperglycemia mice model[J]. Applied Biological Chemistry,2016,59(1):143-150.
[10]El-Nezami H S,Polychronaki N,Salminen S,et al. Binding rather than metabolism may explain the interaction of two food-gradeLactobacillusstrains with zearalenone and its derivativeα-zearalenol[J]. Applied and Environmental Microbiology,2002,68(7):3545-3549.
[11]Niderkorn V,Boudra H,Morgavi D P. Binding ofFusariummycotoxins by fermentative bacteriainvitro[J]. Journal of Applied Microbiology,2006,101(4):849-856.
[12]Srinivasan K,Ramarao P. Animal models in type 2 diabetes research:an overview[J].The Indian Journal of Medical Research,2007,125(3):451-472.
[13]杨巍,罗春元,于春雷,等.不同剂量STZ诱导小鼠糖尿病模型的发病机制[J].吉林大学学报:医学版,2006,32(3):432-435.
[14]向雪松.2型糖尿病大鼠模型的建立及其在辅助降血糖功能评价中的应用[D].北京:中国疾病预防控制中心,2010.
[15]罗成,鲁晓翔,周达.鸡油菌多糖降血糖作用研究[J].食品工业科技,2010,31(12):333-334,337.
[16]Quine SD,Raghu PS. Effect of(-)-epicatechin,a flavonid on lipid peroxidation and antioxidants in streptozocin-induced diabetic liver,kidney and heart[J].Pharmacological Reports,2005,57(5):610-615.
[17]Uruno A,Yagishita Y,Yamamoto M. The Keap1-Nrf2 system and diabetes mellitus[J].Archives of Biochemistry and Biophysics,2015,566:76-84.
[18]王宁,马慧萍,漆欣筑,等. Nrf2-ARE信号通路在机体氧化应激损伤防护中的研究进展[J]. 解放军医药杂志,2015(12):21-27.
