Fe3O4纳米颗粒的制备及成像分析
2018-04-27邓寒霜李筱玲高明明
邓寒霜,李筱玲,高明明
(1.商洛学院 生物医药与食品工程学院,陕西 商洛 726000;2.西安凯立新材料股份有限公司,陕西 西安 710201)
磁性纳米材料在磁流体、 磁性荧光纳米颗粒成像、磁热疗、磁靶向药物载体、细胞标记、蛋白质纯化等领域应用广泛[1]。目前,对以铁磁性纳米材料(如Fe3O4,γ-Fe2O3)为代表的磁性纳米材料的研究已经取得了较大进展。Fe3O4纳米颗粒具有独特的表面效应和量子尺寸效应,在热、电、光、磁等方面应用广泛[2]。Fe3O4纳米颗粒在交变磁场下能够产热,可通过磁热疗的方式将肿瘤细胞杀死[3];Fe3O4纳米颗粒在人体内血液循环时间较长,能够与药物分子以共价键或静电吸附的形式相结合,可作为理想的药物载体[4];Fe3O4纳米颗粒能够快速、高效进行细胞分离[5]和蛋白质纯化等[6];Fe3O4磁性纳米颗粒具有较高的空间分辨率,可在核磁共振成像中用于T1(正增强显影)和T2(负增强显影)造影剂[7-8]。
活体磁共振(MR)成像技术由于具有分辨率高的特点已在临床得到广泛应用[9]。目前,临床MR成像中使用的造影剂主要分为顺磁性、铁磁性和超顺磁性[10-12]。Fe3O4纳米颗粒的尺寸范围从几个纳米到几十个纳米,受到表面效应的影响极易发生团聚现象,采用适当的方法得到在水相中稳定、弛豫性能高、毒性小、均匀分散的纳米颗粒是研究者需要解决的难题。
本工作选用高温溶剂热分解法制备油相Fe3O4纳米颗粒[13]。通过控制Fe3O4纳米颗粒的粒径大小、形貌、表面功能化修饰,提高纳米颗粒的弛豫性能、稳定性及生物相容性,并赋予Fe3O4纳米颗粒荧光特性,为Fe3O4纳米颗粒在MR成像中的应用提供理论依据。
1 实验部分
1.1 主要试剂
油酸(AR)、无水乙醇(AR)、1,2-十六烷二醇(纯度97%(w))、苯基醚(纯度大于99%(w)):阿拉丁试剂公司;油酸铁、氯仿、二甲基亚砜(DMSO):AR,天津市致远化学试剂有限公司;聚乙烯亚胺(PEI):纯度99%(w),广东翁江化学试剂有限公司;异硫氰酸酯(FITC):纯度大于95%(w),上海金穗生物科技有限公司。
1.2 纳米颗粒的制备
4 nm油相Fe3O4纳米颗粒的制备:将一定量油酸铁和1,2-十六烷二醇加入到油酸、苯基醚、油胺的混合溶剂中。充N2、磁力搅拌条件下,将混合体系升温至120 ℃,陈化排除体系水后,在冷凝回流条件下升温至250 ℃并恒温反应一段时间,反应结束后冷却产物至室温。向混合物中加入无水乙醇,离心洗涤,收集黑色沉淀产物,正己烷重新分散后加入无水乙醇,重复离心洗涤三次,干燥得黑色油相Fe3O4纳米颗粒。
Fe3O4-PEI纳米颗粒的制备:取干燥黑色油相Fe3O4纳米颗粒及PEI溶解于一定量氯仿中,超声一定时间后置于圆周型恒温摇床上40 ℃下反应。反应完后在30 ℃下干燥使溶剂完全挥发。将干燥后的Fe3O4纳米颗粒加入去离子水中超声,离心得水相Fe3O4-PEI纳米颗粒。
磁性荧光Fe3O4-PEI-FITC纳米颗粒的制备:取一定量水相Fe3O4-PEI纳米颗粒溶于去离子水中,用0.5 mol/L的氢氧化钠溶液调pH至9.0。用DMSO溶解FITC,并加入到水相Fe3O4-PEI纳米颗粒水溶液中,混合均匀,置于摇床上(300 r/min)振荡反应。待反应结束后,离心洗涤,弃上层清液,加入无水乙醇重新溶解后再重复离心洗涤,直至上层清液在490 nm处无紫外吸收峰。
1.3 表征方法
采用美国FEI公司Tecnai G2F20S-TWIN型透射电子显微镜观察纳米颗粒形貌,加速电压200 kV;采用日本Rigaku公司D/max 2200PC型X射线衍射分析仪对纳米颗粒晶体类型进行分析,Cu Kα射线,扫描范围10°~80°;采用德国Bruker光谱仪器公司Tensor 27型红外光谱仪测定吸收峰,溴化钾压片,扫描范围500~4 000 cm-1,分辨率2 cm-1;室温下将磁性纳米颗粒置于思普特公司SPT-VSM-130型振动磁强计上测定试样的磁滞回线,最大磁场强度6×103A/m;采用德国耐驰公司STA409C型热分析仪作热重分析,载气N2,升温速率10 ℃/min,最高温度800 ℃;采用英国马尔文公司Mastersizer 3000型马尔文动态光散射激光粒度仪测定不同pH下试样的Zeta电位,纳米颗粒溶液pH用NaOH和HCl溶液调节,pH范围为2~13。
2 结果与讨论
2.1 油相Fe3O4纳米颗粒表征结果
2.1.1 形貌及结构表征结果
图1为4 nm油相Fe3O4纳米颗粒TEM照片及粒径分布。由图1可知,油相Fe3O4纳米颗粒呈球形,具有单分散性。图2为4 nm油相Fe3O4纳米颗粒XRD谱图。由图2可知,制备的Fe3O4纳米颗粒具有立方尖晶石结构。
2.1.2 VSM表征结果
图3为油相Fe3O4纳米颗粒的磁滞回线。由图3可知,纳米颗粒在300 kHz时没有剩余磁场和矫顽力,说明纳米颗粒具有超顺磁特性。饱和磁化强度为53×103A/(m·g),明显低于油相Fe3O4体相的饱和磁化强度,可能是油相Fe3O4纳米颗粒表面覆盖了一层油酸的缘故[14]。

图1 4 nm油相Fe3O4纳米颗粒TEM照片及粒径分布Fig.1 TEM photograph and size distribution of 4 nm Fe3O4 nanoparticles in oil phase.

图2 4 nm油相Fe3O4纳米颗粒的XRD谱图Fig.2 XRD spectrum of 4 nm Fe3O4 nanoparticles in oil phase.

图3 4 nm油相Fe3O4纳米颗粒的磁滞回线Fig.3 Hysteresis curve of 4 nm Fe3O4 nanoparticles in oil phase.
2.1.3 FTIR表征结果
图4为油相Fe3O4纳米颗粒FTIR谱图。由图4可知,在2 929 cm-1和2 856 cm-1处为亚甲基—CH2—的不对称和对称振动吸收峰;在1 426 cm-1处为C==O键的对称伸缩振动峰,表明油酸分子中的羧基在Fe3O4纳米颗粒表面与Fe原子结合形成了共价键。
2.1.4 TG表征结果
图5为4 nm油相Fe3O4纳米颗粒的TG曲线。由图5可知,曲线出现两个失重阶段,第一个阶段在100~300 ℃,主要是Fe3O4纳米颗粒孔隙吸附水和结构水的脱除;第二个阶段在300~600 ℃,在此阶段纳米颗粒失重率有明显下降,这是由于纳米颗粒表面的油酸逐渐脱除,加热到600 ℃时,失重率达到38%。温度高于600 ℃时,质量维持恒定,说明表面油酸脱除完全。

图4 4 nm油相Fe3O4纳米颗粒的FTIR谱图Fig.4 FTIR spectrum of 4 nm Fe3O4 nanoparticles in oil phase.
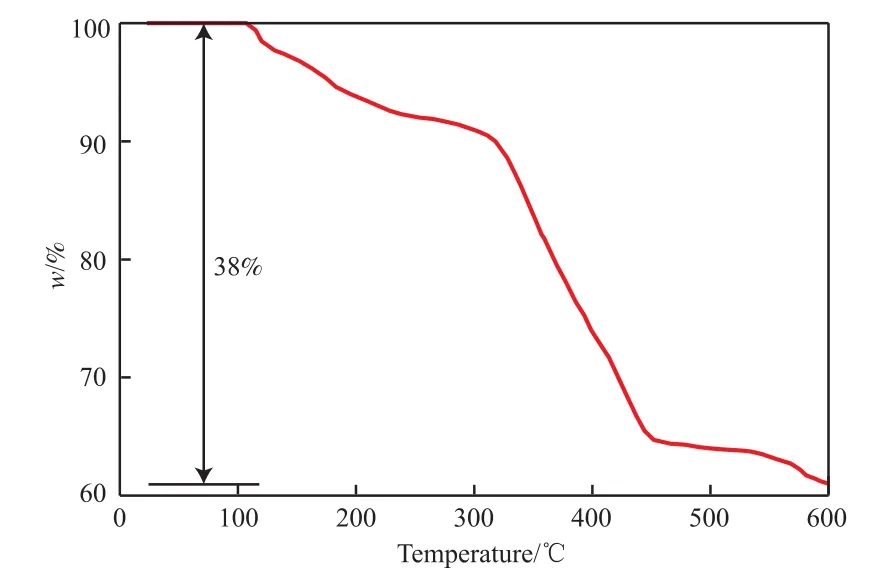
图5 4 nm油相Fe3O4纳米颗粒的TG曲线Fig.5 TG curve of 4 nm Fe3O4 nanoparticles in oil phase.
2.2 表面修饰Fe3O4纳米颗粒的表征结果
2.2.1 粒径分布
图6为4 nm油相Fe3O4纳米颗粒经表面修饰后的粒径分布。由图6可知,经PEI包覆油相纳米颗粒后对应的水合直径为10.9 nm,Fe3O4-PEI纳米颗粒经FITC修饰后水合直径变为18.8 nm,粒径随着水相纳米颗粒尺寸增大而增大,且尺寸分布较窄,说明经一系列表面修饰后纳米颗粒没有出现团聚现象,在水相中均匀分散。

图6 纳米颗粒经表面修饰后的粒径分布Fig.6 Size distribution of surface modified nanoparticles.PEI:polyethyleneimine;FITC:fluorescein isothiocyanate.
2.2.2 Zeta电位
由于静电斥力作用,Fe3O4纳米颗粒在水溶液中Zeta电位(绝对值)越大,溶液越趋于稳定状态,纳米颗粒在溶液中分散越均匀。PEI分子中含有大量的氨基,经PEI包覆油相纳米颗粒后,溶液中形成NH3+,使得纳米颗粒表面带正电荷,水相纳米颗粒对应的等电点为10.3。图7为4 nm油相Fe3O4纳米颗粒经表面修饰后的Zeta电位。

图7 纳米颗粒经表面修饰后的Zeta电位Fig.7 Zeta-potentials of surface modified nanoparticles.
由图7可知,在pH=7时,PEI对应的Zeta电位为24.6 mV,表明Fe3O4-PEI纳米颗粒水溶液在中性条件下较稳定。FITC修饰水相Fe3O4-PEI纳米颗粒,对应的等电点为8.9,等电点相对降低,说明PEI分子表面氨基与FITC反应,纳米颗粒表面所带正电荷减少。在pH=7时,对应的Zeta电位为15.7 mV,表明经FITC修饰后的水相Fe3O4-PEI纳米颗粒在中性条件下也较稳定。
2.2.3 FTIR表征结果
图8为Fe3O4-PEI和Fe3O4-PEI-FITC纳米颗粒的FTIR谱图。由图8可知,Fe3O4-PEI谱线在1 638 cm-1处的特征吸收峰归属于C—N键的伸缩振动,在3 385 cm-1处的特征吸收峰归属于N—H键的伸缩振动,在1 157 cm-1和1 108 cm-1处的特征吸收峰分别归属于 NH2和NH的不对称振动吸收,说明存在伯氨基,即PEI分子成功包覆在Fe3O4纳米颗粒表面;Fe3O4-PEI-FITC曲线在1 630 cm-1处出现了酰胺键的特征吸收峰,说明PEI分子上的伯氨基和FITC发生反应,FITC荧光分子成功接枝于纳米颗粒表面。

图8 纳米颗粒经表面修饰后的FTIR谱图Fig.8 FTIR spectra of surface modified nanoparticles.
2.2.4 Fe3O4-PEI-FITC 纳米颗粒荧光稳定性分析
图9为Fe3O4-PEI-FITC纳米颗粒水溶液的荧光强度。

图9 Fe3O4-PEI-FITC纳米颗粒的荧光稳定性Fig.9 Fluorescent stability of Fe3O4-PEI-FITC nanoparticles.The hydrodynamic diameter of the nanoparticles is 18.8 nm.
由图9可知,经表面荧光修饰后的Fe3O4-PEI-FITC纳米颗粒没有明显的荧光猝灭现象发生,稳定性较好。表明Fe3O4纳米颗粒经PEI包覆后,阻止了荧光分子与Fe3O4纳米颗粒内核相结合,极大程度降低了Fe3O4纳米颗粒内核带来的荧光猝灭现象发生。
2.2.5 Fe3O4-PEI-FITC纳米颗粒VSM表征结果
图10为Fe3O4-PEI-FITC纳米颗粒的磁滞回线。由图10可知,Fe3O4-PEI-FITC纳米颗粒的饱和磁化强度为42×103A/(m·g),小于油相纳米颗粒的饱和磁化强度53×103A/(m·g)。但纳米颗粒在300 kHz时没有剩磁和矫顽力,纳米颗粒仍具有超顺磁特性。

图10 Fe3O4-PEI-FITC纳米颗粒的磁滞回线Fig.10 Hysteresis curve of Fe3O4-PEI-FITC nanoparticles.The hydrodynamic diameter of the nanoparticles is 18.8 nm.
2.3 磁性荧光Fe3O4-PEI-FITC纳米颗粒MR成像研究
2.3.1 细胞毒性分析
采用四唑盐比色法来探究经PEI和FITC修饰后Fe3O4纳米颗粒的细胞相容性。对于Fe3O4纳米颗粒,随着Fe离子含量的升高,细胞存活率逐渐降低,但经修饰后的Fe3O4-PEI-FITC纳米颗粒的细胞存活率仍在83%以上,即使当Fe离子含量达180 μg/mL,细胞增值仍受较小影响。表明经PEI和FITC修饰后的Fe3O4纳米颗粒细胞相容性较好。
2.3.2 弛豫率及MR成像分析
Fe3O4-PEI-FITC纳米颗粒的内核尺寸大小影响纵向弛豫时间(t1)及横向弛豫时间(t2),从而使MR信号强弱受到影响。纵向弛豫率(r1)及横向弛豫率(r2)可分别通过不同Fe含量的Fe3O4纳米颗粒的t1,t2的倒数拟合得到[15],r1和r2的大小直接反应出纳米颗粒作为T1和T2造影剂的潜力。
图11为Fe3O4-PEI-FITC纳米颗粒Fe含量与1/t1、1/t2的线性关系。由图11可知,Fe3O4-PEIFITC纳米颗粒的1/t1,1/t2与Fe含量均呈现出良好的线性关系。通过计算可得水动力学直径为18.8 nm的Fe3O4纳米颗粒的r1= 7.96 m/ms,r2= 25.83 m/ms。结合Fe3O4-PEI-FITC纳米颗粒对应的T1,T2加权MR成像图分析,Fe3O4-PEI-FITC纳米颗粒(内核尺寸为4 nm)的T1加权MR成像图有较为明显的逐渐变亮趋势,MR成像信号增强,但T2加权MR成像图变暗趋势不明显。因此,表面修饰后的水动力学直径为18.8 nm的Fe3O4-PEI-FITC纳米颗粒更适合作为T1造影剂。
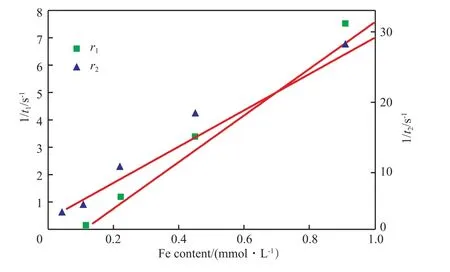
图11 Fe3O4-PEI-FITC纳米颗粒Fe含量与1/t1、1/t2的线性关系Fig.11 Linear relationship of the Fe3O4-PEI-FITC nanoparticles Fe content to 1/t1 and 1/t2 .t1:longitudinal relaxation time;t2:transverse relaxation time;r1:longitudinal relaxation rate;r2:transverse relaxation rate.The hydrodynamic diameter of the nanoparticles is 18.8 nm.
3 结论
1)制备的4 nm油相Fe3O4纳米颗粒表面成功包覆了油酸分子,纳米颗粒单分散性较好,颗粒大小均匀且呈球形,具有立方尖晶石结构。在室温下无剩磁和矫顽力且具有超顺磁特性。
2)经PEI及FITC功能化修饰后的Fe3O4纳米颗粒,水动力学直径增大,颗粒尺寸分布较窄;在中性条件下,可在水相中均匀、稳定存在,饱和磁化强度降低,但仍具有超顺磁特性,荧光稳定性较好,没有明显的荧光猝灭现象。
3)磁性荧光Fe3O4-PEI-FITC纳米颗粒具有良好的细胞相容性;拟合计算可得纳米颗粒的r1=7.96 m/ms,r2= 25.83 m/ms;结合MR加权成像图分析,该纳米颗粒适合应用于T1造影剂。
[1] Krishnan K M. Biomedical nanomagnetics:A spin through possibilities in imaging,diagnostics,and therapy[J].IEEE Trans Magn,2010,46(7):2523-2558.
[2] 张立德,牟季美. 纳米材料和纳米结构[M].北京:科学出版社,2001:303-310.
[3] Mornet S,Vasseur S,Grasset F,et al. Magnetic nanoparticle design for medical diagnosis and therapy[J].J Mater Chem,2004,14(14):2161-2175.
[4] Chen Y,Chen H,Zeng D,et al. Core/shell structured hollow mesoporous nano capsules:A potential platform for simultaneous cell imaging and anticancer drug delivery[J].ACS Nano,2010,4(10):6001-6013.
[5] Motoki K,Haruko T,Tsuyoshi T A,et al. Magnetic cell separation using antibody binding with protein a expressed on bacterial magnetic particles[J].Anal Chem,2004,76(21):6207-6213.
[6] Franzreb M,Siemann-Herzberg M,Hobley T J,et al. Protein purification using magnetic adsorbent particles[J].Appl Microbiol Biotechnol,2006,70(5):505-516.
[7] Laurent S,Forge D,Port M,et al. Magnetic iron oxide nanoparticles:Synthesis,stabilization,vectorization,physicochemical characterizations,and biological applications[J].Chem Rev,2008,108(6):2064-2068.
[8] Hong J,Xu D,Yu J,et al. Facile synthesis of polymerenveloped ultrasmall superparamagnetic iron oxide for magnetic resonance imaging[J].Nanotechnology,2007,18(13):135-14 2.
[9] Jun Y W,Jang J T,Cheon J. Magnetic nanoparticle assisted molecular MR imaging[J].Adv Exp Med Biology,2007,620:85-106.
[10] 徐星星,朱宏. 磁性纳米颗粒及其在生物医学领域中的应用[J].磁性材料及器件,2010,41(5):7-11.
[11] Lind K,Kresse M,Debus N P,et al. A novel formulation for superparamagnetic iron oxide(SPIO) particles enhancing MR lymphography:Comparison of physicochemical properties and the in vivo behavior[J].J Drug Target,2002,10(3):221-230.
[12] 肖研,吴亦洁,张文军,等. 磁共振成像造影剂的研究进展[J].分析化学,2011,39(5):757-764.
[13] Sun S,Zeng H. Size-controlled synthesis of magnetite nanoparticles[J].J Am Chem Soc,2002,124(28):8204-8205.
[14] 邹鹏. 多功能Fe3O4/ZnO/Au纳米复合材料的制备及其性质研究[D].长春:东北师范大学.
[15] 李明丽. 磁性纳米簇在磁共振显像细胞中的应用研究以及超小粒径Fe3O4纳米颗粒的初步研制[D].上海:上海交通大学,2012.
