肝胆特异性MRI对比剂Gd-EOB-DTPA诊断小肝癌价值的Meta分析
2018-04-27冯智超廖云杰梁琪容鹏飞
冯智超,廖云杰,梁琪,容鹏飞
中南大学湘雅三医院放射科,长沙410013
肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的原发恶性肿瘤,目前在我国乃至世界范围内是第三大癌症相关死亡因素[1]。由于其临床治疗效果不理想且致死率高,早期诊断对于提高HCC患者疗效及生存率极为关键。绝大多数HCC是在乙型或丙型肝炎肝硬化的基础上发生的,并且经历从肝硬化再生结节、低/高级别不典型增生结节、带亚灶HCC的不典型增生结节到小肝癌(small HCC,sHCC)的发展演变过程[2]。国内对sHCC的定义为单个癌结节直径小于3 cm或邻近两个癌结节直径之和小于3 cm,而WHO、韩国及日本学者将直径≤2 cm的癌结节诊断为sHCC[3]。准确地检出并诊断sHCC有助于提高HCC的早期诊断率。
钆塞酸二钠或普美显(gadoxetic acid disodium,Gd-EOB-DTPA)是一种肝胆特异性MRI对比剂,能被正常肝细胞膜上有机阴离子转运多肽1B3(organic anion transport protein 1B3,OATP1B3)所摄取,有助于提高肝脏局灶性病变的检出及定性诊断能力[4-5]。肝硬化结节的多步演变过程中肝细胞的形态及其细胞膜上OATP1B3表达水平、周围血管结构等会发生变化[6],从而影响病灶的强化模式及信号特点,这是EOB-MRI鉴别不同阶段肝硬化结节及早期诊断sHCC的生物学基础。本研究旨在通过对已发表的高质量文献进行再分析和评价,为EOB-MRI诊断sHCC的临床价值提供科学的循证依据。
1 材料与方法
1.1 纳入与排除标准
1.1.1 研究类型
纳入以Gd-EOB-DTPA作为对比剂进行MRI增强扫描诊断sHCC的临床试验。
1.1.2 研究对象
超声或CT发现肝内小结节或者临床怀疑为sHCC的肝硬化患者,年龄、性别、种族和国别不限。
1.1.3 金标准
病理结果(包括穿刺活检和手术标本)或CT、MRI影像学追踪随访检查。
1.1.4 检查方法
EOB-MRI扫描,或有MRI平扫(T1WI、T2WI及同反相位序列等)或DWI序列。
1.1.5 排除标准
(1)不是基于病灶数进行数据统计的研究;(2)无法提取完整四格表资料的文献;(3)会议资料、综述、病例报道、讲座及述评类数据不完整,或者无法获取全文的文献;(4)重复的病例资料;(5)研究样本量<10例;(6)非中、英文文献。
1.1.6 结局指标
敏感度(sensitivity,Sen)、特异度(specifcity,Spe)、阳性似然比(positive likelihood ratio,+LR)、阴性似然比(negative likelihood ratio,-LR)、诊断比值比(diagnosis odds ratios,DOR)及相应的95%可信区间,以及综合受试者工作特征(summary receiver operating characteristic,SROC)曲线下面积(area under the curve,AUC)。
1.2 方法
1.2.1 检索策略
通过检索PubMed、Web of Science、Embase及中国学术期刊网(CNKI)、中国生物医学文献数据库(CBM)、万方(Wanfang Data)及维普(VIP)等中外文数据库,搜集采用肝胆特异性MRI对比剂Gd-EOB-DTPA诊断sHCC的相关诊断性试验,检索时限均为2008年1月至2017年2月。此外,通过追溯被纳入研究的参考文献来补充获取相关文献。根据研究目的制定检索策略,采用自由词和MeSH主题词相结合的方式进行文献检索,并按照不同数据库具体情况进行调整。英文检索词主要包括Gd-EOB-DTPA、Gadolinium-EOB-DTPA、gadoxetic acid disodium、primovist、small、liver cancer、hepatocellular carcinoma、hepatocarcinoma等;中文检索词主要包括Gd-EOB-DTPA、钆塞酸二钠、普美显、小肝癌等。
1.2.2 文献筛选、数据提取和偏倚风险评价
由2名研究人员独立筛选文献、数据提取和偏倚风险评价,如有分歧则通过协商解决。将所有相关文献经剔除重复后进行文献筛选,首先阅读文题及摘要,按照纳入、排除标准进行初筛,再进一步阅读全文复筛,以确定最终纳入分析的文献。提取数据主要为:纳入研究基本信息:包括作者、国家、发表年份、性别比例、研究类型;纳入患者基本信息:包括样本量、金标准实施方法、病灶总数;纳入统计分析的四格表资料:包括真阳性例数(true positive,TP)、假阳性例数(false positive,FP)、假阴性例数(false negative,FN)和真阴性例数(true negative,TN);偏倚风险评价的关键要素。按照诊断性试验质量评价表(quality assessment for studies of diagnostic accuracy studies,QUADAS-2)独立对纳入文献进行偏倚风险评价,采用Deeks散点图分析发表偏倚。
1.2.3 统计学分析
本研究采用Stata 12.0软件进行统计学分析,数据保留小数点后两位。首先采用χ2检验对纳入各研究结果进行异质性分析,根据I2定量评估异质性程度。若各研究结果间无统计学异质性,采用固定效应模型;若存在统计学异质性,在排除明显临床异质性因素的影响后,采用随机效应模型。通过计算敏感度对数与(1-特异度)对数的Spearman相关系数来评价是否存在阈值效应,P>0.05表示不存在阈值效应。合并计算总的Sen、Spe、+LR、-LR、DOR及相应的95%可信区间,并绘制SROC曲线,计算AUC。若存在异质性,在排除阈值效应引起的异质性后,采用Meta回归分析及对可能产生异质性的因素进行亚组分析,来探索其异质性来源。对亚组间敏感度、特异度的差异比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 检索结果及纳入研究特征
初检获得相关文献567篇,手工补充检索3篇,经逐层筛选(阅读题目、摘要和全文,去除重复及其它不合格文献)后,最终纳入12篇文献[7-18],纳入各研究的具体信息见表1。纳入的12项研究分别来自4个国家,共包括1127例患者、1685个肝结节。其中英文研究11篇,中文研究1篇。2篇为前瞻性,其余为回顾性研究。使用3.0 T和1.5 T磁共振的研究均各为6篇。3篇研究采用直径<3 cm作为sHCC的诊断标准,其余以直径≤2 cm为标准。
2.2 纳入研究的偏倚风险评价
纳入研究的总体偏倚风险评价结果见图1。Deeks散点图分析结果提示所纳入研究的发表偏倚较小(P=0.202)。
2.3 Meta分析结果
2.3.1 异质性检验
异质性χ2检验结果Q为31.78,P<0.01,说明纳入各项研究之间存在显著异质性。而Spearman相关系数r=0.12,P=0.71,提示不存在阈值效应所引起的异质性,也就是说本研究中非阈值效应是异质性的主要来源。
2.3.2 合并分析结果EOB-MRI对sHCC诊断价值的合并Sen、Spe、+LR、-LR、DOR及相应95%置信区间分别为0.95 (0.91,0.97)、0.90 (0.83,0.95)、9.84(5.60,17.28)、0.06 (0.03,0.10)、166.39 (73.66,375.84),SROC曲线下面积AUC为0.98 (0.96,0.99),具体结果见图2。联合诊断sHCC的验前概率和阳性、阴性似然比结果提示,当验前概率为25%即临床怀疑sHCC可能性较低时,当EOB-MRI为阴性结果时验后概率仅为1%,可充分认为排除发生sHCC的风险。

表1 纳入研究的基本特征Tab. 1 The basic characteristics of the included studies

图1 纳入研究的总体风险偏倚评价Fig. 1 Overall risk bias assessment of the included studies.
2.3.3 亚组分析合并分析结果显示EOB-MRI诊断sHCC的敏感度、特异度均存在一定程度的异质性(敏感度Q=56.67,P<0.01;特异度Q=61.67,P<0.01),拟通过Meta回归及亚组分析来探究其具体原因。以DOR为因变量,对可能对结果造成影响的客观因素(研究人群、样本量、MRI场强及发表年份)进行Meta回归分析,结果表明上述因素均非引起异质性的主要因素。亚组分析结果见表2,研究人群、MRI场强及发表年份的组间差异均无统计学意义;但以研究样本量进行分组时发现,样本量超过100例时,其诊断总特异度高于样本量不超过100例组(P<0.01),而诊断总敏感度的差异无统计学意义。
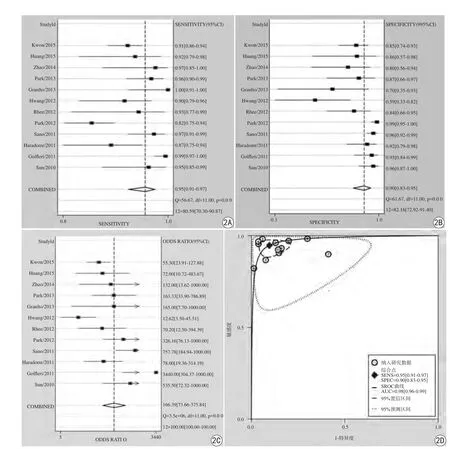
图2 EOB-MRI诊断sHCC的Meta分析结果。A:总敏感度森林图;B:总特异度森林图;C:OR森林图;D:sROC曲线Fig. 2 Meta-analysis results of EOB-MRI for the diagnosis of sHCC. A: forest plot of total sensitivity. B:forest plot of total speci ficity. C: forest plot of OR. D: sROC curve.

表2 亚组分析结果Tab. 2 Results of subgroup analysis
3 讨论
3.1 EOB-MRI诊断sHCC的重要意义及纳入研究质量评价
目前国内外指南[19-20]对HCC的影像诊断需要在动态增强扫描时存在动脉期快速强化、门脉期或延迟期快速洗脱的典型征象,但由于部分sHCC的动脉新生血管尚未完全形成、门静脉供血少,不能表现出这种典型征象而易被漏诊[21]。EOB-MRI扫描肝胆特异期时,sHCC由于不摄取对比剂而呈相对低信号,为乏血供性sHCC的诊断提供补充依据,从而提高了sHCC的检出及诊断率。尽管此前有学者荟萃分析了钆塞酸二钠增强MRI对sHCC的诊断效果[22],但其纳入文献少且标准不够严格。因此本研究结合国内sHCC的诊断标准,对肝胆特异性对比剂Gd-EOB-DTPA对慢性肝病背景下直径≤3 cm肝癌的诊断价值进行综合定量分析,以期为sHCC的临床管理决策提供科学依据。
本研究中12篇纳入文献的研究对象代表性、部分证实偏倚及诊断试验盲法评估等研究设计质量均较好。然而,由于纳入研究中sHCC的诊断标准包括穿刺活检、手术切除或移植术后病理及临床诊断等多种,缺乏明确统一的金标准,不同诊断标准的敏感度和特异度存在差异,从而引起合并偏倚可能,同时也是研究异质性的重要来源之一。此外,诊断试验的实施及病例流程和进展情况等方面报告质量略差,大部分研究对不确定情况及失访情况的描述不清楚,可能发生偏倚。因此建议在今后的研究中尽量采用诊断试验报告标准(standards for reporting of diagnostic accuracy,STARD)[23],提高诊断性试验的报告质量。
3.2 EOB-MRI诊断sHCC的价值分析
本项Meta分析研究结果显示:EOB-MRI诊断sHCC合并敏感度、特异度分别为0.95、0.90,提示漏诊率及误诊率均较低,但特异度有待进一步提高;合并DOR为166.39、SROC曲线下面积为0.98,提示Gd-EOB-DTPA对sHCC的诊断效能很高。Wu等[24]的结果显示Gd-EOB-DTPA对慢性肝病患者直径<2 cm肝癌的诊断敏感度、特异度分别为0.95、0.89,这与我们的研究结果类似;Kierans等[25]的结果表明EOB-MRI对诊断直径≤2 cm肝癌的敏感度、特异度分别为0.92、0.95,与本组结果相比,特异度有所提高但敏感度稍有下降。一方面,小部分HCC由于细胞膜上的OATP1B3发生突变[26]而在肝胆特异期可吸收Gd-EOB-DTPA呈部分或全部高信号,因此会存在一定程度的漏诊从而降低诊断敏感度;另一方面,本研究对sHCC瘤径大小的判断标准及纳入文献质量高等也会对结果有一定影响。与前述两项Meta分析相比,笔者针对性研究EOB-MRI对直径≤3 cm的sHCC的诊断价值并进行亚组分析,纳入研究及病例量也更多。
为明确文献异质性来源,笔者进行了Meta回归及亚组分析,结果表明只有样本量大小对EOBMRI诊断sHCC的特异度水平有影响。所有纳入文献中有2/3样本量不超过100例,这也是造成分析结果特异度稍低的重要因素。样本量超过100例时,由于样本量增加而误诊率降低、特异度提高,提示在今后研究中需要大样本研究来准确反映Gd-EOB-DTPA对sHCC的诊断效能。其他分组因素的组间差异均无统计学意义,说明不同分组间异质性较小,可信度较高。研究人群、MRI场强及发表年份均未影响到合并数据的敏感度和特异度,其中亚洲人群和非亚洲人群、1.5 T和3.0 T磁共振对sHCC诊断效果的影响有待进一步研究证实。
3.3 本研究的局限性
本研究尚存在着一些不足。首先,本次研究中纳入文献仅来自4个国家,尤其是对非亚洲人群的代表性不足,而且绝大多数为回顾性研究,这样容易带来研究对象的选择偏倚并提高敏感度,因此需要更多地区开展设计良好的高质量前瞻性试验以进一步提高结论的可靠程度。其次,纳入各项研究中肝结节的诊断金标准不全为病理结果,小部分研究采用病理联合临床CT、MRI随访诊断,可能会产生多重参照偏倚或合并偏倚。最后,由于纳入各项研究之间存在着异质性,笔者采用随机效应模型进行合并分析并探讨异质性来源,然而受文献资料信息的限制,只能提取4种分组因素进行Meta回归及亚组分析,全面分析异质性的来源事实上需要更多更合理的亚组数据。
总之,肝胆特异性MRI对比剂Gd-EOB-DTPA从影像学角度反映肝硬化结节不同发展阶段的分子及病理特征,能早期发现具有恶变倾向的肝硬化结节或诊断sHCC,具有较高的敏感度和特异度。本次Meta分析详实可靠,结果表明EOB-MRI对sHCC的诊断有很高的准确度,值得推荐用于临床早期诊断sHCC,可进一步开展大样本研究来提高诊断特异度。
参考文献 [References]
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015.CA Cancer J Clin, 2016, 66(2): 115-132.
[2] Zhang YY, Zhang Q, Li YF, et al. MR imaging research present situation of HBV related liver cirrhosis nodules multi-step evolution and the latest progress. Chin J Magn Reson Imaging, 2014, 5(3):232-235.张岩岩, 张琦, 李云芳, 等. HBV相关肝硬化结节多步演变MR影像特征研究现状及最新进展. 磁共振成像, 2014, 5(3): 232-235.
[3] Kojiro M. Focus on dysplastic nodules and early hepatocellular carcinoma: an eastern point of view. Liver Transpl, 2004, 10(2 Suppl 1): S3-8.
[4] The Abdominal Group in Chinese Society of Radiology. Expert consensus on the clinical application of hepatobiliary-speci fic MRI contrast agent gadoxetic acid disodium. Chin J Radiol, 2016, 50(9):641-646.中华医学会放射学分会腹部学组. 肝胆特异性MRI对比剂钆塞酸二钠临床应用专家共识. 中华放射学杂志, 2016, 50(9): 641-646.
[5] Lei JQ, Ma WT, Wang YZ, et al. Diagnostic value of Gadoxetic acid disodium (Gd-EOB-DTPA) for the detection of liver metastases: a Meta-analysis. Chin J Evid-based Med, 2015, 15(12): 1378-1386.雷军强, 马文婷, 王寅中, 等. 特异性肝胆对比剂钆塞酸二钠对肝转移瘤的诊断价值的Meta分析. 中国循证医学杂志, 2015, 15(12):1378-1386.
[6] Choi JY, Lee JM, Sirlin CB. CT and MR imaging diagnosis and staging of hepatocellular carcinoma: part I. Development, growth,and spread: key pathologic and imaging aspects. Radiology, 2014,272(3): 635-654.
[7] Sun HY, Lee JM, Shin CI, et al. Gadoxetic acid-enhanced magnetic resonance imaging for differentiating small hepatocellular carcinomas(<or=2 cm in diameter) from arterial enhancing pseudolesions:special emphasis on hepatobiliary phase imaging. Invest Radiol,2010, 45(2): 96-103.
[8] Golfieri R, Renzulli M, Lucidi V, et al. Contribution of the hepatobiliary phase of Gd-EOB-DTPA-enhanced MRI to dynamic MRI in the detection of hypovascular small (</= 2 cm) HCC in cirrhosis. Eur Radiol, 2011, 21(6): 1233-1242.
[9] Haradome H, Grazioli L, Tinti R, et al. Additional value of gadoxetic acid-DTPA-enhanced hepatobiliary phase MR imaging in the diagnosis of early-stage hepatocellular carcinoma: comparison with dynamic triple-phase multidetector CT imaging. J Magn Reson Imaging, 2011, 34(1): 69-78.
[10] Sano K, Ichikawa T, Motosugi U, et al. Imaging study of early hepatocellular carcinoma: usefulness of gadoxetic acid-enhanced MR imaging. Radiology, 2011, 261(3): 834-44.
[11] Park MJ, Kim YK, Lee MW, et al. Small hepatocellular carcinomas:improved sensitivity by combining gadoxetic acid-enhanced and diffusion-weighted MR imaging patterns. Radiology, 2012, 264(3):761-770.
[12] Rhee H, Kim MJ, Park MS, et al. Differentiation of early hepatocellular carcinoma from benign hepatocellular nodules on gadoxetic acid-enhanced MRI. Br J Radiol, 2012, 85(1018):e837-844.
[13] Hwang J, Kim SH, Lee MW, et al. Small (</=2 cm) hepatocellular carcinoma in patients with chronic liver disease: comparison of gadoxetic acid-enhanced 3.0 T MRI and multiphasic 64-multirow detector CT. Br J Radiol, 2012, 85(1015): e314-322.
[14] Granito A, Galassi M, Piscaglia F, et al. Impact of gadoxetic acid(Gd-EOB-DTPA)-enhanced magnetic resonance on the non-invasive diagnosis of small hepatocellular carcinoma: a prospective study.Aliment Pharmacol Ther, 2013, 37(3): 355-363.
[15] Park MJ, Kim YK, Lee MH, et al. Validation of diagnostic criteria using gadoxetic acid-enhanced and diffusion-weighted MR imaging for small hepatocellular carcinoma (<=2.0 cm) in patients with hepatitis-induced liver cirrhosis. Acta Radiol, 2013, 54(2):127-136.
[16] Zhao XT, Li WX, Chai WM, et al. Detection of small hepatocellular carcinoma using gadoxetic acid-enhanced MRI: Is the addition of diffusion-weighted MRI at 3.0 T bene ficial? J Dig Dis, 2014, 15(3):137-145.
[17] Huang HD, Zeng MS, Ding YQ, et al. The application of Gd-EOBDTPA-enhanced MRI in diagnosis of small hepatocellular carcinoma in patients with chronic hepatitis. J Clin Radiol, 2015, 34(7):1085-1089.黄海东, 曾蒙苏, 丁玉芹, 等. Gd-EOB-DTPA磁共振成像在慢性肝炎背景下小肝癌诊断中的应用. 临床放射学杂志, 2015, 34(07):1085-1089.
[18] Kwon HJ, Byun JH, Kim JY, et al. Differentiation of small (</=2 cm) hepatocellular carcinomas from small benign nodules in cirrhotic liver on gadoxetic acid-enhanced and diffusion-weighted magnetic resonance images. Abdom Imaging, 2015, 40(1): 64-75.
[19] Ministry of Health of the People's Republic of China. Diagnosis and treatment of primary liver cancer (2011 Version). Chin Clin Oncol,2011, 16(10): 929-946.中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版). 临床肿瘤学杂志, 2011, 16(10): 929-946.
[20] Bruix J, Sherman M, Practice Guidelines Committee, American Association for the Study of Liver Disease. Management of hepatocellular carcinoma. Hepatology, 2005, 42(5): 1208-1236.
[21] Bolondi L, Gaiani S, Celli N, et al. Characterization of small nodules in cirrhosis by assessment of vascularity: the problem of hypovascular hepatocellular carcinoma. Hepatology, 2005, 42(1):27-34.
[22] Zhong WN, Kang W, Hu XY, et al. Diagnostic accuracy and sensitivity of Gd-EOB-DTPA enhanced MR imaging in the detection of small hepatocellular carcinoma: a Meta-analysis. Chin J CT MRI,2014, 12(06): 54-57, 67.钟武宁, 康巍, 胡雪莹, 等. 钆塞酸二钠增强MRI对小肝癌诊断效果的Meta分析. 中国CT和MRI杂志, 2014, 12(06): 54-57, 67.
[23] Tackmann R, Schuetz G, Hamm B, et al. Quality of the reporting of diagnostic accuracy studies: STARD (standards for the reporting of diagnostic accuracy studies). Rofo, 2010, 182(8): 655-659.
[24] Wu LM, Xu JR, Gu HY, et al. Is liver-specific gadoxetic acidenhanced magnetic resonance imaging a reliable tool for detection of hepatocellular carcinoma in patients with chronic liver disease? Dig Dis Sci, 2013, 58(11): 3313-3325.
[25] Kierans AS, Kang SK, Rosenkrantz AB. The diagnostic performance of dynamic contrast-enhanced MR imaging for detection of small hepatocellular carcinoma measuring up to 2 cm: a Meta-analysis.Radiology, 2016, 278(1): 82-94.
[26] Kitao A, Matsui O, Yoneda N, et al. Hypervascular hepatocellular carcinoma: correlation between biologic features and signal intensity on gadoxetic acid-enhanced MR images. Radiology, 2012, 265(3):780-789.
