基于MR图像的苍白球内侧部帕金森手术靶点坐标定位
2018-04-27邓信平赵娜王珏
邓信平,赵娜,王珏
杭州师范大学认知与脑疾病研究中心,杭州 310015
帕金森氏病(Parkinson's disease,PD)是一种在老年人群中常见的中枢神经退行性疾病,其主要表现为静止性震颤、肌强直、运动迟缓和姿势步态异常等运动障碍,同时伴有大量非运动症状。帕金森病作为一种低病死率、高病残率的中枢神经系统变性疾病,其主要病理改变是黑质致密部多巴胺 (dopamine,DA)能神经元变性、死亡,形成路易小体。目前帕金森病的治疗方式主要为药物治疗与手术治疗,其中发病早期药物治疗效果较好,随着病程增加,患者产生耐药性,同时药物副作用也会逐渐积累变大,因而手术成了晚期帕金森病的主要治疗手段。早期手术治疗普遍采用损毁方式,用微电极植入深部脑区,对特定靶点实施损毁。由于损毁的不可逆性,随着技术发展,具有可逆可调性的深部脑刺激术(deep brain stimulation,DBS)逐步替代了脑损毁术,深部脑刺激手术采用埋置微电极,配合植入式刺激发生器,实现对特定靶点的持续电刺激,从而达到治疗目的。无论是损毁术还是深部脑刺激术,其手术效果与靶点位置的选择及定位准确性存在密切相关,甚至是决定性的。1987年,法国医生Benabid首次采用DBS刺激丘脑腹外侧核团治疗PD震颤症状取得良好疗效[1]。目前以丘脑底核(subthalamic nucleus,STN)及苍白球内侧部(globus pallidus internus,GPi)为靶点的脑损毁术及深部脑刺激术是手术治疗PD常用方法。有研究表明,以STN或GPi为靶点治疗帕金森氏病的DBS手术在改善患者运动症状上无显著差异,不过相比GPi,STN术后产生情绪与认知副作用的比例更高,而且产生一般性副作用的人数也更多[2]。另外,GPi靶点定位相对困难,因此笔者重点回顾性总结了近20年帕金森氏病GPi手术的发展及靶点定位,力图为后续帕金森氏病的研究提供一定的参考与指导。
1 手术发展
1.1 立体定向手术
立体定向手术是一种利用定向仪和导向器把操作器械,如电极、脑室镜、穿刺针等精确送达靶点,实现治疗或者诊断的方法。治疗PD的立体定向神经外科手术始于20世纪40年代,欧美医生将微电极埋入苍白球或丘脑等靶点实施毁损术取得了良好的疗效。一直到60年代,脑立体定向手术都是PD治疗的重要手段,随后由于左旋多巴药物治疗方法的兴起而被逐渐放弃。但是近年来毁损术,深部脑刺激等外科治疗再次成为PD治疗的主要手段,其主要原因有:(1)长期服用左旋多巴制剂后药效减退及伴随药物产生的副作用[3];(2)有研究发现PD导致行动迟缓等症状可能与苍白球细胞异常放电有关;(3)脑影像技术及微电极细胞外记录等电生理技术的发展使得靶点定位更准确,手术治疗更安全有效。
1.2 损毁术与深部脑刺激术
相比于深部脑刺激术,损毁术出现时间较早,传统损毁术利用埋置微电极确定靶点位置,随后对靶点进行逐步加热,直至损毁。20世纪40、50年代苍白球和丘脑毁损术被应用于手术治疗PD[4]。60年代左旋多巴胺药物治疗开始兴起,其治疗效果明显,并且相对于毁损术更为安全,因此逐步取代了损毁术,成为主要治疗手段。然而,由于应用左旋多巴胺治疗帕金森氏病的十年内,其局限性渐渐显现,使得手术治疗再次成为热点[3,5]。
深部脑刺激术,也称“脑起搏器”,是一种可植入设备。深部脑刺激术通过立体定向技术在深部脑区特定部位植入微电极,配合皮下植入的脉冲发生器,给予神经核团连续脉冲刺激。20世纪50年代,在采用电刺激术对脑深部结构进行电生理学定位时发现,当频率超过100赫兹时可抑制由帕金森氏病引起的震颤及缓解运动障碍。这一发现成为深部脑刺激术诞生的契机,后经不懈探索,70年代初深部脑刺激术开始应用于临床治疗PD,该时期手术靶点均选择丘脑核团,但部位差异较大,临床效果也不一致。
损毁术治疗成本低,见效快,但损毁部位不可逆,术后并发症发病率高,且治疗效果会随时间逐渐衰退。相较于损毁术的局限与缺点,深部脑刺激存在可控可调,对脑组织几乎无损伤,副作用小,治疗效果明显且疗效长等诸多优点,成为目前PD外科手术治疗的最佳选择。
1.3 Atlas-based定位方法与MR imaging-based定位方法
随着技术手段的不断发展,靶点定位的方法也在不断变化。由最初根据人脑解剖图(the atlases of Schaltenbrand and Talairach)[6]进行定位到运用磁共振成像(magnetic resonance imaging,MRI)定位扫描、粗电极刺激和微电极记录相结合的手段进行定位。新近研究表明,DBS手术可以通过运用术中CT监测技术或介入性MRI技术,结合高分辨率MRI安全,准确地进行[7]。
基于人脑解剖图,计算靶点与内部参照点距离来确定坐标,通常参照点选取为前联合(anterior commissure,AC)与后联合(posterior commisure,PC)并以AC-PC连线中点(midpoint,MP)作为坐标原点,此类方法为Atlas-based定位方法。由于人脑解剖图样本量大小的限制,采用此类间接方法定位存在较大偏差。伴随技术进步,采用高分辨率MRI已经可以准确分辨出靶点核团位置,相对于间接定位法,在高分辨率MRI上直接确定靶点坐标的方法称为MR imaging-based定位方法。2002年Vayssiere等[8]系统比较了两种定位方法,MR imaging-based与Atlas-based其根本的区别在于靶点坐标是否参照前后联合等大脑解剖标志点借助先验经验推断而来。在相关技术的支持下,MR imaging-based方法能有效降低个体解剖差异引起的靶点定位误差,并能简化手术流程,缩短手术时间。
2 靶点定位发展
苍白球位于基底神经节中豆状核的内侧部,以内髓板为分界,较大的外侧部分为苍白球外侧部,较小的内侧部分为苍白球内侧部。苍白球内有许多有髓纤维穿行,是纹状体的主要输出部分,参与运动功能的调节。有研究表明,起源于中央运动区的基底节-苍白球-丘脑皮质下环路与手术治疗PD密切相关[9]。
20世纪50年代,Talairach和Cooper等采用苍白球损毁术治疗PD取得一定疗效,随后Hassler等[10]以丘脑腹外侧核为靶点进行损毁术对PD震颤症状起到良好控制效果,丘脑腹外侧核逐步取代了苍白球成为损毁术的主要靶点。几年后人们发现,中晚期PD病人除了震颤,运动迟缓、步态及语言障碍逐渐成为主要症状。1985年,Laitinen等[11]主张以苍白球内侧部作为PD手术治疗靶点,取得了较好效果,逐步被研究者接受和采用。
1992年Laitinen等[4],采用立体定向仪结合计算机断层扫描(computed tomography,CT)技术实施苍白球损毁手术治疗38例运动功能衰退PD病人,采用Atlas-based方法确定苍白球后腹侧靶点坐标报告如下:MP中点前方2~3 mm,第三脑室旁开18~21 mm,前3例病人AC-PC连线下方3 mm,其余35例病人AC-PC连线下方6 mm。同时该研究探讨了靶点与内囊及视束的相对位置关系。因损毁靶点尤其靠近视束,如定位不准确极易造成副作用,进而影响病人视觉。其后续跟踪研究表明,尽管术中运用了电极电刺激试图精确定位损毁位置,仍然有6例病人出现视觉障碍。
1999年,Guridi等[12]比较了采用微电极记录确定的最终GPi坐标与用术前MRI影像间接获得的GPi坐标位置差异。研究分析了50例接受微电极记录引导苍白球损毁术的病人。首先通过MRI定义AC-PC线,再以此为参照间接确定手术GPi靶点的理论坐标。初始GPi坐标引自Laitinen等[4,13]的研究,相对原点MP为:旁开20~22 mm,前方2~3 mm,下方5~6 mm。该研究发现,通过MRI定义的理论靶点位置与实际损毁靶点位置存在相对差异。多数情况下,实际损毁区域相对于MRI得出的理论区域处于后方及侧面。微电极记录显示实际靶点与理论靶点位置在矢状面及冠状面坐标方向上分别存在(2.3±1.55) mm及(3±1.9) mm的偏差。理论靶点位置与实际损毁靶点位置只在45%的病人中重叠。Hiner等[14]研究表明,采用微电极记录技术引导,70%病人的最终损毁区域进行了调整。Azizi等[15]研究表明,在25%的病例中,理论靶点坐标比实际损毁区域坐标偏离达5 mm以上。另外,该文章还分析了MRI确定靶点坐标的误差来源。主要分为两个,一个为成像过程中产生的变形,无论采用何种靶点确定方式都不可避免;另一个是个体解剖变异,同时手术过程中打开硬脑膜也会造成相应变异,尤其是老年患者。
Vayssiere等[8]于2002年比较了基于脑解剖图集定位及基于MRI定位的肌张力障碍立体定向DBS手术。该研究共包括35例接受双侧GPi深部脑刺激手术的病人。通过三维MRI可视化确定GPi靶点,并用相应软件记录靶点坐标,再通过转换矩阵将其坐标换至AC-PC坐标系。同时,分别参照Schaltenbrand脑解剖图集和Talairach脑解剖图集相应脑组织结构确定上述GPi靶点坐标。随后对运用两种方法得到的同一GPi靶点坐标进行统计比较分析。研究表明[16-17],借助立体定位框架,严格制定MRI扫描程序,可有效评估术前术后MRI变形,无需要依靠术中微电极记录技术,从而缩短手术时间及降低复杂程度。对比采用基于人脑解剖图集的间接方法进行定位,由于个体间差异较大,其得出靶点坐标往往是一个范围而不是精确值。因此该文作者认为有必要比较Atlas-based和MR imaging-based之间的差异。基于Schaltenbrand脑解剖图集得出的GPi靶点坐标被Svennilson等[18]广泛地应用,其AC-PC坐标报告如下:旁开18~21 mm,MP前方2~3 mm,AC-PC连线下方4~6 mm。几年后Laitinen等[19-20]报告了相同坐标位置,从此该坐标位置成了多数神经外科医生实施苍白球手术时的参考目标。Vayssiere等[8]的研究中,通过MR imaging-based直接定位确定的70个靶点平均坐标位置如下:旁开(17.5±1.8) mm,MP前方(4.2±1.9) mm,AC-PC线下方(1±1.6)mm;通过Schaltenbrand脑解剖图集得到的靶点坐标如下:旁开20 mm,MP前方2 mm,AC-PC下方4 mm;通过Talairach脑解剖图集得到的靶点坐标如下:旁开18 mm,MP前方4 mm,AC-PC下方4 mm。同时该研究探讨了MR imaging-based直接定位靶点坐标的个体差异,发现个体间存在很高的解剖位置变异,校正后最大变异矢状面达10.5 mm,冠状面达11.5 mm,轴状面达7.3 mm;同时,对比左右两半球MRI靶点坐标并未发现显著差异,但是AC-PC连线的长度与冠状面方向的靶点坐标位置存在正相关,即AC-PC长度越长,靶点相对MP越靠前。该研究对照两种方法定位GPi的坐标后发现:对于给定的病人,由MR imaging-based直接定位的GPi靶点坐标与经由脑解剖图集间接得到的GPi靶点坐标相比差异显著(P<0.01)[8]。据此该文作者指出,运用3D高分辨率MRI可视化GPi靶点坐标进行直接定位的方法要优于采用脑解剖图集的间接定位方法。
1999年,Guridi等[12]的研究与2002年Vayssiere等[8]的研究存在一定联系。前者对比了微电极记录定位方法与根据MR图像上AC、PC的位置对靶点进行推算的间接定位方法的差异,后者对比了MRI可视化直接定位与人脑解剖图集间接定位的差异。根据Guridi等[12]研究中对靶点相对AC、PC位置进行间接定位的描述:由MRI计算AC-PC长度,根据该长度对Schaltenbrand解剖图进行调整以适合病人脑结构[21],最后参照解剖图集确定靶点坐标。对比Vayssiere等[8]的研究中对人脑解剖图集定位的描述,可认为Guridi等[12]研究中所指利用MRI定位的方法即为Vayssiere等[8]研究中所指的人脑解剖图集定位方法,同属于间接定位靶点的方法。值得注意的是,Vayssiere等[8]研究中所指MRI定位方法为通过高分辨率MRI直接定位GPi靶点,属于直接定位靶点的方法。Guridi等[12]和Vayssiere等[8]的研究均表明参照解剖图集间接定位靶点的方法存在一定误差,其精确性存疑。
2006年,Starr等[22]及其同事系统介绍了微电极引导苍白球DBS手术治疗肌张力障碍,共包括23例病人。其用于治疗肌张力障碍的DBS靶点坐标与治疗PD的靶点坐标相似[23]。关于靶点位置确定,该研究运用微电极引导技术所定GPi靶点AC-PC坐标如下:旁开20.0 mm,MP前方2.5 mm,AC-PC下方5.8 mm。Starr研究中按照术后疗效绘制了标准化后的靶点坐标示意图(图1)。由该图可以看出,不同个体间靶点坐标存在较大差异,且邻近靶点位置对于不同个体术后疗效不尽相同。另外,Bereznai等[24]研究了6例接受双侧GPi-DBS手术的肌张力障碍患者,其术后疗效良好,其平均坐标报告如下:旁开20.5 mm,MP前方2.8 mm,AC-PC下方5.3 mm。
2014年,Starr等[25-26]及其同事发展了一套能够实现术中实时结构图像监测的MRI介入导航定位系统,以弥补传统手术需要在病人清醒状态下利用生理学方法(主要为微电极记录及术中电刺激)确认靶点位置而产生的不足。因免去了生理学方法确认靶点坐标的操作,使得手术流程得以简化,时间缩短,同时适用范围也加大了。这套系统被称作ClearPoint,提高了机械控制精度,并配有一套整合软件,以便精确定位靶点坐标。作者应用ClearPoint系统实施了6例肌张力障碍手术,病人处于麻醉状态,术中未采用生理学方法确认靶点位置,10个GPi平均靶点坐标报告如下:旁开19.00 mm,MP前方3.13 mm,AC-PC下方3.52 mm。作者报告手术后疗效理想,靶点定位误差小,较传统方法有显著优势。
3 GPi靶点坐标总结
本文涉及GPi靶点坐标汇总见表1、图2。
可以看出,随着医学影像技术的进步,核团靶点坐标的确定由最初通过脑解剖图集的间接方法发展到运用高分辨率MRI或介入性MRI等技术的直接方法。综合上述文献,间接方法确定GPi靶点一般采用Laitinen等[4]所报告坐标:旁开18~21 mm,MP前方2~3 mm,AC-PC连线下方3~6 mm。2002年及以后普遍采用微电极记录等与MRI相结合的方法直接确定靶点坐标。2014年开始采用介入性MRI技术,在不运用生理学方法进行靶点确认的情况下实时监控以确保精准定位。由于采用MR imaging-based直接定位方法精度较间接定位方法高,报告多为一个平均坐标点,经总结6篇研究GPi靶点坐标范围如下:旁开17~22 mm,MP前方2~4 mm,AC-PC下方1~6 mm。

图1 Starr研究中GPi手术靶点坐标散点示意图。Starr研究中基于标准化苍白球边界前后联合平面上的手术靶点目标示意图。左半球对应图的左侧。星号表示平均靶点坐标;实心方块表示术后出现副作用或疗效不好需要重新定位的靶点坐标;虚线表示参照Schaltenbrand-Wahren人脑解剖图集确定的苍白球后边界。空心圆表示术后6个月内疗效提升至少70%的靶点坐标;空心方块表示术后6个月内疗效提升50%至70%的靶点坐标;实心圆表示术后疗效提升低于50%手术靶点。征得作者同意允许转载 图2 文献GPi靶点坐标汇总示意图。直角坐标系单位mm,原点为标准空间AC-PC连线中点,苍白球边界采用标准空间AAl模板确定,根据相对AC-PC连线中点距离描出各文献GPi靶点坐标示意图Fig. 1 Scatter plots of GPi target locations in the study of Starr. Scatter plots of GPi target locations in the study of Starr at the level of the inter commissural plane, plotted with respect to a normalized pallidocapsular border. Left hemisphere is on the left side. Asterisk denotes mean lead location, black squares, leads that required surgical repositioning due to low thresholds for stimulation-induced adverse effects and/ or poor ef ficacy, dotted lines, the latter border of GPi, drawn based on the Schaltenbrand-Wahren human brain atlas,open circles, leads associated with at least a 70% improvement in within a minimum 6-month follow-up period, open squares, leads associated with 50% to 70% improvement within a minimum 6-month followup period, small filled circles, leads associated with less than a 50% improvement. Cited with permission of the author. Fig. 2 Scatter plots of GPi target locations of six reference articles. Units of the Cartesian coordinate is millimeter, midpoint of AC-PC line as the origin of coordinates, the border of GPi was determined based on AAL template. Scatter plots of GPi targets was drew based on target distance related to midpoint of AC-PC line.
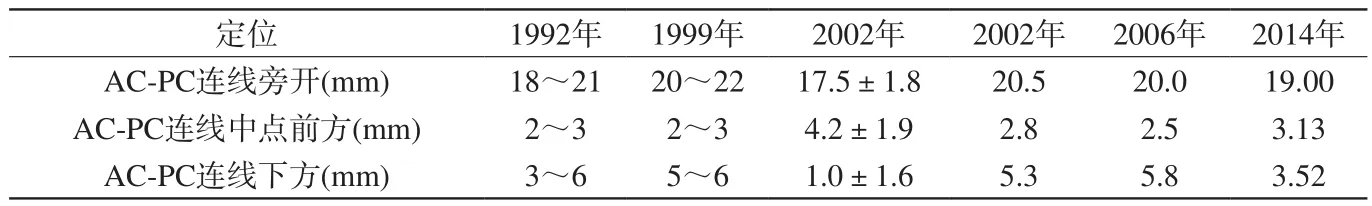
表1 GPi靶点坐标Table. 1 GPi target locations
4 GPi的MR imaging-based靶点定位
上述文章部分主要回顾了技术进步带来的GPi手术靶点精准定位的发展,下面着重介绍MR imaging-based相关技术在GPi靶点定位中的运用及发展。MR imaging-based定位方法通过高分辨率MRI图像进行定位,区别于Atlas-based定位方法,前者为直接定位,后者为间接定位[27]。
传统深部脑刺激手术实施时需要进行术中电极放置位置的神经生理学确认,藉此提高电极放置的精准性,但是术中进行神经生理学电极确认这一步骤存在诸多弊端。诸如:微电极的植入会增加颅内出血的概率[28];植入更多记录通道会因脑脊液渗漏,颅内压改变导致更为严重的颅脑变形[29-30];术中保持清醒会对病人心理造成极大压力,对于不能忍受清醒状态下手术及不适合清醒手术病人术中神经生理学确认并不适用[26];神经生理学电极确认会延长手术时间,同时也增加了手术难度。
鉴于术中神经生理学电极确认的上述弊端,直接依据MR图像,免去神经生理学电极确认步骤更为精准的MR imaging-based定位方法成为研究者探索的热点。同时,随着现代MRI技术的进步,已经能够在高分辨率MRI上直接分辨出目标靶点来[8,27,31],从而为MR imaging-based定位方法的实现打下基础。早在2007年,Patel等[32]报道了未进行术中神经生理学电极确认对处于全身麻醉状态下病人实施Leksell框架结合导航管道的DBS手术,手术电极放置准确,效果良好。Zrinzo等[33]于2012年的研究同样得到了类似结果。近期多项研究报告了非神经生理学电极确认高分辨率MRI结合术中CT的DBS手术准确性及效果。2013年,Burchiel等[34]的研究表明:无框架高分辨率MRI结合术中CT的直接定位手术靶点定位的准确性良好;Mirzadeh等[35-36]于2014年及2016年分别报告了运用无框架术前高分辨率MRI结合术中CT技术的DBS手术定位方法靶点定位与术后效果均十分理想。因此,多项研究表明,MR imaging-based定位方法是一种可行有效前景广阔的DBS手术方法。
2010年,Starr等[37]开发了一套无框架DBS手术定位系统(ClearPoint®,MRI Interventions,Inc),该系统包括配套软件,可以实施术中MRI实时(intraoperative MRI,iMRI)定位。前文提到2014年Starr等[26]运用这一套系统对不适合清醒手术的儿童肌张力障碍患者实施了DBS手术治疗,取得良好效果。2015年,Ostrem等[38]评估了临床上运用这套系统对PD病人实施DBS手术的有效性和安全性,该研究评估了26个PD病人的术后效果,指出相较于有框架DBS手术方法,运用ClearPoint介入性实时MRI定位系统能获得更精确的靶点定位及优良的术后效果。2016年,Sidiropoulos等[39]运用ClearPoint系统对12例晚期PD患者植入了STN或GPi电极,该研究发现,运用纯MRI导向方法植入DBS手术电极前景广阔,相对于传统微电极导向方法,MRI导向方法至少在有效性和安全性上不存在劣势。 同时该研究指出,ClearPoint系统相比基于CT的MRI直接定位方法一个可能的优点是该系统能够在术中实时连续扫描,从而有效校正因颅脑变形引起的电极偏移。
不同扫描序列对获得的图像质量影响十分显著,特定序列能满足特定的成像需求,对于识别GPi或STN等微小的神经核团,Nowacki等[40]于2015年研究了采用MDEFT (Modified Driven Equilibrium Fourier Transform)扫描序列对提高MR imaging-based靶点定位DBS手术准确性的影响。该研究表明,MDEFT MRI序列可以提供高分辨率及良好的对比度,通过MDEFT序列成像,能够精确可靠地定位GPi等微小核团,同时该序列还能够实现对GPi的3D分割,从而更好地分析DBS手术中电极放置的准确性。
除了不同扫描序列会对MRI成像质量产生影响,不同磁场强度也是一个重要的影响因素。2016年van Laar等[41]对比研究了不同磁场强度对DBS手术准确性的影响。该研究分别比较了1.5 T、3.0 T及7.0 T场强条件下进行DBS手术的靶点定位准确性,发现7.0 T MRI显著提高了目标靶点的可视化程度,但是对于DBS手术的临床效果提高并不显著。
基于上述文献研究,可以看出,MRI技术在DBS手术中的运用研究主要基于以下三个方面:(1)开发专门的手术系统(ClearPoint),配套专用软件及磁共振兼容设备实现手术过程中MRI的实时监控,从而提高手术准确性及术后效果。(2)研发特殊的扫描序列,增强图像质量,提高对微小神经核团的分辨度,提高手术效果。(3)探索不同磁场强度对图像质量的提高效果,能否对优化手术效果提供帮助。
从目前的研究结果来看,MR imaging-based定位方法优于传统定位方法,具有广大的运用前景及临床价值。
5 确定一般适用GPi靶点坐标的意义
由于GPi解剖位置个体间差异较大,对于要求精确定位的DBS手术而言,必须制定个体化的定位计划,避免因定位不准造成手术效果降低甚至相反效果。确定一般适用的GPi坐标对实际手术仅能提供粗略的参考,指导意义十分有限,笔者认为这也是多年来没有学者系统研究大样本GPi位置坐标的原因。笔者回顾了近20年来涉及GPi坐标以及GPi手术定位发展的研究,综合确定了一个大致GPi坐标范围,为以后DBS手术细微神经核团定位提供一定参考。虽然GPi坐标个体差异较大,但是群组水平上得出的平均坐标具有一定代表性,因此本文所总结坐标可用于群组水平上的数据分析。
志谢 衷心感谢导师臧玉峰教授在本文撰写过程中提供的指导与帮助
参考文献 [References]
[1] Benabid AL, Chabardes S, Mitrofanis J, et al. Deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease//Deep brain stimulation in neurological and psychiatric disorders.Clifton: Humana Press, 2009: 67-81.
[2] Okun MS, Fernandez HH, Wu SS, et al. Cognition and mood in Parkinson disease in STN versus GPi DBS: the COMPARE Trial. An Neurol, 2009, 65(5): 586-595.
[3] Gildenberg PL. The history of surgery for movement disorders.Neurosurg Clin North Am, 1998, 9(2): 283-294.
[4] Laitinen LV, Bergenheim AT, Hariz MI. Leksell's posteroventral pallidotomy in the treatment of Parkinson's disease. J Neurosurg,1992, 76(1): 53-61.
[5] Bucy PC, Case TJ. Tremor: physiologic mechanism and abolition by surgical means. Arch Neurol Psychiatry, 1939, 41(4): 721-746.
[6] Bosch DA, Bosch DA. Atlas for stereotaxy of the human brain//Atlas for stereotaxy of the human brain. Georg Thieme Publishers,1977: 299.
[7] Mirzadeh Z, Chapple K, Lambert M, et al. Validation of CT-MRI fusion for intraoperative assessment of stereotactic accuracy in DBS surgery. Mov Disord, 2014, 29(14): 1788-1795.
[8] Vayssiere N, Hemm S, Cif L, et al. Comparison of atlas-and magnetic resonance imaging-based stereotactic targeting of the globus pallidus internus in the performance of deep brain stimulation for treatment of dystonia. J Neurosurg, 2002, 96(4): 673-679.
[9] Dogali M, Beri A, Sterio D, et al. Anatomic and physiological considerations in pallidotomy for Parkinson's disease//Advances in Stereotactic and Functional Neurosurgery 11. NewYork: Springer Vienna, 1995: 53-60.
[10] Hassler R, Riechert T, Mundinger F. The precision in anatomical localization of stereotactic Parkinson operations checked with data from autopsies. Arch Psychiatr Nervenkr, 1969, 212(212): 97-116.
[11] Laitinen LV. Pallidotomy for Parkinson's disease. Neurosurg Clin North Am, 1995, 6(1): 105-112.
[12] Guridi J, Gorospe A, Ramos E, et al. Stereotactic targeting of the globus pallidus internus in Parkinson's disease: imaging versus electrophysiological mapping. Neurosurgery, 1999, 45(2): 278.
[13] Laitinen LV. Pallidotomy for Parkinson's disease. Neurosurg Clin North Am, 1995, 6(1): 105-112.
[14] Hiner B, Madden K, Neal J. Effect of microelectrode recording on final lesion placement in pallidotomy. Neurology, 1992, 48(Suppl): A251.
[15] Azizi A, Goldman WH, Moreledge D. Posteroventral pallidotomy:comparison of the accuracy of anatomical targets defined by MR and CT imaging with physiological targets de finedby microelectrode recording. Neurology, 1996, 46(Suppl): A199.
[16] Coubes P, Echenne B, Roubertie A, et al. Traitement de la dystonie generalisee a debut precoce par stimulation chronique bilaterale des globus pallidus internes. A propos d' un cas. Neurochirurgie, 1999,45(2): 139-144.
[17] Vayssiere N, Hemm S, Zanca M, et al. Magnetic resonance imaging stereotactic target localization for deep brain stimulation in dystonic children. J Neurosurg, 2000, 93(5): 784-790.
[18] Svennilson E, Torvik A, Lowe R, et al. Treatment of parkinsonism by stereotactic thermolesions in the pallidal region: a clinical evaluation of 81 cases. Acta Psychiatr Scand, 1960, 35(3): 358-377.
[19] Laitinen L, Johansson GG, Sipponen P. Impedance and phase angle as a locating method in human stereotaxic surgery. J Neurosurg,1966, 25(6): 628.
[20] Laitinen LV, Bergenheim AT, Hariz MI. Ventroposterolateral pallidotomy can abolish all parkinsonian symptoms. Stereotact Funct Neurosurg, 1992, 58(1-4): 14-21.
[21] Schaltenbrand G, Wharen W. Atlas for stereotaxy of the human brain.Clin Neurol Neurosurg, 1977, 80(4): 299-299.
[22] Starr PA, Turner RS, Rau G, et al. Microelectrode-guided implantation of deep brain stimulators into the globus pallidus internus for dystonia: techniques, electrode locations, and outcomes.J Neurosurg, 2006, 104(4): 488-501.
[23] Yoon MS, Munz M. Placement of deep brain stimulators into the subthalamic nucleus. Stereot Funct Neurosurg, 2003, 79(3-4):118-145.
[24] Bereznai B, Steude U, Seelos K, et al. Chronic high-frequency globus pallidus internus stimulation in different types of dystonia: a clinical,video, and MRI report of six patients presenting with segmental,cervical, and generalized dystonia. Mov Disord, 2002, 17(1):138-144.
[25] Starr PA. Deep brain stimulation for other tremors, myoclonus, and chorea. Handb Clin Neurol, 2013, 116: 209-215.
[26] Starr PA, Markun LC, Larson PS, et al. Interventional MRI-guided deep brain stimulation in pediatric dystonia: first experience with the ClearPoint system. J Neurosurg Pediat, 2014, 14(4): 400-408.
[27] Dormont D, Ricciardi KG, Tandé D, et al. Is the subthalamic nucleus hypointense on T2-weighted images? A correlation study using MR imaging and stereotactic atlas data. AJNR Am J Neuroradiol, 2004,25(9): 1516-1523.
[28] Mascott CR, Sol JC, Bousquet P, et al. Quantification of true in vivo(application) accuracy in cranial image-guided surgery: in fluence of mode of patient registration. Neurosurg, 2006, 59(1): 146-156.
[29] Elias WJ, Fu KM, Frysinger RC. Cortical and subcortical brain shift during stereotactic procedures. J Neurosurg, 2007, 107(5): 983-988.
[30] Petersen EA, Holl EM, Martineztorres I, et al. Minimizing brain shift in stereotactic functional neurosurgery. Neurosurgery, 2010,67(3 Suppl Operative): 213-221.
[31] Slavin KV, Thulborn KR, Wess C, et al. Direct visualization of the human subthalamic nucleus with 3 T MR imaging. AJNR Am J Neuroradiol, 2006, 27(1): 80-84.
[32] Patel NK, Plaha P, Gill SS. Magnetic resonance imaging-directed method for functional neurosurgery using implantable guide tubes.Neurosurg, 2007, 61(2): 365-366.
[33] Zrinzo L, Foltynie T, Limousin P, et al. Image-verified deep brain stimulation reduces risk and cost with no apparent impact on ef ficacy.Mov Disord, 2012, 27(12): 1585-1586.
[34] Burchiel KJ, Mccartney S, Lee A, et al. Accuracy of deep brain stimulation electrode placement using intraoperative computed tomography without microelectrode recording. J Neurosurg, 2013,119(2): 301-306.
[35] Mirzadeh Z, Chapple K, Lambert M, et al. Validation of CT-MRI fusion for intraoperative assessment ofstereotactic accuracy in DBS surgery. Mov Disord, 2014, 29(14): 1788-1795
[36] Mirzadeh Z, Chapple K, Lambert M, et al. Parkinson's disease outcomes after intraoperative CT-guided "asleep" deep brain stimulation in the globus pallidus internus. J Neurosurg, 2015,124(4): 902-907.
[37] Starr PA, Martin AJ, Ostrem JL, et al. Subthalamic nucleus deep brain stimulator placement using high- field interventional magnetic resonance imaging and a skull-mounted aiming device: technique and application accuracy. J Neurosurg, 2010, 112(3): 479-490.
[38] Ostrem JL, Ziman N, Galifianakis NB, et al. Clinical outcomes using ClearPoint interventional MRI for deep brain stimulation lead placement in Parkinson's disease. J Neurosurg, 2015, 124(4):908-916.
[39] Sidiropoulos C, Rammo R, Merker B, et al. Intraoperative MRI for deep brain stimulation lead placement in Parkinson's disease: 1 year motor and neuropsychological outcomes. J Neurol, 2016, 263(6):1226-1231.
[40] Nowacki A, Fiechter M, Fichtner J, et al. Using MDEFT MRI Sequences to Target the GPi in DBS Surgery. Plos One, 2015, 10(9): e0137868.
[41] van Laar PJ, Oterdoom DL, Ter Horst GJ, et al. Surgical accuracy of 3-tesla versus 7-tesla MRI in deep brain stimulation for Parkinson's disease. World Neurosurg, 2016, 93: 410-412.
