面肌痉挛的静息态脑功能和结构的初步探究
2018-04-27陆海锋张绮婷张记磊王梦星徐帅秦朝霞史妍慧何欣威杜小霞刘建仁
陆海锋,张绮婷,张记磊,王梦星,徐帅,秦朝霞,史妍慧,何欣威,杜小霞*,刘建仁*
1. 华东师范大学物理系,上海市磁共振重点实验室,上海 200062
2. 上海交通大学医学院附属第九人民医院神经内科,上海 200011
面肌痉挛(hemifacial spasm,HFS)是一种由非自主外周神经运动障碍引起的痉挛疾病,临床特征表现为由外侧面神经支配的肌肉非自主的单边收缩[1]。典型的面肌痉挛患者痉挛大多位于一侧,双侧面肌痉挛非常罕见,据统计大约只占0.6%到5%之间[2-4]。而且典型偏侧面肌痉挛的患病率为每10万人中有9.8人患有此病,平均年龄约为44岁,女性略多于男性,但整体发病年龄有年轻化的趋势[5]。因此,该病的社会关注度在不断升高。据报道,面部肌肉间歇性痉挛伴随可能一直影响着患者的情绪,而情绪因素导致患者在社交中的无形压力,两者在恶性循环中相互影响,而且很有可能会导致HFS进一步恶化成焦虑等其他疾病[6]。Bao等[7]和Batla等[8]提出,面肌痉挛虽是周围神经病,但间歇性痉挛激活自主神经系统神经内分泌机制去适应或者是抑制,可能改变了患者的中枢神经系统。有学者利用经颅磁刺激(transcranial magnetic stimulation,TMS)观察到皮层的抑制能力减弱是HFS病理至关重要的因素[9]。还有学者用正电子发射计算机断层显像(positron emission tomography,PET)发现HFS患者丘脑葡萄糖代谢异常[10]。以上结果表明HFS是受周围神经和中枢神经共同的影响而导致的。
近年来,随着磁共振影像的发展,rs-fMRI被广泛运用于帕金森氏病、轻度认知障碍、偏头痛等各种神经系统疾病的研究中[11-13]。其中局部一致性(regional homogeneity,ReHo)值是计算所选体素与其相邻的26个体素时间序列的同步性。因此,ReHo值反映了脑神经自发活动的局部一致性。有学者用ReHo方法来探究HFS脑功能的改变,并发现在额中回、扣带回中部等脑区发现异常[14]。形态学分析方法(voxel-based morphometry,VBM)是一种可以独立的分析方法,可以探测整个大脑的灰质体积并且不需要提前确定感兴趣区域[15]。但有关HFS脑功能改变的研究比较少,没有确切证据证实HFS脑功能的改变。因此笔者结合ReHo和VBM进一步探究面肌痉挛患者中枢神经系统和灰质体积的异常改变特征。
1 材料与方法
1.1 资料
搜集2015年7月至2016年10月上海交通大学医学院附属第九人民医院神经内科门诊33例偏侧面肌痉挛患者(其中17例为左侧面肌痉挛,16例为右侧面肌痉挛),33例健康志愿者作为对照组,两组的性别完全匹配并均为右利手,具体见表1。偏侧面肌痉挛的诊断由具有经验的神经内科高级医师完成,就诊根据临床病史和典型的由一侧面神经引起同侧不自主的阵发性肌肉收缩而确诊为原发性偏侧面肌痉挛。纳入标准:(1)符合偏侧面肌痉挛临床诊断标准;(2)年龄在18~70岁;(3)常规头颅MRI检查未见器质性改变;(4)入组前3个月内未接受肉毒素注射治疗。所有测试均获得了被试者本人的知情同意,并通过问卷和结构检查排除神经性或精神类疾病。该研究已通过上海交通大学医学院附属第九人民医院和华东师范大学伦理委员会的审批。
1.2 数据采集
静息态功能像和结构像的MRI数据采集是在华东师范大学上海磁共振重点实验室内完成。使用西门子3.0 T Trio仪器,在12通道头线圈内完成扫描。在扫描前采取泡沫固定头部来尽量减少被试者的头动。三维高分辨结构像采用T1加权三维磁共振序列,参数:TR 2530 ms,TE 2.34 ms,反转时间为1100 ms,反转角7°,扫描矢状位共192层,层厚1 mm,视野256 mm×256 mm,采集矩阵256×256。
静息态功能磁共振图像采用平面梯度回波T2*加权序列,参数:TR 2000 ms,TE 30 ms,反转角90°,扫描横断位共33层,层厚3.5 mm,视野220 mm×220 mm,采集矩阵64×64,一共扫描210帧数据。另外被试者在功能像扫描时被告知闭眼保持平静状态。

表1 面肌痉挛患者和健康对照的人口特征(x±s)Tab.1 Demography and clinical scores of the HFS group and control group (x±s)
1.3 数据处理和统计分析
1.3.1 数据预处理
静息态原始数据的预处理由基于SPM12 (http://www. fil.ion.ucl.ac.uk/spm/software/spm12)的静息态数据处理软件(DPABIv2.0,http: //restfmri.net)完成。具体过程包括:先将DICOM数据转化成NIFTI格式,并去除静息态数据前10个时间点。依次经过时间层矫正、头动矫正,进行功能像对准结构像,将头动,脑白质和脑脊液信号作为协变量回归掉,再标准化到MNI标准空间,然后以3×3×3的分辨率进行重采样。预处理后的数据经时域滤波(0.01<f<0.1 Hz)来减少低频和高频的呼吸影响带来的噪音,最后用6 mm半高全宽(fullwidth at half-maximum,FWHM)的高斯滤波器对ReHo结果进行空间平滑,全脑信号作为协变量去除。其间超过2 mm平动和2度转动的被试者将被剔除。
结构像的数据处理采用基于SPM12的CAT12(http: //dbm.neuro.uni-jena.de/cat12/)软件完成。主要的过程:利用CAT12将大脑分割成灰质、白质、脑脊液,再进行重组,标准化到MNI空间;再采用半高全宽高斯进行空间平滑,平滑核为8 mm。其间计算全脑颅内体积(total internal-volume,TIV ),在统计时作为协变量去除。
1.3.2 统计分析
采用SPSS 23.0软件对被试者的年龄进行独立样本t检验。采用SPM12软件分别对两组被试者的ReHo和VBM统计图进行双样本t检验。其中ReHo值的双样本t检验以年龄和性别作为回归协变量,VBM结果的双样本t检验以年龄、性别和TIV值作为回归协变量。得到两组之间的ReHo值和灰质体积显著差异的脑区。其中ReHo和VBM统计图t检验结果体素水平上的阈值为P<0.005,再经FWE检验多重比较校正(P<0.05,体素数>30),存活的脑区为显著脑区。
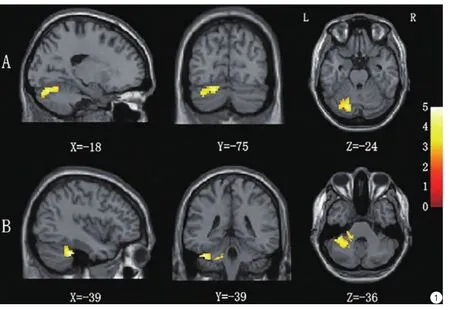
图1 两组ReHo和VBM的差异脑区图。A代表HFS ReHo值显著降低的脑区(HFS<HC,P<0.05,FWE校正)。B代表VBM结果灰质体积显著减小的脑区(HFS<HC,P<0.05,FWE校正)。L:左侧;R:右侧。图中的X,Y,Z是MNI中的坐标Fig. 1 Clusters showing significant ReHo and VBM differences between two groups. A: Brain decreased image of ReHo in the HFS (HFS<HC, P<0.05, FWE correct). B: Brain decreased image of VBM in the HFS (HFS<HC, P<0.05, FWE correct). L: Left. R: Right. X, Y, Z belong to Montreal Neurological Institute coordinates.

表2 组分析ReHo值和VBM的结果显著的脑区Tab.2 Brain regions of ReHo and VBM compared to healthy control group
2 结果
ReHo和VBM的结果:两组之间做双样本t检验,面肌痉挛患者组相对于正常对照组有显著差异的脑区主要在小脑部分,进一步用MNI小脑分割模版确认患者比对照组在左侧小脑Ⅵ区域ReHo显著降低(表2,图1),阈值为P<0.005,团块大于30个体素,cluster-level经过FWE检验矫正P<0.05。VBM的结果是患者主要在左侧小脑Ⅵ区域并延伸到左侧CrusI区灰质体积显著小于正常对照组(表2,图1),阈值为P<0.005,团块大于30个体素,cluster-level经过FWE检验矫正P<0.05。
3 讨论
本研究采用ReHo (局部一致性)分析方法,发现静息状态下偏侧面肌痉挛患者对比于健康对照在左侧小脑的Ⅵ小叶区显著降低,说明偏侧面肌痉挛患者左侧小脑的Ⅵ区神经活动的局部一致性降低。另外,VBM基于体素的形态学分析客观的定量计算得出的结果同样也是在左侧小脑的Ⅵ区显示出面肌痉挛患者比正常人灰质体积显著减少。虽然ReHo和VBM异常的脑区均在Ⅵ区,其异常的脑区较为接近,但是不完全重叠。一般脑结构的改变会影响功能,而长期的功能的改变也会导致结构的适应性的改变。本研究结果提示长期的面肌痉挛导致患者小脑Ⅵ区结构和功能的改变,且不完全重合,说明Ⅵ区可能同时存在结构和功能的改变。
目前国内外有关面肌痉挛的磁共振结构和功能的研究较少。Tu等[14]报道面肌痉挛患者相对正常人ReHo值在左侧额中回,左侧扣带回内侧,左侧舌回,右侧颞上回,右侧楔前叶下降,而ReHo值在左侧体感皮层,扣带前回,右侧脑干和小脑上升。目前笔者仅检索到此一篇相关的研究,其结果和本研究结果不一致,其原因可能是被试的异质性较大,还需要更大的样本和分侧研究来进一步验证。在本研究中同时包含了左侧面肌痉挛患者和右侧面肌痉挛患者,而其异常均发生在左侧小脑。笔者对左侧面肌痉挛患者和右侧面肌痉挛患者分开分析发现(被试有限,其结果经不起矫正),其异常的脑区有相同的地方也有不同的地方,而小脑是他们共同异常的脑区,所以笔者认为小脑在面肌痉挛的病理中发挥了重要作用。由于目前患者数据有限,分左面肌痉挛和右侧面肌痉挛研究其结果不够显著,后期的研究中将分侧研究。
研究表明,小脑是重要的运动调节中枢,小脑与大脑皮层有着正向和反向反馈系统。而大脑与小脑反馈系统表明感觉运动皮层的信息传到小脑,会在小脑的不同区域进行处理[16]。根据前人所做的与小脑相关的脑功能磁共振实验,在执行感觉运动任务时[17-20],小脑前叶Ⅴ小叶区和Ⅵ小叶区显著激活。所以在某种程度上提示,HFS患者在小脑Ⅵ小叶ReHo值的降低代表着患者在静息状态下局部感觉运动功能连接活动异常。另外,生物学方面有关研究结果表明,小脑前叶和Ⅷ小叶与手臂和腿部相关的感知觉相关,而与脸部感觉相关的则是在Ⅵ小叶[21]。因此面肌痉挛患者可能长期以来机体本身为了抑制面部肌肉的抽搐导致小脑Ⅵ小叶区异常或者受损,感觉运动能力降低。而感觉运动小脑主要对应于其躯体的感觉部分接受外界信息和本体感受的输入,通过脊髓和躯体感觉的传入,以及将输出信号发送到执行区域,以控制和引导正确的正在进行的动作,此过程有可能因异常状态而无法控制自身肌肉的跳动。Burciu等[22]在颈部肌肉痉挛(cervical dystonia,CD)的研究中也发现小脑的感觉运动区有异常。同样VBM结果显示Ⅵ小叶区灰质体积显著降低可能由于长期频繁运用该脑区导致此区域灰质体积受损。结合VBM与ReHo的结果,可能是因为长期以来的痉挛紧张影响结构上的Ⅵ小叶灰质受损,同时Ⅵ小叶也存在功能异常,功能的结构的异常同时存在,且可能相互影响。总之小脑Ⅵ小叶的异常在面肌痉挛的病理中发挥了重要作用。
总之,根据结构态和功能态的MRI结果表明,面肌痉挛患者比健康对照在感觉运动功能上有显著受损和异常。小脑的Ⅵ区损伤可能是导致患者持续痉挛的原因之一,而本实验没有发现大脑皮层的显著差异,周围神经病变所致的面肌痉挛与大脑功能结构是否相关还待进一步探究。本研究的不足之处是患者的病程跨度太大,个体差异较大,并且样本量有限。因此需要增加样本量,来进一步做与痉挛强度相关等问题。
参考文献 [References]
[1] Wang A, Jankovic J. Hemifacial spasm: clinical findings and treatment. Muscle Nerve, 1998. 21(12): 1740-1747.
[2] Alafaci C, Granata F, Cutugno M, et al. Presurgical evaluation of hemifacial spasm and spasmodic torticollis caused by a neurovascular con flict from AICA with 3T MRI integrated by 3D drive and 3D TOF image fusion: a case report and review of the literature. Surg Neurol Int, 2014, 5: 108.
[3] Sekula RF Jr, Bhatia S, Frederickson AM, et al, Utility of intraoperative electromyography in microvascular decompression for hemifacial spasm: a meta-analysis. Neurosurg Focus, 2009, 27(4): E10.
[4] Felício AC, Godeiro-Junior Cde O, Borges V, et al. Bilateral hemifacial spasm: a series of 10 patients with literature review.Parkinsonism Relat Disord, 2008, 14(2): 154-156.
[5] Lu AY, Yeung JT, Gerrard JL, et al. Hemifacial spasm and neurovascular compression. ScientificWorldJournal, 2014, 2014: 349319.
[6] Wang L, Hu X, Dong H, et al. Clinical features and treatment status of hemifacial spasm in China. Chin Med J (Engl), 2014, 127(5): 845-849.
[7] Bao F, Wang Y, Liu J, et al. Structural changes in the CNS of patients with hemifacial spasm. Neuroscience, 2015, 289: 56-62.
[8] Batla A, Goyal C, Shukla G, et al. Hemifacial spasm: clinical characteristics of 321 Indian patients. J Neurol, 2012, 259(8): 1561-1565.
[9] Kotterba S, Tegenthoff M, Malin JP. Hemifacial spasm or somatoform disorder--postexcitatory inhibition after transcranial magnetic cortical stimulation as a diagnostic tool. Acta Neurol Scand,2000, 101(5): 305-310.
[10] Shimizu M, Suzuki Y, Kiyosawa M, et al. Glucose hypermetabolism in the thalamus of patients with hemifacial spasm. Mov Disord,2012, 27(4): 519-525.
[11] Cai S, Chong T, Zhang Y, et al. Altered functional connectivity of fusiform gyrus in subjects with amnestic mild cognitive impairment:a resting-state fMRI study. Front Hum Neurosci, 2015, 9: 471.
[12] Harrington DL, Shen Q, Castillo GN, et al. Aberrant intrinsic activity and connectivity in cognitively normal Parkinson's disease. Front Aging Neurosci, 2017, 9: 197.
[13] Zhang J, Su J, Wang M, et al. The sensorimotor network dysfunction in migraineurs without aura: a resting-state fMRI study. J Neurol,2017, 264(4): 654-663.
[14] Tu Y, Wei Y, Sun K, et al. Altered spontaneous brain activity in patients with hemifacial spasm: a resting-state functional MRI study.PLos One, 2015, 10(1): e0116849.
[15] Ashburner J, Friston KJ. Voxel-based morphometry: the methods.Neuroimage, 2000, 11(6 Pt 1): 805-821.
[16] Stoodley CJ, Schmahmann JD. Evidence for topographic organization in the cerebellum of motor control versus cognitive and affective processing. Cortex, 2010, 46(7): 831-844.
[17] Stoodley CJ, Schmahmann JD. Functional topography in the human cerebellum: a meta-analysis of neuroimaging studies. Neuroimage,2009, 44(2): 489-501.
[18] Nitschke MF, Kleinschmidt A, Wessel K, et al. Somatotopic motor representation in the human anterior cerebellum: a high-resolution functional MRI study. Brain, 1996, 119 (Pt 3): 1023-1029.
[19] Bushara KO, Wheat JM, Khan A, et al. Multiple tactile maps in the human cerebellum. Neuroreport, 2001, 12(11): 2483-2486.
[20] Grodd W, Hülsmann E, Lotze M, et al. Sensorimotor mapping of the human cerebellum: fMRI evidence of somatotopic organization.Hum Brain Mapp, 2001, 13(2): 55-73.
[21] Al-Solamy FR, Khan MA. Duality in multiobjective nonlinear programming under generalized second order (F, b, phi, rho, theta)-univex functions. J Comput Analy Applicat, 2017, 23(4): 740-749.
[22] Burciu RG, Hess CW, Coombes SA, et al. Functional activity of the sensorimotor cortex and cerebellum relates to cervical dystonia symptoms. Hum Brain Mapp, 2017, 38(9): 4563-4573.
