腔内治疗19例Stanford B型主动脉夹层的临床分析
2018-04-27梁双超胡骥琼薛清泉夏友传冯桂林
梁双超,胡骥琼,薛清泉,夏友传,冯桂林,许 贝
(皖南医学院第一附属医院 弋矶山医院 血管外科,安徽 芜湖 241001)
Stanford B型主动脉夹层(aortic dissection,AD)是临床常见危重病,保守治疗病死率较高,传统的开放手术创伤大,随着血管腔内介入技术的改进和日益成熟,腔内修复术(thoracic endovascular aortic repair,TEVAR)已成为治疗AD的主要手段;有5年临床随访研究表明,TEVAR可减慢夹层的发展,降低主动脉夹层的病死率[1]。2014年1月~2017年6月,我院19例AD行腔内修复术,现报道如下。
1 资料与方法
1.1 一般资料 本组共19例患者,男15例,女4 例;年龄34~72岁,平均(42±9)岁。合并高血压17例,冠心病3例,糖尿病1 例,肾功能不全1例,慢性阻塞性肺气肿1例。入院后绝对卧床休息,监测生命体征,硝酸甘油或尼卡地平持续泵入,控制收缩压在120 mmHg以下,控制心率在60~80次/分钟,同时予以止痛镇静、保持大小便通畅、祛痰镇咳等对症处理。
19例AD患者均为Stanford B型主动脉夹层,15例患者破口距左锁骨下动脉开口距离>1.5 cm;2例患者破口距左锁骨下动脉开口距离<1.5 cm,AD近端累及左颈总动脉2例;19例AD患者合并胸腔积液者14例,其中大量胸腔积液者2例。
1.2 腔内治疗方法 19例Stanford B型AD患者行单纯TEVAR 17例,其中部分或全部覆盖左锁骨下动脉开口5例,另2例患者先行旁路手术(采用右颈总动脉-左颈总动脉人工血管搭桥),再行TEVAR。使用的支架包括Zenith TX2支架(COOK公司,美国)和Valiant支架(Medtronic公司,美国)。
术前行胸腹主动脉CT血管造影(CTA)检查,评估瘤颈长短、判断破口位置及主动脉弓形,观察椎动脉的直径及有无血管狭窄,确定优势椎动脉,决定手术方式,若左椎动脉优势,主动脉支架覆盖左侧锁骨下动脉时要慎重,必要时考虑“烟囱”术或“杂交”手术。术前还要做血管入路的评估,要求髂动脉直径>7 mm,评估有无环状钙化狭窄、是否合并髂动脉瘤;股动脉入路最好选择全真腔入路或者夹层累及较轻的一侧,在腹股沟处,沿股动脉走行做纵行切口,游离股动脉,置入穿刺鞘,导丝配合导管至升主动脉,避免进入假腔,造影确定破口和锁骨下动脉开口位置。更换Landquist导丝,导入主动脉覆膜支架,oversize在5%左右,控制收缩压在120 mmHg以下,精准释放支架,后将血压升到正常水平,退出输送系统后,再次造影检查有无近端内漏、支架有无移位、近端有无鸟嘴现象,观察内脏分支是否显影,尤其是肾动脉和肠系膜上动脉,如无明显内漏,尽量避免后扩。
1.3 随访 19例AD患者出院前复查胸腹主动脉CTA,观察有无内漏、支架位置、远端有无新发破口;出院后1、3、6、12个月复查胸腹主动脉CTA,后每年随访1次,观察有无并发症及存活情况,评估腔内修复疗效。对于肾动脉在假腔患者,随访期间尚须注意肾功能变化,定期复查同位素肾图。术中覆盖锁骨下动脉患者,尚需注意有无神经系统缺血症状和上肢乏力。
2 结果
19例Stanford B型AD患者均采用TEVAR,手术成功率100%,无术中死亡病例,11例患者术中近端可见内漏,其中3例近端内漏明显,术中行球囊扩张,再次造影后内漏明显减少,另外8例AD患者内漏出现在2个心动周期后,决定予以随访。围手术期死亡的1例出现在术后第2天,患者咳嗽明显,突然出现血压下降心跳骤停,考虑近端逆撕引起。14例胸腔积液患者中12例术后胸腔积液逐渐减少,另2例术后胸腔积液增多(图1A、B),其中1例于术后第3天出现血氧饱和度下降、发热、血象增高,复查胸部CT示双侧胸腔积液,经胸腔闭式引流,抗炎等处理后好转,仅局部形成包裹(图1C)。术中无瘤体破裂,无血管入路损伤及远端血管栓塞。术后1例患者左上肢乏力,考虑术中主动脉覆膜支架覆盖左锁骨下动脉,给予抗凝抗血小板处理后好转;7例患者术后存在不同程度发热,体温基本在39℃以下,1例最高体温达39.5℃。
19例均得到随访,随访时间3个月~3 年;11例主动脉夹层患者近端内漏术后随访消失;2例杂交手术患者术后给予华法林抗凝和氯吡格雷阿司匹林抗血小板,无人工血管闭塞(图2A~C);术后半年出现胸腔积液增多1例,系降主动脉远端继发破口引起,血流倒灌引起假腔内压力增高,在降主动脉远端植入覆膜支架后胸腔积液明显减少。2例AD患者在随访过程中出现腹主动脉段新发破口,1例患者自觉腹部胀痛,另1例患者无明显不适症状,予以继续随访。
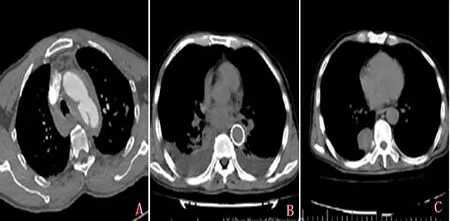
A.患者急性AD,术前左侧胸腔内少量积液;B.主动脉夹层术后双侧胸腔积液;C.经胸腔闭式引流后,胸腔积液消失,局部形成包裹。
图1 Stanford B型AD患者术前、术后胸部CT检查

A.急性AD,累及左颈总动脉,主动脉弓较陡;B.主动脉弓较陡,选择美敦力覆膜支架,行腔内修复术;C.术中行颈-颈动脉转流,拓展主动脉近端锚定区。
图2 Stanford B型AD患者术前胸腹主动脉CTA、 术中DSA下胸主动脉和弓上分支动脉造影
3 讨论
AD起病急,病死率高,TEVAR已成为主要手术方式,TEVAR主要目标是封堵近端破口,维持血流动力学稳定,避免瘤体破裂引起的死亡。对于弓形良好、近端有足够锚定区、真腔无闭塞的患者,TEVAR术操作简单,但对于主动脉弓形复杂、累及弓上分支、短瘤颈、主动脉真腔完全闭塞的AD患者,既要封堵近端破口,又要保证弓上分支血流通畅,是TEVAR术的一个难点。对于主动脉局部管腔不规则、弓较陡或明显成角的患者,要适当拓展近段锚定区的长度,主要可以采用烟囱技术、原位开窗技术、也可以采用颈-颈转流等[2],本组2例患者采用颈-颈搭桥术拓展近端锚定区,效果明确,随访期间无脑部并发症,人工血管通畅。
TEVAR术后部分患者出现发热,复查血常规白细胞升高、血小板减少,原因尚不明确,可能与菌血症、主动脉覆膜支架、手术操作、假腔内血栓形成、术后胸腔积液肺部感染等有关[3]。TEVAR术后发热发生率很高,本组TEVAR术后7例患者出现不同程度发热,其中6例患者无明确感染,1例系术后肺部感染引起。文献报道[4]术前使用抗生素与术后发热、发热持续时间无相关性,预防性使用抗生素,不能阻止术后发热的发生;最近一项临床研究表明,对TEVAR术后发热患者进行血培养,其结果都为阴性,因此对于TEVAR术后发热患者进行血培养是不必要的[5],而降钙素原可作为TEVAR 术后发热患者鉴别感染的一项可靠指标[6]。
AD合并胸腔积液发生率较高,本组19例患者术前合并胸腔积液14例,大量胸腔积液2例;围手术期胸腔中等量以下积液原则上不处理,但对于大量胸腔积液、呼吸困难明显者,则需积极处理,多采用分日分次抽吸或胸腔闭式引流,每日放出胸腔积液500 mL以下,不能追求放尽积液,大量放出积液后可能诱发大出血,抽吸或胸腔闭式引流出积液均为不凝血或血水样积液。本组2例患者术后出现胸腔积液增加,因此术后应积极寻找原因,对于围手术期术后出现胸腔积液增多的患者,应注意有无肺部感染及假腔内压力增高及假腔血栓形成反应性渗出;对于随访期间出现胸腔积液增多者,要注意近端有无明显内漏,远端是否有新发破口甚至假腔破裂。急性AD引起胸腔积液的原因,主要是因为主动脉内膜快速撕裂,血管壁受损、血液外渗致胸腔积液,而血管损伤、管壁炎症水肿又可导致反应性渗出,两者综合导致血性胸腔积液;对于大量胸腔积液患者,往往主动脉血管壁受损严重,提示夹层破裂可能,因此必须积极寻找病因并及时救治,必要时行急诊手术[7]。
急性AD术后近端逆撕是严重的并发症,发生率为1.4%~20%[8]。本组19例患者术后1例出现猝死,考虑近端逆撕。分析原因,考虑包括如下因素:主动脉支架输送系统头端较硬,过弓的时候可能会损伤动脉壁,Landquist导丝和导管也可以损伤血管壁,术中操作应轻柔;主动脉覆膜支架头端裸支架贴附主动脉壁,主动脉搏动时,相对运动可引起内膜损伤;术中主动脉支架oversize过大,移植物径向力越大,越容易损伤动脉壁,因此在选择主动脉覆膜支架时,oversize多控制在5%左右;主动脉弓角度小弓较陡,支架释放后会产生弹性回缩力,在移植物的两端,会损伤主动脉内膜;支架植入后尽量避免后扩,后扩可能会加重移植物头端对血管壁的损伤;此外,一些动脉本身病变,如白塞病和马凡综合征,因血管自身病变而极易形成新发破口。总之,为了避免主动脉夹层术后近端逆撕,我们应慎重选择主动脉覆膜支架,尽量选择径向力低、弹性回缩力小的覆膜支架;腔内操作应轻柔,主动脉支架头端释放固定后不应前后移动,支架释放后如无明显内漏和鸟嘴现象,应尽量避免后扩。
【参考文献】
[1] NINABER CA,KISCHE S,ROUSSEAU H,etal.Endovascular repair of Type B aortic dissection:long-term results of the randomized investigation of stent grafts in aortic dissection trial [J].Circ Cardiovasc Interv,2013,6:407-416.
[2] LIOUPIS C,CORRIVEAU MM,MACKENZIE KS,etal.Treatment of aortic arch aneurysms with a modular transfemoral multibranched stent-graft: initial experience [J]. Eur J Vasc Endovasc Surg,2012,43:525-532.
[3] ARNAOUTOGLOU E,KOUVELOS G,MILIONIS H,etal.Post-implantation syndrome following endovascular abdominal aortic aneurysm repair:preliminary data [J].Interact Cardiovasc Thorac Surg,2011,12(4):609-614.
[4] 谢年谨,罗淞元,薛凌,等.预防性抗生素在导管室进行完全经皮穿刺主动脉覆膜支架植入术的应用 [J].J South Med Univ,2015,35(4):578-582.
[5] CORFIELD L,CHAN J,CHANCE T,etal.Early pyrexia after endovascular aneurysm repair:are cultures needed [J].Ann R Coll Surg Engl,2011,93(2):111-113.
[6] XUE L,LUO S,LUO J,etal.Procalcitonin could be a reliable marker in differential diagnosis of post- implantation syndrome and infection after percutaneous endovascular aortic repair [J].Chin Med J(Engl),2014,127(14):2578-2582.
[7] NINABER CA,FATTORI R,MEHTA RH,etal.Gender-related differences in acute aortic dissection [J].Circulation,2004,109:3014-3021.
[8] TANG DG,DAKE MD.TEVAR for acute uncomplicated aortic dissection:immediate repair versus medical therapy [J].Semin Vasc Surg,2009,22:145-151.
