微生物酯酶的性质及其应用
2018-04-27李晓如
李晓如,白 晶,张 剑
(1. 山西大学化学化工学院,山西太原,030006;2. 山西勇宁记科技有限公司,山西太原,030006)
酯酶是一类既可催化酯键水解又可催化酯键合成的酶的总称。其催化酯键水解时,使酯键断裂,产物为醇和酸;催化酯键合成时,使酸的羧基和醇的羟基脱水缩合,产物为酯类及其他香味物质[1]。酯酶广泛存在动物、植物、微生物中[2],且微生物中细菌、真菌和酵母中的酯酶含量较为丰富,因此微生物发酵是酯酶的主要来源。由于微生物种类多、繁殖快,具有比动植物更广的作用pH、作用温度以及底物专一性[3]、便于工业生产等优点,故微生物发酵酯酶得到了研究人员的关注,并且已经将其广泛应用于食品加工、医药化学品、洗涤行业和环境保护等领域[4]。除此之外,酯酶的酶促反应具有较高的底物专一性、区域选择性或者对映选择性,酯酶是合成手性化合物(如手性药物、农药等)的高效生物催化剂[5]。近年来微生物发酵的酯酶已成为研究热点[6]。本文从酯酶的来源、产酯酶菌株的筛选以及发酵条件和培养方法进行了综述,并结合酯酶的分子结构,对酯酶的催化特性和应用做了总结,以期今后对酯酶的研究提供有益的借鉴。
1 酯酶
1.1 酯酶的来源
自然界中能产酯酶的微生物种类非常丰富,主要有真菌、酵母菌和细菌,其中真菌有曲酶菌、青霉菌、根霉菌、毛霉菌、链孢霉菌、犁头霉菌、须霉菌、白地霉菌等12属23种[7];酵母类有假丝酵母、毕赤酵母、红酵母等;而产酯酶的细菌种类特别多,包括芽孢杆菌、微球菌、假单孢菌、乳酸菌等。这些产酯酶微生物的分布环境也是多种多样的,如工厂废弃物、植物油加工厂、油脂污染的土壤等。
1.2 酯酶的特性
1.2.1 酯酶的结构及催化特性
酯酶是 a / b 水解酶,具有典型的 a / b 水解酶的结构特征[8],由8个平行的 b 折叠和6个 a 螺旋组成[9],其中疏水的 b 折叠排列在酶分子的结构中央,亲水的 a 螺旋则分布在两侧,a 螺旋和 b 折叠之间则由Loop环连接[10-11](如图1)。
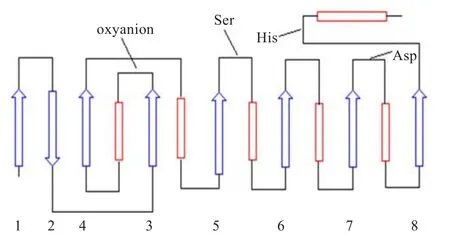
图1 α/β水解酶折叠示意图[12]
酯酶结构中含有一个丝氨酸-天冬氨酸-组氨酸的催化三联体(Ser-Asp-His),使其具有催化活性[13]。催化过程一般为[8]:①酶分子活性中心丝氨酸残基的羟基被组氨酸残基活化后,丝氨酸残基的羟基氧形成亲核基团对底物羰基碳原子进行亲核攻击,发生亲核加成反应;②亲核加成反应后形成四面体化合物,四面体中间物的氧负离子与酶分子中氧阴离子的两个氨基酸残基酰胺键上的-NH-形成氢键以稳定中间态;③底物酯键发生断裂生成酰化酶,同时释放底物醇。水分子继而被组氨酸残基激活,水分子中的羟基对酰化酶上的羰基碳原子发生亲核攻击;④组氨酸将质子传递给丝氨酸残基的氧原子导致酰化酶酯键断裂,同时释放出羧基产物,完成催化过程[14]。
在含水量低的条件下,反应体系由液-液双相、液-固双相、反胶团和微水相体系组成。一般情况酯酶溶解在反胶团或双相体系中的水相里,还可以以不溶性粉粒或以固定化酶的形式存在于有机相中。大量的实验数据表明,酯酶在有机相中的催化优于在水相中的催化,这是由于有机介质可以增加酯酶的热稳定性,增加非极性底物的溶解度,减少反应的副产物,增加合成反应的速率。及时移出反应产物,有利于酯催化反应的进行。另外酶的用量、反应温度和pH值也对酯酶催化有一定的影响[15](图2)。
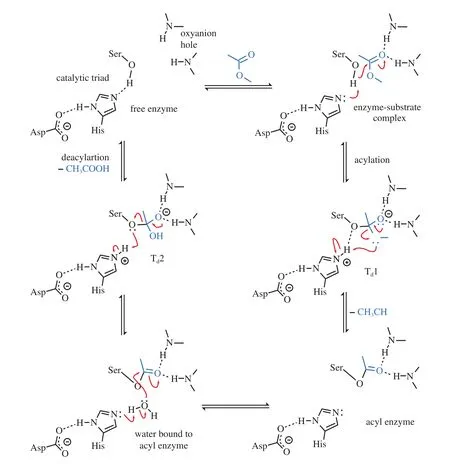
图2 酯酶水解Estera醋酸甲酯的典型机理示意图[12]
1.2.2 酯酶与脂肪酶的差异
微生物酯酶和微生物脂肪酶的定义和分类在文献报道中并没有加以严格区分,但实际上还是存在一些差异:①酯酶与脂肪酶的差异主要在于作用底物碳链长短的不同,脂肪酶优先水解长链酯类,酯酶则优先水解短链酯类[16]。对于酯酶和脂肪酶催化酯类化合物分子的水解,酯酶作用于I型酯,脂肪酶作用于II型酯(如图3),对于由较大基团的手性羧酸和较小基团的醇形成的酯,其水解或酯交换选择酯酶催化较为适宜;而对于由较小基团的羧酸和较大基团的手性醇形成的酯,进行水解和转酯化反应时则选择脂肪酶催化较为适宜。②两者作用底物的物理状态不同,即脂肪酶主要在两相体系(油-水界面)上作用,而酯酶只作用于水溶性的底物或者只能分解已溶解的底物[17]。③脂肪酶催化的反应存在界面激活现象,而酯酶的反应遵循经典的米氏动力学过程。酯酶和脂肪酶都能稳定存在于有机溶剂中并表现出活性,但脂肪酶的这一特征更为突出。④虽然酯酶和脂肪酶结构大多都是 a / b 的水解酶的典型特征,但是脂肪酶存在一个疏水的盖子结构,对催化反应有一定的选择性[18]。
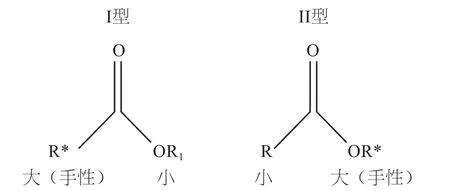
图3 酯酶/脂肪酶催化多数底物特征
1.3 酯酶的分类
1.3.1 Alridge分类
1953年,Alridge通过对硝基苯酯的鉴别,把从兔的血清中提取的酯酶命名A酯酶和B酯酶,因此,后来的学者习惯就把Alridge对酯酶的分类定义为Alridge分类[19]。根据Alridge的分类,酯酶可以分为三类:A类酯酶,B类酯酶,C类酯酶。A类酯酶以有机磷化合物为作用底物,包括:①异丙基氟磷酸酯酶,这类酯酶水解化合物梭曼、沙林,一般需要金属Co2+、Mg2+、Mn2+作辅助因子。②对氧磷酶水解对氧磷一类的有机膦化合物。这类酯酶以Ca2+为辅基。而B类酯酶却被有机膦化合物所抑制,B类酯酶是一类广泛分布于组织、器官的丝氨酸类,能水解许多含有羧酯键、硫酯键、酰胺键的内源性和外源性物质。其主要功能可能是参与药物和毒物等的生物转化、脂质代谢、信号转导及维持生物膜结构的完整性,包括脂族酯酶和胆碱酯酶。其他不与有机膦化合物作用的酯酶称为C类酯酶。Alridge分类不够精确,各种酯酶不能逐一系统地进行分类,比较混乱。
1.3.2 标准分类
依据国际酶学委员会的标准,每一个酶的分类由4个数字组成,数字之前加上“E.C”。目前按这种分类的酯酶有31种大类[20],包括羧酸酯酶(EC3.1.1)、硫酯酶(EC3.1.2)、磷酸单酯酶(EC3.1.3)、磷酸二酯酶(EC3.1.4)、三磷酸单酯酶(EC3.1.5)、硫酸酯酶(EC3.1.6)、二磷酸单酯酶(EC.3.1.7)、磷酸三酯酶(EC3.1.8)等。这种分类方法比较明确,但是目前对于酯酶的系统分类标准还不能满足要求,经常有新鉴定和命名的酯酶需要调整分类地位和系统名称。
1.3.3 其他分类
Walk[21]等根据酯酶对作用底物的特异性和等电点也进行了分类,这种分类方法也不够精确,因为酯酶作用底物复杂多样,并且有重叠性,难以逐一区分,且各种底物的等电点数值差异微小。
2 微生物酯酶的发酵
2.1 产酯酶菌株的筛选
产酯酶菌种的筛选一般有两个步骤:初筛和复筛。初筛多是采用平板培养透明圈法,一般是将筛选到的菌种进行富集,然后用无菌水稀释,涂布在含有酯酶的合适底物的平板上,通过培养一段时间后,平板上菌落周围会形成透明水解圈,并根据透明圈的大小初筛合适的菌种。Guillermo[22]等利用透明圈变色法来筛选产酯酶的菌种,相比较传统的筛选方法,筛选结果更为清晰可见,变色透明圈更为直观。复筛是将初筛得到的产酯酶能力较强的菌株移入三角瓶内振荡培养,然后通过较为精确的荧光比色法(乙酸萘酯或对硝基苯酚检测法)对产物进行分析检定,从中找出产酶量最高、性能上更符合要求的菌株。
“公司早期以把产品按照客户的需求做出来为目标,注重成品是否满足客户的设计与需求”,吴重蔚坦言,而随着时间的推移,栢科富翔尝试为客户提出建议,刚开始偏重于实物的建议,后来介入更高层次的设计环节。“公司专门成立了设计部,帮助客户做出更加合理的设计。有的客户甚至把整个项目交给我们来做,客户给出预算,公司则按照预算金额完成设计和制作。” 吴重蔚也表示,有时候客户描述得比较抽象,而使其具体化、图像化确是件不容易的事,但换个角度来看,设计师的理想与现实的差距就是企业生存的空间。
2.2 微生物酯酶的发酵过程
通过改变培养基成分和培养条件来提高酯酶的发酵产量已有许多相关报道[23]。培养基成分和培养条件对菌种的生长以及酶的生产有着最直接的影响。
2.2.1 培养基成分
(1) 碳源
碳源是菌体细胞组成的原料,也是菌体生长发育必需的能源物质。某些碳源是酶的诱导剂,选择适宜的碳源既可提高相应酶的产量,也有利于定向地促进某些酶的合成。如干酪乳杆菌产生的一种耐热酯酶,需要三丁酸甘油酯的诱导;假单胞菌产生的磷酸三酯酶,需要磷酸盐或者相应特殊碳源的诱导。Wang[24]等利用三乙酸甘油酯为底物,从自然发酵的黄皮果汁中筛选产酯酶优良的菌种进行研究,三乙酸甘油酯为唯一碳源,且对酯酶的筛选有一定的促进作用,结果从样品中筛选出一株产酯酶菌种C10,通过酶学特性分析,该菌种所产酯酶为碱性酯酶,最适条件为60℃,pH9,并且该酯酶有较好的耐热性和稳定性。
(2) 氮源
氮源是菌体蛋白质和核酸的重要组成原料。各种微生物对氮源的利用情况相当复杂。焦云鹏[25]等对黑曲霉产果胶酯酶发酵条件进行探讨,发现以蛋白胨为氮源的液体发酵产生的果胶酯酶比以无机氮发酵产生的酯酶的量比高。
2.2.2 培养条件
培养条件对酯酶产量也有影响,例如培养温度。培养温度不仅能影响酯酶菌体的生长,也影响酯酶的合成以及合成后的稳定性,特别是耐热性菌。 Thermurs sp.FD3041是国内温泉分离得到的一株栖热菌[26],培养温度为70℃,得到的胞内碱性磷酸酯酶FD2TAP,最适温度是70℃;Pyrococcusabyssi是从深海火山中分离得到的异养古细菌[27],最适生长温度是100℃,得到胞内碱性磷酸酯酶的最适温度为70℃。

2.3 微生物酯酶的发酵工艺
微生物酯酶的液体深层培养生产法就是采用液体培养基,在发酵瓶内进行一种通风搅拌式培养,其优点是易于控制、不易染杂菌;缺点是周期长。潘名志[30]等通过对4株红曲霉进行液体深层培养研究,筛选出产酯化酶能力较高的红曲霉菌ZK,此菌种产酶的酶活力提高了42.3%。固体发酵生产法和液体深层培养生产法是产酯酶菌种常用的两种方法,菌种培养大多时候只需要一种培养方法,有时候需要两种方法配合完成。
3 酯酶酶活力的测定方法
目前酯酶酶活力测定的方法有比色法、氢氧化钠滴定法、a -乙酸萘酯比色法等。
3.1 比色法
以对硝基苯酚为作用底物,利用紫外分光光度计在400nm处测体系的吸光度值。文献报道的具体过程为[31]:取1mL 1mmol/L对硝基苯醋酸酯(p-NPC2)溶液、2mL Tris-HCL pH7.2的缓冲液加入试管,于40℃恒温水浴15min,再加1mL酶液震荡反应8min,立即加2mL 0.1mol/L盐酸终止反应,在400nm处测吸光度值。以加入1mL灭活酶液作对照。每分钟催化产生1mmol对硝基苯酚的酶量为1个酶活力单位。
3.2 氢氧化钠滴定法
以NaOH滴定三醋酸甘油酯在酯酶作用下所释放的醋酸来测定[32]。具体过程为:取5.9mL甘油三醋酸酯置于100mL的容量瓶中,加蒸馏水充分摇匀溶解,定容至100mL,取上述溶液20mL,放入三角瓶内,调温40℃,用0.05mol/L的NaOH将pH值滴定至6.5。然后加2mL酶液,40℃搅拌反应30min,过程中以NaOH维持pH值为6.3~6.5,读取NaOH耗量,用灭活酶液作对照。酶活力单位的定义:每分钟催化分解三醋酸甘油酯释放1mmol游离醋酸的酶量为1个酶活力单位。
3.3 α-乙酸萘酯比色法
乙酸萘酯是酯酶的一种作用底物,在显色剂的辅助下可以用来检测酯酶酶活力,其检测的原理是:
乙酸萘酯+水+酶→萘酚+乙酸
萘酚+偶氮盐→褐色偶氮化合物+氯化锌+盐酸
乙酸萘酯经酯酶水解后,生成的萘酚与偶氮盐反应生成褐色偶氮化合物[33],可以根据颜色的变化来确定酶活力的大小。Baumann M[34]等采用乙酸酯为筛选底物的方法,通过底物羧基端(乙酸)的释放速度来测定酶活的大小;孙中涛、薛庆节[35]等通过a-乙酸萘酯检测法对工程菌酯酶进行了纯化、性质和固定化的研究。
4 酯酶的应用
酯酶作为一种重要的工业用酶,可催化酯交换、酯合成、多肽合成及内酯合成等多种反应,且具有反应不需要辅酶、反应条件较温和、催化活性高以及选择性强等优点,因此,酯酶被广泛应用于洗涤剂、食品、饮料、油脂、造纸、饲料、纺织、皮革、精细化工、新型材料、医药、化妆品、环境治理、生物能源等工业领域。
4.1 酯酶在食品加工中的应用
酯酶主要是通过酯交换、水解[36]及合成化合物等在食品加工中广泛应用。与使用传统酶相比较,将酯酶应用于食品加工过程中可减少纤维素水解、蛋白质消化等引起的食品污染问题,同时也可提高食品的食用性能。如酱油和食醋的酿造过程中加入酯酶,可提高乳酸乙酯、乙酸乙酯等酯类的含量,从而增加产品的香味,提高了产品的口感[37];酿酒过程中加入酯酶,可催化合成香酯液,应用于浓香型白酒,大大缩短了发酵周期,提高了酒质和香味;同样酯酶也可以使乳制品增香;食用油脂提炼工艺中,酯酶能催化脂肪酸与甘油之间的酯化反应,可以把油中的大量游离脂肪酸转变成中性甘油酯,提高了食用油的价值;酯酶催化合成的单甘脂是食用量最大的食品乳化剂[38]。
4.2 酯酶在医药行业中的应用
由于酯酶酯化反应具有高底物专一性、区域选择性、对映选择性等优点。在手性化合物拆分、药物合成等领域呈现出很大的应用潜力。在医药领域很多药物都是手性化合物,而近年来酯酶拆分已经成为手性化合物拆分的研究热点。用酯酶拆分酮基布洛芬、(R)-氟比洛芬等手性药物,均提高了对映体过量值,也提高了药物的使用性和有效性。Zheng[39]等利用来自大肠杆菌的纯化酯酶进行薄荷醇的转酯化的拆分,结果表明,酯酶对乙酸薄荷酯的E值大于100,效果较好。宣磊[40]等采用巨大芽孢杆菌WZ009酯酶催化水解拆分(R,S)-3-羟基丁酸乙酯得到(R)-EHB,通过对酯酶催化水解反应条件的探讨得出,在30℃,pH7的条件下,反应经过2h,(R)-EHB对映体过量值eep达到99%,底物转化率达到55.5%。Zheng[41]等利用从重组细胞中提取的羧酸酯酶,在无水乙醇做溶剂,35℃,pH7.5条件下选择性地合成了(S)-1-苯基-1,2-乙二醇,它的对映体过量值eep达到99%,底物转化率达到45%。
4.3 酯酶在环保行业的应用
随着科学的进步,农作物产量的提高,伴随着农业生产中使用的农药量也在不断增加,带来的农药污染、残留问题也日趋严重,其中农药中菊酯类杀虫剂在自然条件下难以降解,给食品安全和环境污染带来了巨大隐患,并且有研究表明,菊酯类杀虫剂具有类固醇结合活性,可能导致人体激素的波动。许多研究人员对菊酯类杀虫剂做了大量的研究工作,起初是从小鼠肝脏中和昆虫内发现了能降解菊酯农药的酯酶,近年来,研究发现,酯酶降解菊酯具有良好的功效,目前已筛选到能有效降解氯氰菊酯和丙烯菊酯等相关的酯酶基因,并将酯酶基因克隆导入微生物中[42]。未来构建产酯酶的高效基因工程菌将是环境保护的一个发展趋势。

4.4 酯酶在洗涤工业中的应用
酯酶可催化合成糖酯类生物表面活性剂,也有提高表面活性剂释放的作用[43],具有低毒、环保、特异性强等优点,因此酯酶在洗涤用品等行业广泛使用。Spicka[44]等利用芳基酯酶和过氧化氢原位产生的过乙酸在65℃下对棉织物漂白,得到了满意的漂白效果。与传统高温高碱条件下的漂白相比,该方法的优点是在温和的作用条件下进行,即接近中性的pH和温度为65℃的条件下,酶促反应产生的过乙酸具有很强的漂白性能。并且酶促漂白绿色环保,不需要添加大量的辅助剂和化学试剂。
5 展望
目前酯酶的结构已知是 a / b 水解酶的典型结构,但具体在催化过程所涉及到许多机理尚不明朗;酯酶的系统分类标准还不能满足分类的要求,许多新检索的酯酶还不能逐一详细地进行命名分类;从环境中筛选产酯酶的微生物菌种效率低。但近年来,随着基因文库、基因工程、定向进化技术、固定化技术的发展,以及界面酶促过程等技术的深入研究,酯酶的研究可能具体到酯酶结构中的分子层,高效产酯酶菌种的筛选和酯酶发酵培养条件的优化、诱变育种、基因克隆等,进而构建高效基因工程菌的研究取得了很大的发展。继而可能挖掘酯酶在食品、医药、环保和洗涤行业中更加广泛的应用。
[1] Sebastián T, Mariod B, Swathy S L, et al. Enzymatic synthesis of banana flavour (isoamyl acetate) by Bacillus licheniformis S-86 esterase[J]. Food Research International, 2009,42(4):454-460.
[2] 张敏文, 刘悦, 李荷. 微生物酯酶的研究进展[J]. 广东第二师范学院学报, 2012, 32(3):66-71.
[3] 杨柳. 脂肪酶的应用与研究现状[J]. 硅谷, 2012(16):69-69.
[4] 徐诗伟, 王维庆. 微生物酶不对称水解合成S(+)—布洛芬的研究:Ⅰ.高度立体选择性 [J]. 微生物学报, 1995(3):190-196.
[5] Xin L, Huiying Y. Purification and characterization of an extracellular esterase with organic solvent tolerance from a halotolerant isolate, Salimicrobium sp. LY19.[J]. Bmc Biotechnology, 2013, 13(1):108.
[6] Panda T, Gowrishankar B S. Production and applications of esterases[J]. Applied Microbiology & Biotechnology, 2005,67(2):160.
[7] Bavaro T, Filice M, Bonomi P, et al. Regioselective Deprotection of Peracetylated Disaccharides at the Primary Position Catalyzed by Immobilized Acetyl Xylan Esterase from Bacillus pumilus[J]. European Journal of Organic Chemistry, 2011(31):6181-6185.
[8] Jaeger K, Dijkstra B W, Reetz M T. Bacterial Biocatalysts:Molecular Biology, Three-Dimensional Structures, and Biotechnological Applications of Lipases[J]. Annual Review of Microbiology, 1999, 53(1):315-351.
[9] Nardini M, Dijkstra B W. Alpha/beta hydrolase fold enzymes: the family keeps growing.[J]. Current Opinion in Structural Biology, 1999, 9(6):732-737.
[10] Ollis D L, Cheah E, Cygler M, et al. The α/β hydrolase fold[J].Prot Eng, 1992, 5(3):197-211.
[11] Heikinheimo P, Goldman A, Jeffries C, et al. Of barn owls and bankers: a lush variety of alpha/beta hydrolases.[J]. Structure,1999, 7(6):R141.
[12] Rauwerdink A, Kazlauskas R J. How the Same Core Catalytic Machinery Catalyzes 17 Different Reactions: the Serine-Histidine-Aspartate Catalytic Triad of α/β-Hydrolase FoldEnzymes[J]. Acs Catalysis, 2015, 5(10):6153.
[13] Ericsson D J, Kasrayan A, Johansson P, et al. X-ray structure of Candida antarctica lipase A shows a novel lid structure and a likely mode of interfacial activation.[J]. Journal of Molecular Biology, 2008, 376(1):109-119.
[14] Aertgeerts K, Ye S, Tennant M G, et al. Crystal structure of human dipeptidyl peptidase IV in complex with a decapeptide reveals details on substrate specificity and tetrahedral intermediate formation[J]. Protein Science, 2004, 13(2):412–421.
[15] Smith AJ; Müller R; Toscano MD; Kast P; Hellinga HW; Hilvert D; Houk KN. Structural Reorganization and Preorganization in Enzyme Active Sites: Comparisons of Experimental and Theoretically Ideal Active Site Geometries in the Multistep Serine Esterase Reaction Cycle[J]. Journal of the American Chemical Society, 2008, 130(46):15361-15373.
[16] Song C, Sheng L, Zhang X. Immobilization and characterization of a thermostable lipase.[J]. Marine Biotechnology, 2013,15(6):659.
[17] 李香春, 甄宗国. 脂肪酶特性及其应用[J]. 粮食与油脂, 2003(3):19-20.
[18] Jochens H, Stiba K, Savile C, et al. Converting an esterase into an epoxide hydrolase[J]. Angew Chem Int Ed Engl, 2010,48(19):3532-3535.
[19] Aldridge W N. Serum esterases I. Two types of esterase (A and B) hydrolysing p-nitrophenyl acetate, propionate and butyrate,and a method for their determination.[J]. Biochemical Journal,1953, 53(1):110.
[20] 张立军, 弓雪, 汪澈,等. 酯酶功能和编码基因的多样性[J]. 沈阳农业大学学报, 2010, 41(5):515-520.
[21] Walker C H, Mackness M I. Esterases: problems of identification and classification[J]. Biochemical Pharmacology, 1983,32(22):3265.
[22] Castro G R, Stettler A O, Ferrero M A, et al. Selection of an extracellular esterase-producing microorganism[J]. Journal of Industrial Microbiology, 1992, 10(3-4):165-168.
[23] Cheng Q, Zi-Lan L I, Xiao L L, et al. Screening Rucheng County,Hunan Hot Spring Enzyme Producing Bacteria[J]. Journal of Huaihua University, 2016.
[24] 王文文, 张东峰, 汤敬谦. 黄皮果汁中酯酶产生细菌的选育与酶学特性研究[J]. 食品研究与开发, 2015(11):123-126.
[25] 焦云鹏. 黑曲霉产果胶酯酶发酵条件的研究[J]. 中国酿造, 2007,26(12):28-31.
[26] 盛小禹, 王曦, 高静波,等. 嗜热细菌的碱性磷酸酯酶的研究[J]. 中国生物化学与分子生物学报, 1997, 13(6):672-676.
[27] Zappa S, Rolland J L, Flament D, et al. Characterization of a Highly Thermostable Alkaline Phosphatase, from the Euryarchaeon Pyrococcus abyssi[J]. Applied & Environmental Microbiology, 2001, 67(10):4504-4511.
[28] 李佐华, 张静, 吴衍庸,等. 浓香型酒优质、高产的酶工程技术应用研究[J]. 酿酒科技, 1997(4):23-24.
[29] 滕巍, 李国莹, 刘小波,等. 大曲中产酯化酶菌株的分离鉴定及固体发酵工艺优化[J]. 食品与生物技术学报, 2016, 35(9):971-977.
[30] 潘名志, 谭艾娟, 刘爱英,等. 红曲霉产酯化酶液体培养基研究[J]. 山地农业生物学报, 2009, 28(1):58-62.
[31] Westlake K, Mackie R I, Dutton M F. T-2 toxin metabolism by ruminal bacteria and its effect on their growth[J]. Applied &Environmental Microbiology, 1987, 53(3):587.
[32] 施特尔马赫. 酶的测定方法[M]. 中国轻工业出版社, 1992.
[33] Bornscheuer U T, Stürmer R, Baumann M. A High‐Throughput‐Screening Method for the Identification of Active and Enantioselective Hydrolases[J]. Chemie Ingenieur Technik - CIT,2015, 74(5):559.
[34] 孙中涛, 闫艳春, 姚良同,等. R-工程菌表达产物酯酶B1的纯化及其特性[J]. 安全与环境学报, 2003, 3(6):31-35.
[35] 薛庆节, 闫艳春, 张杰. R-工程菌表达产物酯酶B1的固定化及其降解特性[J]. 农业环境科学学报, 2005, 24(2):299-303.
[36] Cherif S, Fendri A, Miled N H, et al. Crab digestive lipase acting at high temperature: Purification and biochemical characterization[J]. Biochimie, 2007, 89(8):1012-1018.
[37] 王立梅, 齐斌, 马秀华,等. 酶法酿醋的研究[J]. 吉林农业大学学报,1994(3).
[38] Salameh M, Wiegel J. Lipases from extremophiles and potential for industrial applications.[J]. Advances in Applied Microbiology, 2007, 61(61):253.
[39] Zheng G, Zhang J, Xu J. Enzymatic preparation of l -menthol by a high concentration substrate tolerable esterase from a newly isolated Bacillus subtilis, ECU0554[J]. Journal of Biotechnology,2008, 136(4):S366.
[40] 宣磊, 郑建永, 何耀莹,等. 微生物酯酶催化合成(R)-3-羟基丁酸乙酯[J]. 发酵科技通讯, 2013, 42(2):13-17.
[41] Tian X, Zheng G W, Li C X, et al. Enantioselective production of (S)-1-phenyl-1,2-ethanediol from dicarboxyesters by recombinant Bacillus subtilis, esterase[J]. Journal of Molecular Catalysis B Enzymatic, 2011, 73(1):80-84.
[42] Qin S. Separation and aquatic toxicity of enantiomers of synthetic pyrethroid insecticides.[J]. Chirality, 2005, 17(S1):S127-S133.
[43] Sekhon K K, Khanna S, Cameotra S S. Enhanced biosurfactant production through cloning of three genes and role of esterase in biosurfactant release[J]. Microbial cell factories, 2011,10(1):49.
[44] Tavcer P F. Effects of Cellulase Enzyme Treatment on the Properties of Cotton Terry Fabrics[J]. Fibres & Textiles in Eastern Europe, 2013, 21(6):100-105.
