大麻幼苗叶形与毛状体及乳汁管性状的相关性研究
2018-04-27程薪宇徐海军郭梦桥孙宇峰曹焜潘冬梅魏国江王晓飞张旭王晓楠
程薪宇,徐海军,郭梦桥,2,孙宇峰,曹焜,潘冬梅,魏国江,王晓飞,2,张旭,2,王晓楠*
(1.黑龙江省科学院大庆分院,黑龙江大庆163319;2.黑龙江省科学院高技术研究院,哈尔滨150020)
大麻(Cannabis sativa L.)又名寒麻、线麻、火麻等[1],为大麻科(Cannabaceae)大麻属一年生直立草本植物,原产锡金、不丹等国,现各国均有野生或栽培[2]。大麻是一种重要的经济作物,根据用途可分为纤维用、籽用和药用3类,现有品种150个左右[1]。但大麻同时也是一种具有制幻作用的毒品[3],其主要毒性成分为四氢大麻酚(Tetrahydrocannabinol,THC)[4-7]。摄入过量的 THC可导致拟精神病症状,诸如人格解体、幻听、幻视、幻觉,对记忆力损害等[4]。国际上将THC含量低于0.3%的品种称为纤维大麻或工业大麻[8],而将THC含量高于0.3%的品种称为药用或毒品大麻(Marijuana、Hashish)[9]。目前,低毒大麻品种选育是工业大麻育种的重要方向之一[10-12],而在低毒品种选育过程中,主要利用组织化学[9]或色谱法[13-14]来检测毒性高低,但这些方法的高成本及低效性却大大延长了新品种选育周期。
植物的形态特征能在一定程度上反映作物的品质,可作为经济作物品种选育的重要参考依据[15-17]。同时,形态学特征亦可作为大麻优良品种选育的依据,如株高、茎粗常被用作高纤品种选育的参考依据[18],穗紧凑程度及花性状则主要作为低毒品种选育的依据[19]。以上形态学特征主要通过观察快速生长期及随后发育时期的植株来获得,大麻优势植株的首次筛选并非始于快速生长期,而是始于对幼苗期植株的间苗过程。然而目前尚未见关于大麻幼苗期优势植株筛选依据方面的报道。Furr等[20]曾通过组织化学染色法对不同时期、不同部位的大麻植株进行染色处理,发现大麻酚类物质主要集中于乳汁管及腺毛中,这一结论在后期的研究中也得到了证实[21-23]。由此可见,大麻腺毛及乳汁管数量很可能成为反映大麻酚类物质含量或毒性高低的间接判断依据。但这些特征在田间实际生产中无法轻易获得,需在找到与之相关性强且便于观察的特征的前提下,方有可能将其应用至田间工作中。因此,本研究选取4个大麻品种火麻1号、火麻3号、金刀-15和格列西亚以及两个高世代种资源20170114和资源CA-4幼苗期(6叶期)完全展开的第一真叶作为研究材料,对其外形、毛状体特征和叶柄乳汁管数进行观察统计,并对其进行相关分析及因子分析,旨在找到与大麻腺毛及乳汁管数量相关且能直接应用于生产中的幼苗形态学性状,为减轻大麻低毒品种育种工作量提供形态学依据。
1 材料与方法
1.1 试验材料
本研究以4个大麻品种火麻1号、火麻3号、金刀-15和格列西亚以及两个高世代种资源20170114和资源CA-4为试验材料。其中金刀-15和格列西亚引自乌克兰,其余材料由黑龙江省科学院大庆分院提供。试验于2017年5月在黑龙江省大庆市东风农场黑龙江省科学院大庆分院试验基地进行,土壤为盐碱化草甸土,其理化性质为:pH 8.48,碱解氮220.13 mg/kg,速效磷24.57 mg/kg,速效钾349.32 mg/kg,有机质 17.6 mg/kg,测土配方施肥;播种后立即进行封闭除草,视实际情况采取灌溉及病虫害综合防治等措施。播种密度为450粒/m2。
1.2 试验方法
1.2.1 形态学试验材料采集
每种供试材料随机采集5株幼苗期(6叶期)植株,重复3次,摘取第一真叶(第一对真叶中的一片),固定于FAA固定液(甲醛、冰醋酸、70%乙醇按1∶1∶18比例混合而成)中24 h以上。
1.2.2 观察方法
待大麻叶完全固定后,按以下方法进行观察:
叶外形——将叶平展后,用相机拍照,并用Image J进行叶柄长度、叶片长度、叶片宽度、叶面积的测量,柄叶比为叶柄长度/叶片长度。
叶柄乳汁管数——用双面刀片制作大麻叶柄徒手切片,并将其制作成临时装片后,用莱卡DM4000B进行观察,Las X软件计数。
毛状体相关性状——将叶片直接制成临时装片,用莱卡DM4000B在叶片最宽处附近随机选取3个远离叶脉的区域进行叶片腹背面(近轴面及远轴面)毛状体特征的观察,并用Las X软件统计和测量非腺毛及腺毛的密度(每平方毫米中的毛状体数量,重复观察3个视野,取平均值)、总数(由密度值与叶面积值相乘所得)和腺毛直径(视野中所有腺毛直径的平均值,重复观察3个视野,取平均值)。
1.2.3 统计分析
利用SPSS 20.0对大麻形态学观察结果进行相关性分析和因子分析。
2 结果与分析
2.1 叶形态学性状分析
供试材料16个形态学性状的平均值及变异情况见表1。由表1可知,叶片长度、叶片宽度、叶面积、腹面腺毛直径和背面腺毛直径的变异系数相对较小,分别为11.99%、12.50%、22.28%、9.87%、9.48%,表明与大麻叶片外形及腺毛直径相关的性状相对稳定。而叶柄外形及毛状体数量相关的性状在大麻个体间的差异却较大,其中叶柄长度、柄叶比、叶柄乳汁管数、腹面非腺毛密度、腹面非腺毛总数、腹面腺毛密度、腹面腺毛总数、背面非腺毛密度、背面腺毛密度、背面腺毛总数的变异系数分别 42.27%、40.91%、54.07%、52.63%、60.15%、77.98%、82.42%、50.86%、102.17%、103.33%,表明这些性状在研究大麻个体差异及变化规律方面具有更高的实用价值。
2.2 大麻叶形态学性状相关性分析
对大麻幼苗叶外形、毛状体及乳汁管性状进行相关性分析(详见表2),结果显示叶片外形性状间存在极显著正相关关系,其中叶面积与叶片长度和叶片宽度的相关系数分别为0.892和0.851;与叶柄外形相关的两个性状,叶柄长度和柄叶比之间的相关系数为0.950;与毛状体数量有关的性状间的相关性均达到极显著水平,其中腹面非腺毛密度与腹面腺毛密度、腹面腺毛总数、背面腺毛密度和背面腺毛总数的相关系数依次为0.893、0.864、0.872和0.880。腺毛直径相关的两个性状腹面腺毛直径和背面腺毛直径与本研究观察的其它大麻叶性状相关性较弱,而二者彼此间却呈极显著正相关,相关系数0.734。由此可见,选择一些指征性良好的指标来代替绝大多数观测指标是可行的。
2.3 叶形及毛状体性状因子分析
2.3.1 叶形性状因子分析
由上述结果可知,大麻叶各类特征内部性状彼此间常存在较强的相关性,经主成分进一步分析,可知:叶形相关性状可提取为两个主因子,贡献率分别为64.739%和27.019%,累计贡献率为91.758%,说明这两个主因子可以对叶形性状做出很好的解释。但叶片长度、柄叶比及叶柄长在两个主因子中的载荷量均较大,为了更好的定义因子并解释向量,将成分矩阵进行正交旋转,将上述3个变量分别归入2个公因子中,结果表明,第一公因子主要包括叶面积、叶片长度和叶片宽度,其荷载系数分别为0.966、0.927、0.811,主要反映的是叶片外形特征,将其命名为“叶片外形因子”;柄叶比及叶柄长度在公因子2上有较大的载荷,载荷量分别为0.996和0.930,主要反应的是叶柄外形相关特征,因此命名为“叶柄外形因子”。

?
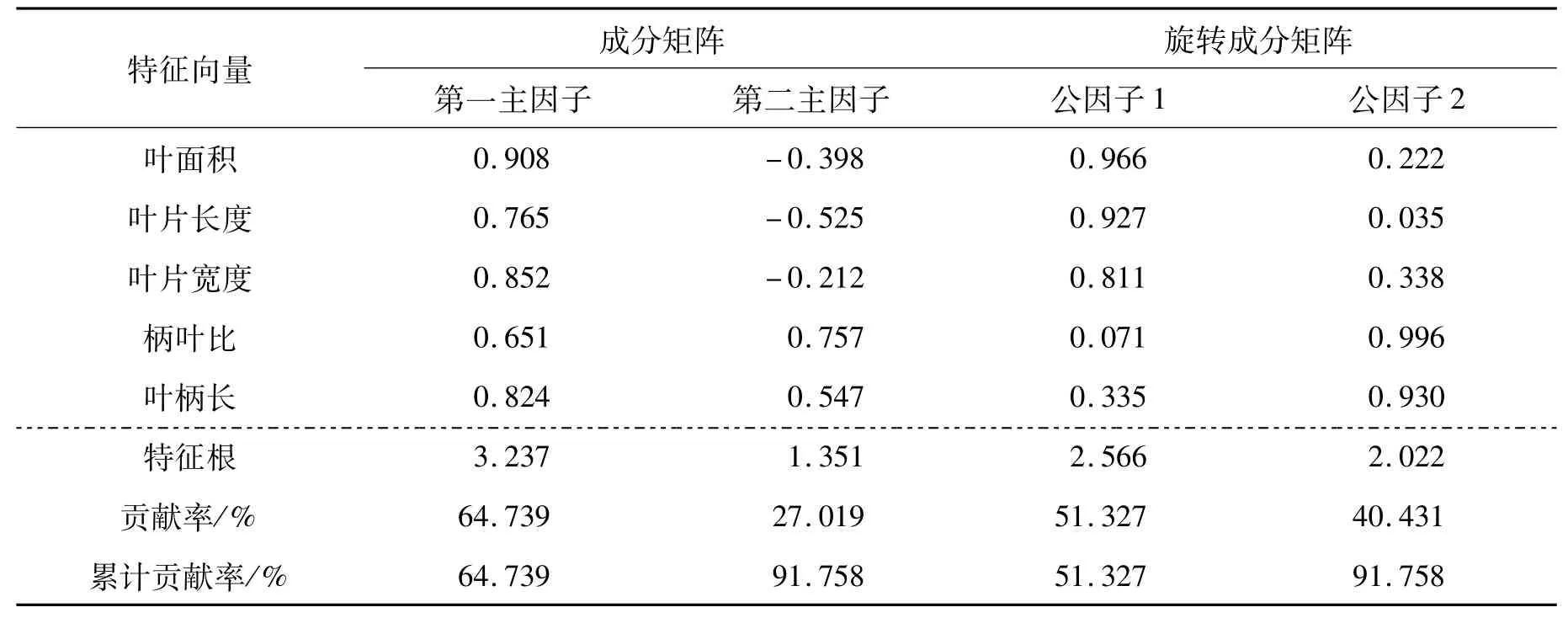
表3 叶形特征因子分析Tab.3 The factor analysis of leaf shape characteristics
2.3.2 毛状体性状因子分析
经主成分进一步分析,大麻毛状体相关性状可提取两个主因子,贡献率分别为73.691%和14.823%,累计贡献率为88.514%,说明这两个主因子可以对毛状体相关性状做出很好的解释。但腹面腺毛直径在两个主因子中的载荷量均较大,为了更好地定义因子并解释向量,将成分矩阵进行正交旋转,结果表明,腹面腺毛总数、腹面腺毛密度、腹面非腺毛总数、腹面非腺毛密度、背面腺毛总数、背面非腺毛总数、背面腺毛密度和背面非腺毛密度8个变量在公因子1上的载荷量较高,依次为0.949、0.944、0.938、0.934、0.930、0.898、0.892和0.873。这些变量均与毛状体数量相关,因此将公因子1命名为“毛状体数量因子”。公因子2中仅有背面腺毛直径和腹面腺毛直径两个变量,在公因子2上的载荷量分别为0.930和0.894,因此将其命名为“腺毛直径因子”。

表4 毛状体特征因子分析Tab.4 The factor analysis of trichome characteristics
2.4 叶柄乳汁管数与新因子间的相关性分析
将叶柄乳汁管数性状与之前因子分析提取的4个公因子变量进行相关性分析(详见表5)。结果显示叶柄乳汁管数与叶柄外形因子及毛状体数量因子均存在极显著的相关性,相关系数分别为0.697和0.721。而叶柄外形因子与毛状体数量因子彼此间的相关性也达到了极显著水平,相关系数0.771。叶片外形因子和腺毛直径因子与叶柄乳汁管数和其它两个公因子的相关性较弱。这表明可通过观察叶柄外形来估测叶柄乳汁管数和毛状体数量或通过统计毛状体数量来估测叶柄乳汁管数。但却无法通过观察叶片外形和腺毛直径来估测其它性状情况。

表5 叶柄乳汁管数与新因子间的相关性分析Tab.5 The correlation analysis between petiole laticifer number and new factors
3 讨论
植物形态特征除作为系统学及分类学研究[24]的依据外,在作物优良品种选育过程中也发挥着重要作用[15-17]。目前大麻低毒品种幼苗期主要保留目测长势较好且整齐的植株[20,25]。但此种筛选方式并不能有效地降低大麻低毒品种选育的周期。而现有研究结果表明,大麻酚类物质主要分布于大麻的腺毛及乳汁管中[20-23]。因此,了解腺毛及乳汁管数量与其它大麻形态学性状间的关系,可为大麻低毒品种选育过程中育种中间材料的筛选提供新的参考依据。
本研究结果显示腺毛数量相关性状和非腺毛数量有关的性状共同组成了毛状体数量因子。毛状体数量因子中腹面腺毛总数载荷量最大,为0.949,其次为腹面腺毛密度(0.944)、腹面非腺毛总数(0.938)和腹面非腺毛密度(0.934),这4个变量在毛状体数量因子中的载荷量较为接近。而这4个变量彼此间的相关系数均大于0.850。综合以上信息后,认为在实际生产过程中,观察这4个变量中任一变量,均可以在一定程度上反映其它3个变量的情况。再考虑到腺毛在叶上的总数和密度远不及非腺毛多(前者在叶片腹面的平均总数和密度分别为3154.76个和5.63个/mm2,后者则分别为31253.99个和56.81个/mm2),以及腹面非腺毛密度与所有腺毛数量相关性状的相关系数均大于0.860,从实用性角度出发,认为可通过观察腹面非腺毛密度这一性状来推测腺毛总数及密度的高低,并可由其来代表毛状体数量因子。
由表5可知,叶柄乳汁管数与叶柄外形因子及毛状体数量因子间均为极显著正相关,相关系数分别为0.697和0.721。认为可通过这两个因子来推测叶柄乳汁管数。而叶柄外形因子中柄叶比对公因子的贡献最大,其因子载荷量达到0.996,且与公因子中的另一个变量叶柄长的相关系数也达到了0.950,因此在生产中可直接用柄叶比代表叶柄外形因子使用。再结合之前提到的用腹面非腺毛密度来代表毛状体数量因子,最终认为,可通过观察大麻叶的柄叶比或腹面非腺毛密度来推测叶柄乳汁管数的高低。
根据表5的分析结果可知,叶片外形因子和腺毛直径因子与叶柄乳汁管数和毛状体数量间无较强的相关性,这意味着无法通过叶片外形和腺毛直径特征来反映乳汁管及毛状体的相关特征。
通过本次研究,最终筛选出两个较为容易观察的性状——柄叶比和叶腹面非腺毛密度。这两个性状可在一定程度上间接反映与大麻腺毛及叶柄乳汁管数量的多寡,为进一步研究大麻形态学特征与其所含大麻酚类物质含量间的关系提供了新的形态学依据。
参考文献:
[1]王德珠,陈建,李宏俊.大麻纤维及其应用[J].中国纤检,2012(5):81-83.
[2]中国科学院中国植物志.中国植物志,23卷,第一分册[M].北京:科学出版社,1998,223.
[3]旺堆,旦增旺扎,汪荀.简述大麻毒品的社会危害性及其利用GC/MS检验大麻成分的分析技术[J].西藏科技,2015(4):19-20.
[4]何锦风,杜军强,陈天鹏.汉麻叶的生物活性成分研究现状[J].中国食品学报,2011,11(8):133-140.
[5]Aizpurua-Olaizola O,Omar J,Navarro P,etal.Identification and quantification of cannabinoids in Cannabissativa L.plants by high performance liquid chromatography-mass spectrometry[J].Analytical and Bioanalytical Chemistry,2014,406(29):7549-7560.
[6]Benjamin D B,Kevin M,Verstraete A G,etal.Evolution of the content of THC and othermajor cannabinoids in drugmilype cannabis cuttings and seedlings during growth of plants[J].Journal of Forensic Sciences,2012,57(4):918-922.
[7]Elsohly M A,Slade D.Chemical constituents ofmarijuana:the complexmixture of natural cannabinoids[J].Life Sciences,2005,78(5):539-548.
[8]Salentijn EM J,Zhang Q,Amaducci S,et al.New developments in fiber hemp(Cannabis sativa L.)breeding[J].Industrial Crops&Products,2015,68(3):32-41.
[9]卢延旭,董鹏,崔晓光,等.工业大麻与毒品大麻的区别及其可利用价值[J].中国药理学通报,2007,23(8):1112-1114.
[10]宋宪友,李江,吴广文,等.低毒雌雄同株大麻新品种USO-31及高产栽培技术[J].中国麻业科学,2007(4):201-203.
[11]宋宪友,张利国,房郁妍,等.大麻新品种“龙大麻1号”的选育[J].中国麻业科学,2011,33(3):109-111.
[12]粟建光,陈基权,谢小美.大麻育种现状与前景[J].中国麻业科学,2006,28(4):212-217.
[13]翟晚枫,张春水,高利生.高效液相色谱检测大麻中△~9-四氢大麻酚的分析方法研究[J].分析测试学报,2012,31(11):1379-1384.
[14]崔广东.低毒工业大麻叶茎化学成分的分离以及抑菌活性物质的跟踪和筛选[D].兰州:兰州理工大学,2008.
[15]佟屏亚.从植株形态指标评价玉米育种方向[J].玉米科学,2006,14(6):1-3.
[16]陈亮.水稻根系育种的意义与前景[J].南方农业,2016,10(24):151-152.
[17]眭书祥,李爱国,朱青竹,等.黄河流域棉花形态育种探讨[J].河北农业科学,2012,16(7):75-77.
[18]郭媛,王玉富,邱财生,等.干旱胁迫对不同大麻品种生理特性和生长的影响研究初报[J].中国麻业科学,2011,33(5):235-239.
[19]郭鸿彦,胡学礼,陈裕,等.早熟籽用型工业大麻新品种云麻2号的选育[J].中国麻业科学,2009,31(5):285-287.
[20]Furr M,Mahlberg PG.Histochemical analyses of laticifers and glandular trichomes in Cannabis sativa[J].Journal of Natural Products,1981,44(2):153-159.
[21]Sirikantaramas S,Taura F,Tanaka Y,et al.Tetrahydrocannabinolic acid synthase,the enzyme controllingmarijuana psychoactivity,is secreted into the storage cavity of the glandular trichomes[J].Plant&Cell Physiology,2005,46(9):1578-82.
[22]陈璇,杨明,郭鸿彦.大麻植物中大麻素成分研究进展[J].植物学报,2011,46(2):197-205.
[23]Paul G.Mahlberg,Eun Soo Kim.Accumulation of Cannabinoids in Glandular Trichomes of Cannabis(Cannabaceae)[J].Journal of Industrial Hemp,2004,9(1):15-36.
[24]杨永红.大麻属植物分类研究史[J].中国麻业科学,2003,25(1):9-11.
[25]胡学礼,郭鸿彦,刘旭云,等.云南工业大麻品种在黑龙江大兴安岭地区的适应性研究[J].西南农业学报,2012,25(3):838-841.
