红麻酮脂酰辅酶A合成酶(KCS)酵母双杂交诱饵载体构建及自激活检测
2018-04-27张高阳邓接楼黄思齐李德芳
张高阳,邓接楼,黄思齐,李德芳*
(1.江西上饶师范学院生命科学学院,江西上饶334001;2.中国农业科学院麻类研究所,长沙410205)
酵母双杂交技术于1989年由Fields等最先应用,是一种有效的真核活细胞内研究蛋白质相互作用的技术平台,其试验过程中省去了蛋白质表达纯化及抗体制备的繁琐步骤,因其简便、快捷、高通量筛选,能够反映在正常生理状态下蛋白质的活性特征等优点被广泛应用于蛋白质相互作用方面的研究[1]。
红麻(Hibiscus cannabinus)为锦葵科木槿一年生草本韧皮纤维作物,富含大量优质天然纤维素,是目前世界上麻纺工业重要的原料[2]。β-酮脂酰-CoA合成酶(Ketoacyl coenzyme A synthetase,KCS)是植物体内超长链脂肪酸和表皮蜡质合成的关键酶,表皮蜡质是防止植物水分散失和抵御不良环境危害的重要屏障,对植物的生长发育及应对生物和非生物胁迫方面具有重要作用[3,4]。目前,有关KCS基因的研究主要集中在对其基因序列和功能的研究上,而对该基因的作用网络以及与体内蛋白和蛋白之间的相互作用研究目前尚未见报道。因此,本研究主要集中构建红麻酮脂酰辅酶A合成酶(KCS)酵母双杂交诱饵载体并检测该蛋白自激活活性,旨在为下一步利用酵母双杂交研究与酮脂酰辅酶A合成酶相互作用的蛋白奠定基础。
1 材料与方法
1.1 材料
菌株Mav103、DB3.1、pGBKT7质粒、salmon DNA购自美国biolab公司;筛选培养基SD/-Trp、SD/-Trp-His、SD/-Trp-His-Ura、X-Gal购自美国 Clontech公司;DNA限制内切酶、T4连接酶、Blue taq DNA聚合酶购自生工生物工程(上海)股份有限公司;引物由华大基因合成;其它试剂为国产分析纯。
1.2 方法
1.2.1 KCS基因片段获得及诱饵载体构建
提取红麻叶片RNA,采用AccuScript反转录试剂盒合成cDNA第一条链,根据基因和载体序列信息设计KCS基因扩增引物,上游引物5’-GAATTCTCCCCTCTGTCGTGCAAGACAATGC-3’;下游引物5’-GCGGCCGCCTAGAGCTTGACAACTTCGGGGATG-3’,以 cDNA为模板进行 PCR扩增,利用EcoRⅠ、NotⅠ酶分别对PCR产物和pGBKT7质粒进行酶切,PCR产物和酶切载体回收纯化后,利用T4连接酶进行连接反应,构建酵母诱饵表达载体pGBKT7-KCS。
1.2.2 酵母感受态细胞制备及载体转化
挑取单个Mav103酵母菌,接种于50 mL YPD培养基中,于30℃以250 r/min振荡培养16~18 h至A600nm在0.3~0.5之间。然后室温离心(4000 rpm/min)5 min收集酵母细胞,弃上清,加入50 mL无菌水重悬菌体,离心5 min,沉淀用1.5 mL 1 X TE/LiAc重悬,离心,再用600μL 1 X TE/LiAc重悬菌体,酵母感受态细胞置于冰上备用。操作之前准备PEG/LiAc溶液,以此加入诱饵载体3μL、Carrier DNA 4μL(20 mg/mL)、50μL酵母感受态细胞及0.6 mL PEG/LiAc溶液于1.5 mL离心管中,同时设置阴性对照质粒、阳性对照质粒,颠倒混匀后,置于30℃ 水浴30 min,每隔10 min颠倒混匀一次,30 min后加入20μL 100%DMSO溶液,混匀,于42℃热激15 min,每隔5 min混匀一次,冰浴5 min。于室温以3000 rpm/min离心5 min。弃上清,用1 mL YPD培养基重悬菌体,离心,弃上清,用0.5%NaCl重悬菌体,取50μL菌液涂布于相应营养缺陷平板上,于30℃倒置培养3~5 d。
1.2.3 诱饵表达载体pGBKT7-KCS自激活检测
待酵母培养3~5 d生长至3~5 mm时,用枪头挑取酵母放入1.5 mL离心管中,置于液氮中,然后取出于室温待其融化,反复5次,加入100μL无菌水作为模板,用PCR验证表达载体pGBKT7-KCS,验证正确的酵母转移至SD-Leu培养上,培养3~5 d后,用NC膜将菌体复印在膜上,将沾有酵母的NC膜放入液氮中,反复3次,放入X-Gal染液中于30℃培养,30 min后观察菌落的颜色变化。
2 结果与分析
2.1 KCS基因分离和诱饵载体构建
根据KCS基因序列设计PCR扩增引物(F:5’-GAATTCTCCCCTCTGTCGTGCAAGACAATGC-3’,R:5’-GCGGCCGCCTAGAGCTTGACAACTTCGGGGATG-3’),PCR扩增后用2%的凝胶电泳检测,结果显示有一条900 bp左右的条带(图1),经回收测序验证后,将PCR产物与载体双酶切连接,继而转化DB3.1细菌,提取质粒,用EcoRⅠ、NotⅠ酶对质粒酶切电泳后,发现一条与预期大小一致的片段(图1),表明载体构建正确,可用于下一步转化试验。
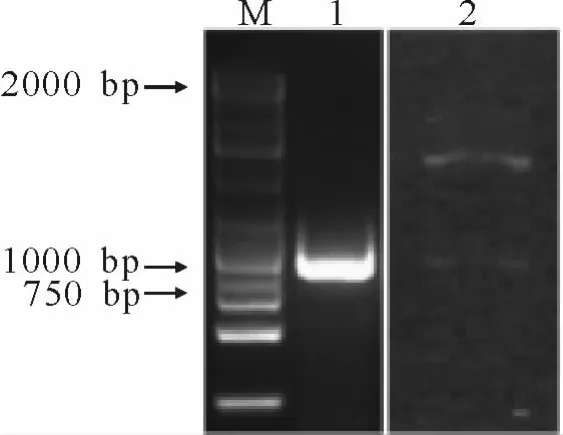
图1 KCS基因分离及酶切鉴定Fig.1 The isolation and enzyme digesting identification of KCSgene
2.2 转化酵母基因型鉴定
待缺陷培养基上长出酵母单克隆后,用无菌枪头挑取少量菌体于1.5 mL离心管中,以反复冻融后的菌体为模板,基因特异引物5’-CAATCGGACCGTTGGTTCTCCCGGC-3’和载体测序引物5’-GCAAAATTTTGGATTCTCAG-3’进行PCR扩增,结果显示,单克隆能扩增出一条800 bp左右的目的条带(图2)。
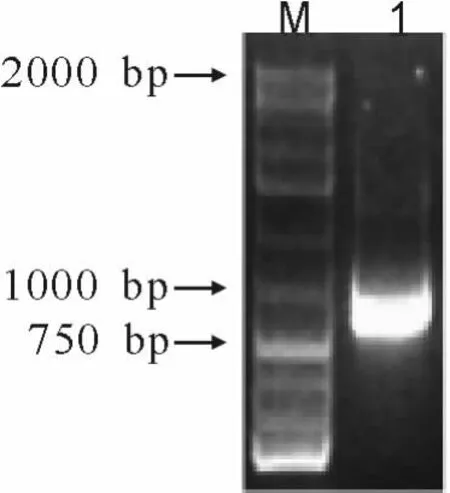
图2 转化酵母基因型鉴定Fig.2 The genotype detection of transformation yeast
2.3 酵母诱饵表达载体pGBKT7-KCS自激活检测
经验证正确的酵母单克隆转移至SD-Leu筛选培养基上,待3~5 d后酵母细胞长至3.5 mm时,将细胞转移至NC膜上,并置于液氮中反复冻融3次后放入预先备好的染色液中(Z buffer,10 mg/mL X-Gal),30 min后观察酵母细胞颜色变化情况。结果显示(见图3),酵母阳性克隆细胞由白色变为蓝色,说明KCS蛋白上游DNA Binding Domain可与GAL4转录因子的上游激活位点(UAS)结合,自动激活报告基因β-半乳糖苷酶表达,将KCS基因DNA Binding Domain删除后,KCS蛋白在酵母中不具有自激活,可用于后期酵母双杂交的诱饵蛋白研究与之相互作用的蛋白。
3 讨论
酵母双杂交系统是在真核模式生物酵母中研究活细胞内蛋白质之间相互作用的方法之一,具有很高灵敏度,可以检测到蛋白质之间微弱的、瞬间的相互作用。酵母双杂交技术不仅可以用来研究哺乳动物蛋白质之间的互作,还可以用来研究高等植物蛋白质之间的互作,因此,在目前生物学研究领域中被广泛应用[5]。KCS基因是超长链脂肪酸延伸过程中的关键酶,负责蜡质成分前体的合成,表皮蜡质与植物防止非气孔性失水、机械损伤、低温冻伤、病毒侵害、花粉与柱头的信号识别、植物形态发育与育性等都密切相关[6-10]。目前,有关红麻KCS蛋白在酵母中的研究还没有报道。本研究构建红麻β-ketoacyl-coa synthase基因诱饵载体,结果显示,该蛋白DNA binding区域能与酵母GAL4转录因子的上游激活位点(UAS)结合,自动激活下游报告基因的表达,把KCS基因DNA Binding Domain删除后,KCS蛋白在酵母中不具有自激活,因此,可用于后期酵母双杂交的诱饵蛋白研究与之相互作用的蛋白。
参考文献:
[1]Asseck L Y,Wallmeroth N,Grefen C.ER Membrane Protein Interactions Using the Split-Ubiquitin System(SUS)[J].2018,1691:191-203.
[2]张高阳,邓接楼,黄思齐,等.红麻S-腺苷甲硫氨酸脱羧酶基因克隆与序列分析[J].分子植物育种,2016,14(9):1-6.
[3]Guo H.S,Zhang Y.M,Sun X.Q,etal.Evolution of the KCSgene family in plants:the history ofgene duplication,sub/neofunctionalization and redundancy[J].Mol Genet Genomics,2016,291(2):739-52.
[4]Taylor DC,Francis T,Guo Y,et al.Molecular cloning and characterization of a KCSgene from Cardamine graeca and its heterologous expression in Brassica oilseeds to engineer high nervonic acid oils for potentialmedical and industrial use[J].Plant Biotechnol J,2009,7(9):925-38.
[5]Causier B,Davies B.Analysing protein-protein interactionswith the yeast two-hybrid system[J].Plant Molecular Biology,2002,50(6):855-70.
[6]Seo P.J,Park C.M.Cuticularwax biosynthesis as away of inducing drought resistance[J].Plant Signal Behav,2011,6(7):1043-10345.
[7]Weidenbach D,Jansen M,Bodewein T,et al.Shoot and root phenotyping of the barleymutant kcs6(3-ketoacyl-CoA synthase6)depleted in epicuticular waxes under water limitation[J].Plant Signal Behav,2015,10(4):1-3.
[8]Yu D,Ranathunge K,Huang H,et al.Wax Crystal-Sparse Leaf1 encodes a beta-ketoacyl CoA synthase involved in biosynthesis of cuticularwaxes on rice leaf[J].Planta,2008,228(4):675-85.
[9]李德芳,陈安国,李辉,等.红麻雄性两用不育系的发现和初步研究[J].中国麻业科学,2014,36(3):166-166.
[10]Saet Buyl Lee,SuJin Jung,Young Sam Go,et al.Two Arabidopsis3-ketoacyl CoA synthase genes,KCS20 and KCS2/DAISY,are functionally redundant in cuticularwax and root suberin biosynthesis,but differentially controlled by osmotic stress[J].The Plant Journal,2009,60(3):462-475.
