养殖大菱鲆感染迟缓爱德华氏菌的分离、毒力基因及ERIC-PCR分析
2018-04-26于新然姚洪叶仕根黎睿君李华李强
于新然, 姚洪, 叶仕根, 黎睿君, 李华, 李强
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁 大连 116023;2.盐城工学院 海洋与生物工程学院,江苏 盐城224051)
迟缓爱德华氏菌Edwardsiella tarda为革兰氏阴性细菌,隶属于肠杆菌科、爱德华菌属,是一种人畜共患菌,感染范围广泛,可引起大菱鲆Scophthalmus maximus、鳗鲡 Anguilla japonica、鲤 Cyprinus carpio等多种海水及淡水鱼类患病,是水产养殖动物主要病原菌之一[1-2]。该菌在大菱鲆养殖生产中危害尤为严重,大菱鲆感染迟缓爱德华氏菌可引起腹腔积水、充血,部分病鱼底板发红,同时,腹部两侧发生溃疡且溃疡边缘出血,剖检肝脏出现苍白囊肿等临床症状[3]。
辽宁省葫芦岛市是中国大菱鲆的主要养殖区,养殖产量占中国近60%,近年来,随着养殖规模的扩大和环境的恶化,鱼类疾病已成为制约葫芦岛市大菱鲆产业发展的主要因素,其中迟缓爱德华氏菌感染引起的腹水、白便症状尤为严重。笔者所在研究团队一年来对葫芦岛市养殖大菱鲆感染迟缓爱德华氏菌情况进行了调查,并对分离菌株的毒力进行了分析,同时,结合ERIC-PCR技术对分离菌株进行了指纹图谱分析,以期为研究迟缓爱德华氏菌积累资料,并为葫芦岛市养殖大菱鲆迟缓爱德华氏菌感染的防控提供依据。
1 材料与方法
1.1 材料
患病大菱鲆取自葫芦岛兴城市4家养殖场和绥中县5家养殖场,体长为10~20 cm,主要症状为腹水、白便、肠炎和红底板。采样时间为2014年1月—2015年4月,每月定期采样,共获得135尾病鱼。
迟缓爱德华氏菌参考菌株 (ATCC15947)和灿烂弧菌 (2CLM002)由大连海洋大学海珍品疾病防控重点实验室提供。
1.2 方法
1.2.1 细菌分离 无菌条件下,取病鱼肝、脾、肾和心等部位,以平板划线分离法划线接种于胰蛋白胨大豆琼脂培养基上,28℃下培养24~48 h,挑选优势菌进行纯化。
1.2.2 细菌鉴定 选用迟缓爱德华氏菌特异性引物对分离菌株进行PCR扩增,阳性菌株保存备用。正、反向引物[4]分别为

PCR 反应体系 (25 μL):10×PCR buffer(含Mg2+)2.5 μL, dNTP Mix 2 μL, 正、 反向引物 (10 pmol/μL) 各 0.5 μL, 模板 (40 ~ 80 ng)1 μL,Taq DNA Polymerase(BBI)0.125 μL, 用 ddH2O补足至 25 μL。
反应程序为:94℃下预变性5 min;94℃下循环变性30 s,63℃下退火20 s,72℃下延伸20 s,共进行30个循环;最后在72℃下再延伸10 min。
1.2.3 毒力分析
(1)毒力基因检测。选取迟缓爱德华氏菌的4个主要毒力基因,包括 esaV、katB、fimA、gadB,对迟缓爱德华氏菌分离株进行毒力分析。PCR反应体系 (25 μL):10×PCR buffer(含 Mg2+)2.5 μL, dNTP Mix 2 μL, 正、 反向引物 (10 pmol/μL)各 0.5 μL, 模板 (40~80 ng)1 μL, Taq DNA Polymerase(BBI)0.125 μL, 用 ddH2O 补足至 25 μL。引物序列设计和条件参照张晓君等[5]、李杰[6]的研究,见表1。
毒力基因检测PCR反应程序为:94℃下预变性5 min;94℃下循环变性30 s,72℃下延伸1 min,共进行30个循环;最后在72℃下再延伸10 min。fimA、gadB基因在55℃下退火1 min。esav、katB基因在56℃下退火和延伸30 s,72℃下再延伸40 s。PCR产物经10 g/L琼脂糖凝胶电泳进行拍照和判定。
(2)人工感染试验。选取健康大菱鲆 (体长为10 cm,体质量为30 g),在规格为60 cm×40 cm×30 cm的水槽中暂养7 d,养殖用水为大连市黑石礁海域沙滤海水,养殖期间盐度为30,水温为15~16℃,24 h不间断充氧。试验前将鱼随机分为23组,每组15尾鱼。选取22株迟缓爱德华氏菌分离株,活化培养后制成菌浓度为1.0×108cell/mL的菌悬液,对鱼进行腹腔注射,每尾注射0.2 mL,对照组注射等量生理盐水。连续观察14 d,每天换水并记录鱼的死亡情况。
1.2.4 ERIC-PCR分型 ERIC-PCR引物参照Maiti等[7]的设计。正、反向引物分别为

PCR 反应体系 (25 μL):10×PCR buffer(含Mg2+)2.5 μL, dNTP Mix 2 μL, 正、 反向引物(10 pmol/μL) 各 1 μL, 模板 (40~80 ng)2 μL,Taq DNA Polymerase(BBI)0.125 μL, 用 ddH2O补足至25 μL。PCR反应程序为:94℃下预变性7 min;94℃下循环变性30 s,52℃下退火复性1 min,65℃下延伸8 min,共进行40个循环;最后在65℃下再延伸16 min。
2 结果与分析
2.1 细菌分离与鉴定结果
从135尾患病大菱鲆中共分离获得98株优势菌,选用迟缓爱德华氏菌特异性引物对分离菌株进行PCR扩增,共鉴定出22株迟缓爱德华氏菌 (图1)。
2.2 毒力基因检测
采用4种毒力基因的特异性引物对22株迟缓爱德华氏菌进行PCR扩增,结果表明,22株分离株在目的条带处均出现清晰条带 (图2)。22株迟缓爱德华氏菌4种毒力基因的携带率均为100%,毒力基因型为 esaV+fimA+gadB+katB+。
2.3 人工感染试验结果
22株迟缓爱德华氏菌人工感染试验结果 (表2)显示,感染组第2天出现死亡,第3天出现死亡高峰,5 d内致死率均为100%,菌株毒力较强。感染大菱鲆临床症状主要以红底板为主,伴有红嘴,鳍基部充血发红。剖检发现,肝脏苍白,肠道红肿并出现不同程度充血,腹腔内充斥少量淡红色或浅黄色黏液。

图1 22株迟缓爱德华氏菌分离株特异性引物鉴定结果Fig.1 Identification of 22 isolates by PCR with the specific primers of Edwardsiella tarda
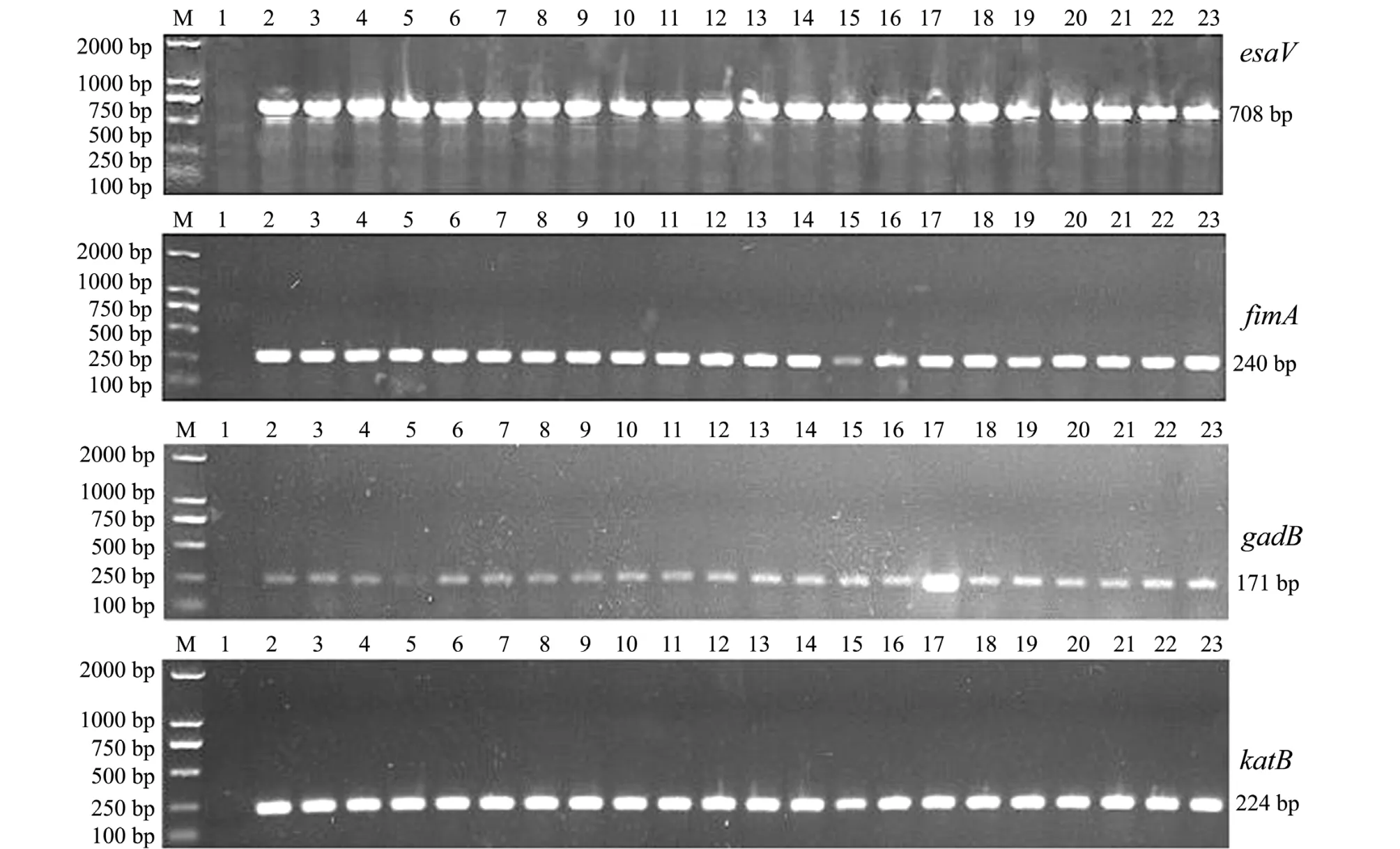
图2 22株迟缓爱德华氏菌分离株毒力基因esaV、fimA、gadB、katB的PCR扩增结果Fig.2 The PCR amplification product of virulence genes esaV,fimA,gadB,and katB in 22 isolates of Edwardsiella tarda
2.4 ERIC-PCR 分型
迟缓爱德华氏菌分离株和参考株ATCC15947经ERIC-PCR扩增,PCR产物为6~17条,主带4~8条,大小介于100~2000 bp(图3)。经聚类分析,22株迟缓爱德华氏菌与ATCC15947株可分为2个基因型,分别标记为Ⅰ和Ⅱ型 (图4)。其中葫芦岛市22株迟缓爱德华氏菌分离株呈现相似的聚类特征,均为Ⅱ型,与ATCC15947株为Ⅰ型明显不同。根据 Hunter等[8]的计算方法,该分型方法的辨别指数值为87%。
3 讨论
本研究中对辽宁省葫芦岛市养殖大菱鲆迟缓爱德华氏菌感染情况进行了调查,结果发现,葫芦岛市大菱鲆感染迟缓爱德华氏菌后呈现高发病率和高死亡率,一年四季均有感染,其中,8、9月份高水温期病情有加重的趋势。患病大菱鲆中共分离获
得了89株优势菌,其中22株被鉴定为迟缓爱德华氏菌,说明迟缓爱德华氏菌是葫芦岛地区养殖大菱鲆的主要病原菌之一。
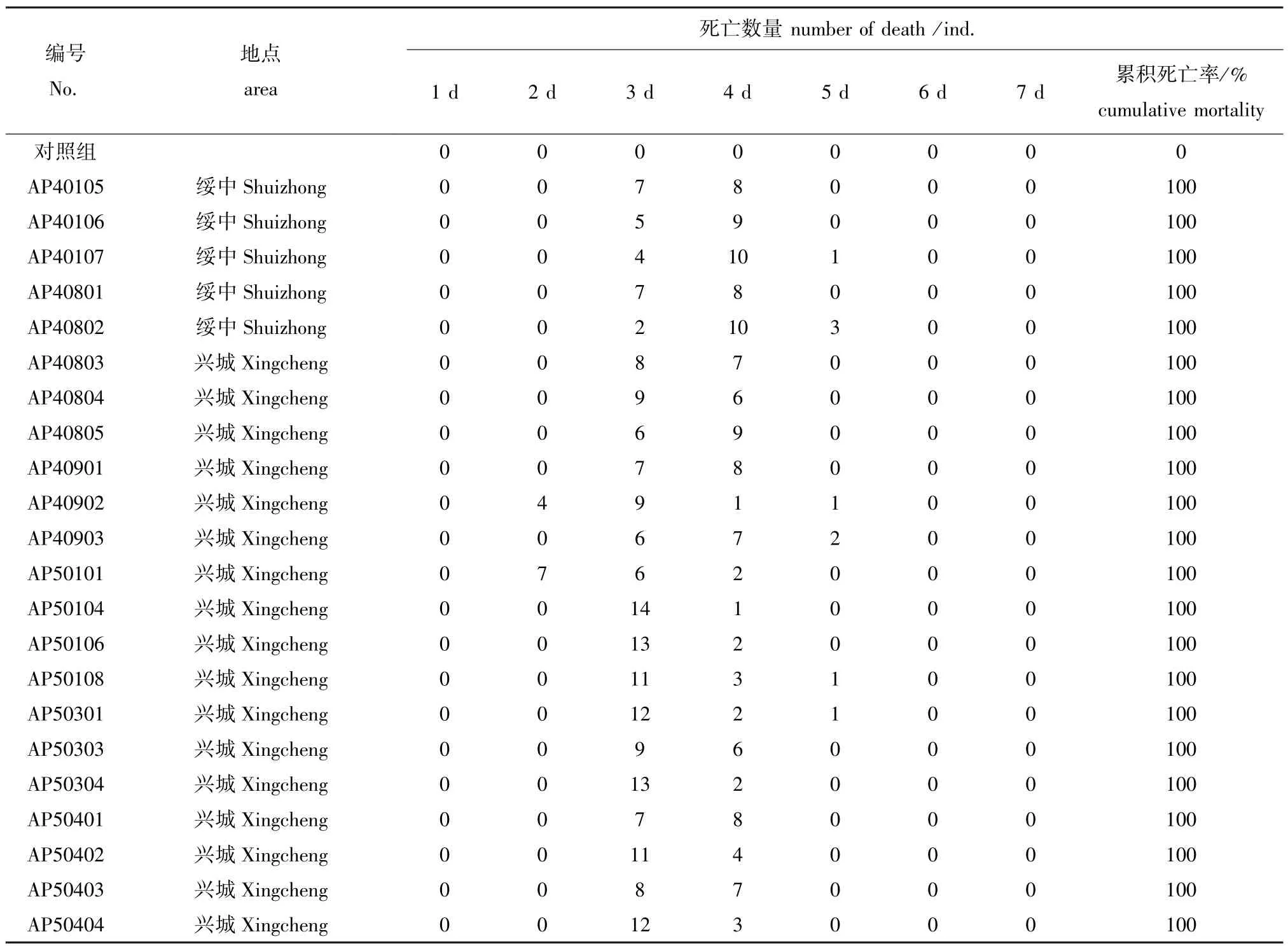
表2 迟缓爱德华氏菌分离株人工感染试验结果Tab.2 Results of challenge tests by Edwardsiella tarda isolates

图3 迟缓爱德华氏菌分离株的ERIC-PCR指纹图Fig.3 ERIC-PCR fingerprint of Edwardsiella tarda isolates
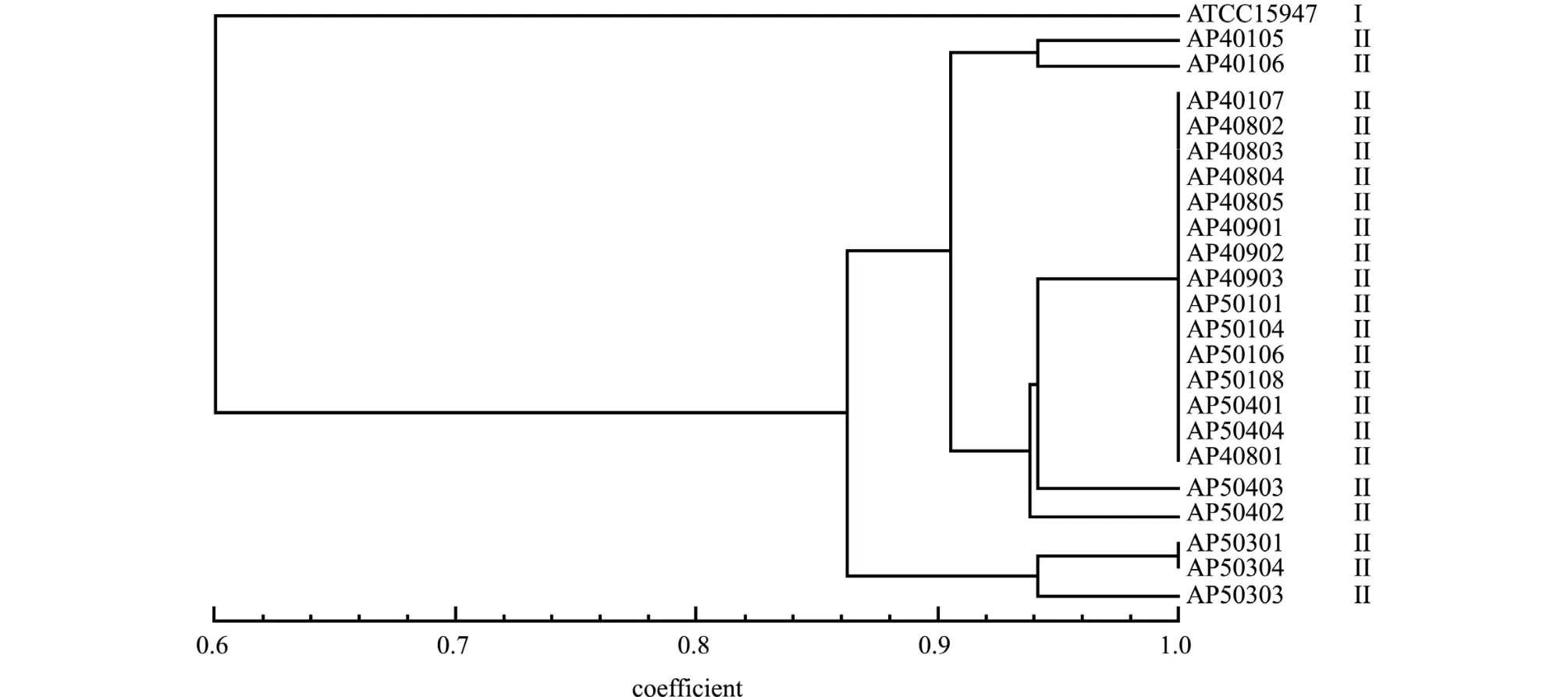
图4 迟缓爱德华氏菌分离株指纹图谱聚类分析图Fig.4 Fingerprint clustering analysis diagram of Edwardsiella tarda isolates
大菱鲆对迟缓爱德华氏菌的易感性较高,不同月龄大菱鲆均能感染迟缓爱德华氏菌,无明显季节性,且感染率和致死率均较高[9-11]。此外,大菱鲆感染迟缓爱德华氏菌临床症状表现复杂化,它可引起体表出血、肝肾溃疡、腹部鼓胀且有腹水,肛门直肠脱出体外,急性感染时无明显症状等[12-13]。王波等[3]研究发现,大菱鲆感染迟缓爱德华氏菌主要表现为腹腔积水、充血,部分病鱼底板发红,同时腹部两侧发生溃疡且溃疡边缘出血,剖检肝脏出现苍白、囊肿等临床症状,这些症状与此次调查结果一致。
通过对22株迟缓爱德华氏菌分离株毒力基因进行特异性扩增,结果显示,22株分离株均含有esaV、katB、fimA和gadB基因。现已报道迟缓爱德华氏菌存在14种毒力基因,其中,esaV和katB为迟缓爱德华氏菌主要毒力基因,esaV编码迟缓爱德华氏菌的Ⅲ型分泌系统装置蛋白,katB帮助迟缓爱德华氏菌抵御巨噬细胞的氧呼吸爆发,并在细胞中大量生殖导致巨噬细胞生成NO和肿瘤坏死因子[14-18]。江云等[19]通过检测4株迟缓爱德华氏菌发现,fimA和gadB仅能在致病性迟缓爱德华氏菌菌株中检测到。fimA拥有黏附、侵染机体细胞的能力[20];gadB赋予迟缓爱德华氏菌在细胞内生存的能力,并突破机体的免疫保护屏障[21-22]。人工感染试验结果表明,分离到的22株迟缓爱德华氏菌均具有较强的致病性,均可引起养殖大菱鲆死亡,这与上述毒力基因在致病株的检测报道结果吻合。
ERIC-PCR结果显示,从葫芦岛市分离到的22株迟缓爱德华氏菌能扩增出6~17条带,均为一种基因型,说明该地区迟缓爱德华氏菌菌株有聚类趋势,Acharya等[23]对整个养殖池塘中分离到的27株迟缓爱德华氏菌进行ERIC-PCR基因分析,结果显示有5个基因型,这可能由于迟缓爱德华氏菌在不同环境如水体、底泥,以及不同水生动物体表与体内生长繁殖的差异导致。Abayneh等[24]通过MLSA方法对采集于欧洲、亚洲的分离菌株及标准菌株进行种内分析发现,迟缓爱德华氏菌存在明显的地域特征。本试验中发现,该地区分离到的22株迟缓爱德华氏菌仅存在一种ERIC-PCR基因型,可见该基因型的迟缓爱德华氏菌是葫芦岛市养殖大菱鲆的主要致病菌株,这也为将来研制针对该病的疫苗提供了理论基础。
参考文献:
[1] 秦蕾,王印庚,张晓君.迟钝爱德华氏菌感染大菱鲆的病理学研究[J].中国水产科学,2009,16(3):411-419.
[2] Alcaide E,Herraiz S,Esteve C.Occurrence of Edwardsiella tarda in wild European eels Anguilla anguilla from Mediterranean Spain[J].Diseases of Aquatic Organisms,2006,73(1):77-81.
[3] 王波,莫照兰.迟缓爱德华氏菌及其致病机理[J].海洋科学集刊,2007(48):133-139.
[4] 荣小军,廖梅杰,张正,等.迟缓爱德华氏菌SYBR Green I实时荧光定量PCR检测方法的建立及其应用[J].水产学报,2013,37(12):1829-1838.
[5] 张晓君,白雪松,毕可然,等.病原迟钝爱德华菌毒力基因及双重PCR与LAMP检测方法的建立[J].水产学报,2013,37(7):1087-1094.
[6] 李杰.致病性迟缓爱德华氏菌的鉴定、PCR检测及esaC基因的功能鉴定[D].青岛:中国海洋大学,2008:1-55.
[7] Maiti B,Raghunath P,Karunasagar I,et al.Typing of clinical and environmental strains of Aeromonas spp.using two PCR based methods and whole cell protein analysis[J].Journal of Microbiological Methods,2009,78(3):312-318.
[8] Hunter P R,Gaston M A.Numerical index of the discriminatory ability of typing systems:an application of Simpson's index of diversity[J].Journal of Clinical Microbiology,1988,26(11):2465-2466.
[9] 王斌,孙岑,范薇,等.养殖大菱鲆出血性败血症病原菌致病性的研究及鉴定[J].大连水产学院学报,2006,21(2):100-104.
[10] 王亚婷,李晓玥,赵宝华.鱼类迟钝爱德华菌病诊断与防治研究进展[J].动物医学进展,2009,30(3):77-81.
[11] 李筠,颜显辉,陈吉祥,等.养殖大菱鲆腹水病病原的研究[J].中国海洋大学学报,2006,36(4):649-654.
[12] Choi H S.Study on Edwardsiella tarda isolated from cultured bastard halibut(Paralichthys olivaceus)[J].Bulletin of National Fisheries Research and Development Agency(Korea).Yangsan,1991(45):197-205.
[13] Mohanty B R,Sahoo P K.Edwardsiellosis in fish:a brief review[J].Journal of Biosciences,2007,32(S3):1331-1344.
[14] 朱文进,陈翠珍,苏咏梅,等.牙鲆致病性迟钝爱德华菌毒力基因的检测及序列分析[J].动物医学进展,2014,35(11):20-24.
[15] Rao P S S,Lim T M,Leung K Y.Functional genomics approach to the identification of virulence genes involved in Edwardsiella tarda pathogenesis[J].Infection and Immunity,2003,71(3):1343-1351.
[16] Wang Xin,Wang Qiyao,Xiao Jingfan,et al.Edwardsiella tarda T6SS component evpP is regulated by esrB and iron,and plays essential roles in the invasion of fish[J].Fish&Shellfish Immunology,2009,27(3):469-477.
[17] Rao P S S,Lim T M,Leung K Y.Opsonized virulent Edwardsiella tarda strains are able to adhere to and survive and replicate within fish phagocytes but fail to stimulate reactive oxygen intermediates[J].Infection and Immunity,2001,69(9):5689-5697.
[18] Ishibe K,Osatomi K,Hara K,et al.Comparison of the responses of peritoneal macrophages from Japanese flounder(Paralichthys olivaceus)against high virulent and low virulent strains of Edwardsiella tarda[J].Fish & Shellfish Immunology,2008,24(2):243-251.
[19] 江云,李寿崧,王寿昆,等.致病性迟钝爱德华氏菌毒力基因的PCR 检测[J].中国食品学报,2008,8(4):123-129.
[20] Sakai T,Kanai K,Osatomi K,et al.Identification of a 19.3-kDa protein in MRHA-positive Edwardsiella tarda:putative fimbrial major subunit[J].FEMS Microbiology Letters,2003,226(1):127-133.
[21] Liu Ying,Oshima S I,Kurohara K,et al.Vaccine efficacy of recombinant GAPDH of Edwardsiella tarda against Edwardsiellosis[J].Microbiology and Immunology,2005,49(7):605-612.
[22] 李墨非.海水鱼类病原菌迟缓爱德华氏菌和海豚链球菌的致病机制[D].青岛:中国科学院研究生院(海洋研究所),2015.
[23] Acharya M,Maiti N K,Mohanty S,et al.Genotyping of Edwardsiella tarda isolated from freshwater fish culture system[J].Comparative Immunology,Microbiology and Infectious Diseases,2007,30(1):33-40.
[24] Abayneh T,Colquhoun D J,Sørum H.Multi-locus sequence analysis(MLSA)of Edwardsiella tarda isolates from fish[J].Veterinary Microbiology,2012,158(3-4):367-375.
