4种壳色菲律宾蛤仔在低氧胁迫下的耐受能力比较研究
2018-04-26王化敏丁鉴锋杨东敏牟政强霍忠明闫喜武包琳
王化敏, 丁鉴锋、2, 杨东敏, 牟政强, 霍忠明、2, 闫喜武、2, 包琳
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023)
菲律宾蛤仔Ruditapes philippinarum隶属于软体动物门、帘蛤目、帘蛤科、蛤仔属,是世界性养殖贝类,具有生长迅速、养殖周期短、适应性强的特点,是中国四大养殖贝类之一。菲律宾蛤仔主要栖息于内湾、河口和沿海滩涂等生存条件经常发生较大变化的区域,温度、盐度和水中溶解氧的变化能够对其代谢、免疫和生长等造成影响,环境胁迫所导致的贝类对病原的抵抗力下降是诱发贝类大规模死亡的一个重要原因[1-2]。水中氧气的含量是影响水生动物生长发育的重要因子之一[3]。溶氧降低对贝类的生长和生存等具有重要的影响,低氧能够引起波罗地海蛤Macoma balthica潜沙行为异常[4];绿唇鲍 Haliotis laevigata Donovan在低氧条件下生长速度和耗氧率均显著降低[5];水中溶氧降低能够导致美洲牡蛎Crassostrea virginica幼虫附着率显著降低,死亡率也较正常氧气条件下有所升高[6],附着后牡蛎幼虫在低氧条件下摄食率降低,生长速度减慢[7];杂色鲍Haliotis diversicolor supertexta氨基酸平衡和无氧代谢过程在溶氧含量降低时发生紊乱[8];沟纹蛤仔Ruditapes decussatus在低氧海水中的清除率、摄食率和排泄率均降低,并导致其能量代谢率也随之降低[9];干露造成的低氧胁迫导致四角蛤蜊Mactra veneriformis血淋巴细胞总数、血细胞吞噬能力、溶菌酶和酚氧化酶活性等免疫指标降低[10];低氧条件下翡翠贻贝Perna viridis血淋巴中的血细胞数和吞噬活性也显著低于正常溶氧组[11];长期处于低氧环境中,菲律宾蛤仔的组织结构异常,活力下降[12]。低氧通常是指海水中溶解氧浓度低于2 mg/L[13]。双壳贝类对低氧的适应可以通过提高呼吸强度以更有效地从水中获取氧气,或者通过减少体内有氧代谢而增加无氧代谢过程以降低氧气消耗[9]。低氧胁迫所导致的贝类免疫能力降低是导致贝类死亡的重要原因之一[10,14]。因此,了解贝类对低氧的耐受机制具有重要意义。
研究表明,不同壳色菲律宾蛤仔在耐受性、抗逆性和生长速率等方面表现出显著差异,并且能稳定遗传给下一代[15-17]。在对贝类相关的转录组研究中发现,不同壳色贝类差异表达基因主要分布在色素合成、生长、免疫和生物矿化等相关信号通路,色素形成信号通路主要集中在黑色素合成途径[18-20]。本课题组对不同壳色菲律宾蛤仔转录组数据分析发现:不同壳色蛤仔之间存在许多表达量显著差异的基因,其中包括抗氧化酶家族基因如硫氧化还蛋白过氧化物酶 (TPx)、过氧化氢酶(CAT)、锰超氧化物歧化酶 (Mn-SOD)、铜锌超氧化物歧化酶 (Cu/Zn-SOD),以及热休克蛋白家族基因HSP40、HSP75和小热休克蛋白家族HSP22家族成员VpsHSP-1、VpsHSP-2等。抗氧化酶和热休克蛋白家族成员在贝类对温度、盐度、低氧和环境污染物等胁迫的反应过程中发挥重要作用[21-24],不同壳色菲律宾蛤仔所表现出的抗逆性差异可能与这些基因在不同壳色蛤仔中的表达量变化有关。因此,以不同壳色菲律宾蛤仔为研究对象,探讨其在低氧条件下体内抗氧化酶和热休克蛋白家族成员基因的表达规律,以期对不同壳色蛤仔低氧耐受差异的机制进行探讨。
1 材料与方法
1.1 材料
试验用菲律宾蛤仔 (以下简称为蛤仔)采自辽宁省盘锦市,为实验室繁育培养的蛤仔 (斑马蛤、白蛤、白斑马蛤)和采集的野生蛤仔,壳长为 (2.0±0.5)cm。
1.2 方法
1.2.1 试验设计 挑选壳型完整且活力强的蛤仔,在50 L水体的平底塑料槽中暂养一周,水温为(18±0.5)℃,盐度为32,溶解氧为 (7.5±0.05)mg/L,每天换水一次,并投喂螺旋藻粉,持续充氧。
正式试验时,从每种壳色蛤仔中随机挑选24枚放置于塑料桶中,每种壳色蛤仔设置3个重复组,充入氮气,当氧气浓度为(1.00±0.05)mg/L时停止,用保鲜膜对桶进行密封处理。处理0、6、12、24 h时分别取蛤仔的鳃和外套膜组织,每个时间点随机取5枚 (各50~100 mg),迅速放入液氮中速冻后于超低温冰箱 (-80℃)中保存备用。1.2.2 蛤仔总RNA提取及cDNA合成 按天根公司动物组织总RNA抽提试剂盒说明书上的方法提取总RNA,产物用15 g/L琼脂糖电泳检测其完整性,并置于核酸分析仪 (Thermo Nanodrop2000c)下检测A260nm/A280nm值。用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)反转录试剂盒对提取的RNA进行反转录,获得相应的cDNA。
1.2.3 引物设计 根据已获得的蛤仔抗氧化酶基因家族和热休克蛋白 (HSPs)基因家族的cDNA序列,用Primer Premier 5.0软件设计实时荧光定量PCR引物 (表1)。所用引物均由生工生物工程(上海)股份有限公司合成。
1.2.4 蛤仔抗氧化酶基因家族和热休克蛋白基因家族实时荧光定量PCR表达分析 以Rp-tubulin为内参基因,分析抗氧化酶基因家族和热休克蛋白基因家族在低氧条件下的表达特征。试验所用的cDNA模板根据所测浓度,按统一标准稀释至一定浓度。
PCR扩增反应体系 (20 μL):SYBR®Premix Ex TaqTMII(TaKaRa)10 μL, cDNA 2.0 μL, 上、下游引物各 0.8 μL,用 ddH2O补足至 20 μL。采用两步法进行扩增:95℃下预变性30 s;95℃下变性5 s,60℃复性30 s,共40个循环。溶解曲线制备反应条件:95℃变性5 s,60℃复性1 min,60~95℃以0.11℃/s的速度升温,每度采集5个荧光信号;50℃下降温30 s。每个反应设置3个重复孔,以消除试验误差。
1.3 数据处理
采用2-ΔΔCt法计算4种壳色蛤仔鳃和外套膜组织中抗氧化酶基因和HSPs基因在低氧胁迫下相对表达量的变化。以野生蛤仔为对照组,其他3种壳色蛤仔抗氧化酶基因和HSPs基因的平均标准化表达量均用对照组0 h未处理的表达量校准。

表1 荧光定量PCR分析基因表达所用引物序列Tab.1 Sequences of primers used in RT-qPCR
采用SPSS 20.0软件分析试验结果,试验数据均以平均值±标准差 (mean±S.D.)表示,采用单因素方差分析法进行显著性检验,用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 低氧胁迫下4种壳色蛤仔外套膜组织中抗氧化酶家族基因的表达量分析
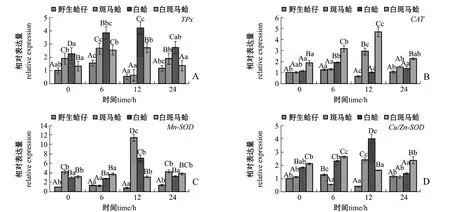
图1 低氧胁迫下4种壳色蛤仔外套膜组织中抗氧化酶家族基因的相对表达量Fig.1 Relative expression levels of antioxidant gene family in the mantle of Manila clam Ruditapes philippinarum with four shell-colors exposed to the hypoxia
低氧胁迫下,不同壳色蛤仔外套膜中抗氧化酶家族基因的表达结果如图1所示。从图1可见:随着低氧胁迫时间的延长,4种壳色蛤仔TPx表达量均表现出先升高后恢复的趋势,其中野生蛤仔和斑马蛤TPx表达量均在胁迫6 h时达到最高值 (P<0.05),白蛤和白斑马蛤TPx表达量均在胁迫12 h时达到最高值 (P<0.05);白蛤TPx表达量在不同时间点均显著高于其他3种壳色蛤仔 (P<0.05)(图1-A)。4种壳色蛤仔CAT表达量随着低氧胁迫时间的延长均呈先升高后降低的趋势,野生蛤仔和白蛤CAT表达量均在胁迫6 h时达到最高值(P<0.05),斑马蛤和白斑马蛤CAT表达量在胁迫12 h时达到最高值 (P<0.05);白斑马蛤CAT表达量均在不同时间点均显著高于其他3种壳色蛤仔(P<0.05)(图1-B)。 4种壳色蛤仔Mn-SOD表达量随着低氧胁迫时间的延长均呈先升高后降低的趋势,野生蛤仔和白斑马蛤Mn-SOD表达量均在胁迫6 h时到最高值 (P<0.05),斑马蛤和白蛤表达量均在胁迫12 h时达到最高值 (P<0.05)(图1-C)。4种壳色蛤仔Cu-ZnSOD表达量随着低氧胁迫时间的延长均呈先升高后恢复的趋势,野生蛤仔和白斑马蛤的Cu-ZnSOD表达量均在胁迫6 h时达到最高值 (P<0.05),斑马蛤和白蛤Cu-ZnSOD表达量均在胁迫 12 h时达到最高值 (P<0.05)(图 1-D)。
2.2 低氧胁迫下4种壳色蛤仔鳃组织中抗氧化酶家族基因的表达量分析
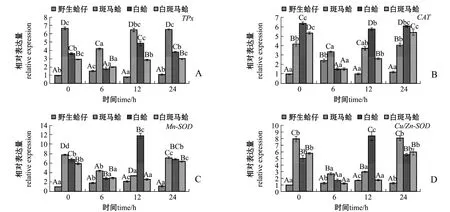
图2 低氧胁迫下4种壳色蛤仔鳃组织中抗氧化酶家族基因的相对表达量Fig.2 Relative expression levels of antioxidant gene family in the gill of Manila clam Ruditapes philippinarum with four shell-colors exposed to the hypoxia
低氧胁迫下,不同壳色蛤仔鳃中抗氧化酶家族基因的表达结果如图2所示。从图2可见:随着低氧胁迫时间的延长,野生蛤仔TPx表达量均呈先升高后恢复的趋势,在胁迫6 h时达到最高值(P<0.05);斑马蛤、白蛤和白斑马蛤受到胁迫后TPx表达量呈先下降后恢复的趋势,均在6 h时达到最低值 (P<0.05),斑马蛤TPx基因表达量在不同时间点均显著高于其他3种壳色蛤仔 (P<0.05)(图2-A)。野生蛤仔CAT表达量随着低氧胁迫时间的延长呈先升高后恢复的趋势,在胁迫6 h时达到最高值 (P<0.05);而其他3种壳色蛤仔CAT表达量呈先降低后恢复的趋势,均在胁迫6 h时达到最低值 (P<0.05) (图2-B)。野生蛤仔 Mn-SOD基因表达量随着低氧胁迫时间的延长出现先升高后恢复的过程,在胁迫12 h时达到最高值(P<0.05);其他3种壳色蛤仔Mn-SOD表达量呈先降低后升高的趋势,白蛤在胁迫6 h时、斑马蛤和白斑马蛤在胁迫12 h时表达量均达到最低值(P<0.05)(图 2-C)。 野生蛤仔 Cu-ZnSOD 表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,在胁迫12 h时表达量达到最高值 (P<0.05);其他3种壳色蛤仔表达量呈先降低后恢复的趋势,均在胁迫6 h时表达量达到最低值 (P<0.05)(图2-D)。
2.3 低氧胁迫下4种壳色蛤仔外套膜组织中热休克蛋白家族基因的表达量分析
低氧胁迫下,不同壳色蛤仔外套膜中热休克蛋白家族基因的表达结果如图3所示。从图3可见:随着低氧胁迫时间的延长,野生蛤仔、斑马蛤和白斑马蛤HSP40表达量均呈先升高后降低的趋势,斑马蛤在胁迫12 h时、野生蛤仔和白蛤胁迫6 h时HSP40表达量均达到最高值 (P<0.05);白斑马蛤HSP40表达量呈先降低后升高的趋势,在胁迫6 h时表达量达到最低值 (P<0.05)(图3-A)。野生蛤仔、斑马蛤和白斑马蛤HSP75表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,斑马蛤在胁迫12 h时、野生蛤仔和白蛤在胁迫6 h时HSP75表达量均达到最高值 (P<0.05);白斑马蛤HSP75表达量呈先降低后升高的趋势,在胁迫6 h时表达量达到最低值 (P<0.05) (图3-B)。野生蛤仔、斑马蛤和白斑马蛤VpsHSP-1表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,斑马蛤在胁迫12 h时、野生蛤仔和白蛤在胁迫6 h时表达量达到最高值 (P<0.05);白斑马蛤VpsHSP-1表达量呈先降低后升高的趋势,在胁迫6 h时表达量达到最低值 (P<0.05)(图3-C)。野生蛤仔、斑马蛤和白斑马蛤VpsHSP-2表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,斑马蛤在胁迫12 h时、野生蛤仔和白蛤在胁迫6 h时表达量均达到最高值(P<0.05);白斑马蛤VpsHSP-2表达量随着低氧胁迫时间的延长呈先降低后升高的趋势,在胁迫6 h时表达量达到最低值 (P<0.05)(图3-D)。
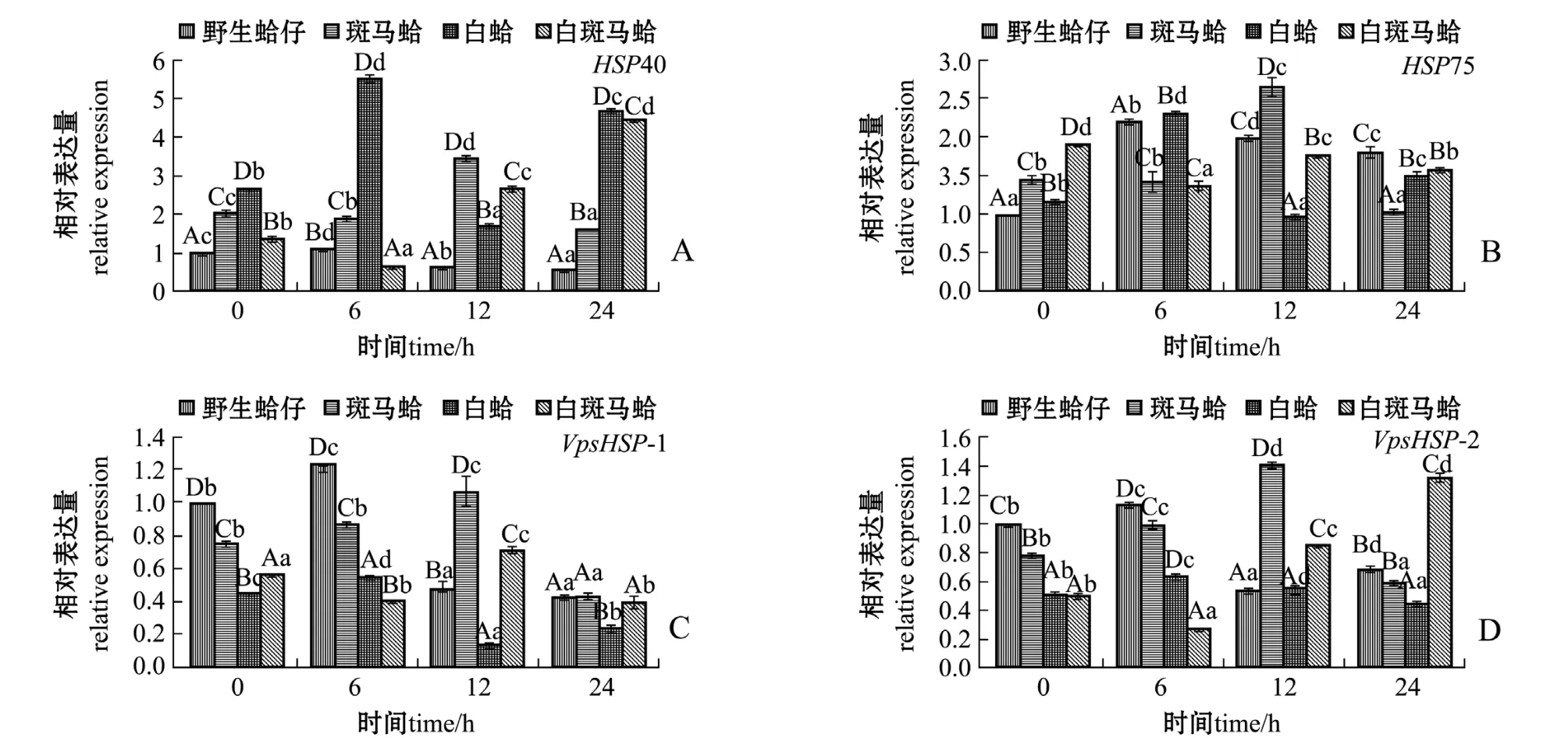
图3 低氧胁迫下4种壳色蛤仔外套膜组织中热休克蛋白家族基因的相对表达量Fig.3 Relative expression levels of heat shock protein gene family in the mantle of Manila clam Ruditapes philippinarum with four shell-colors exposed to the hypoxia
2.4 低氧胁迫下4种壳色蛤仔鳃组织中热休克蛋白家族基因的表达量分析
低氧胁迫下,不同壳色蛤仔鳃组织中热休克蛋白家族基因的表达结果如图4所示。从图4可见:随着低氧胁迫时间的延长,野生蛤仔和白蛤鳃组织中HSP40表达量均呈先升高后降低的趋势,野生蛤仔在低氧胁迫12 h时、白蛤在胁迫6 h时表达量均达到最高值 (P<0.05);斑马蛤和白斑马蛤HSP40表达量呈先降低后升高的趋势,在胁迫6 h时表达量达到最低值 (P<0.05)(图4-A)。野生蛤仔和白蛤鳃组织中HSP75表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,野生蛤仔在胁迫12 h时、白蛤在胁迫6 h时表达量达到最高值(P<0.05);斑马蛤和白斑马蛤HSP75表达量呈先降低后升高再降低的趋势,斑马蛤在胁迫24 h时、白斑马蛤在胁迫6 h时表达量达到最低值 (P<0.05)(图4-B)。野生蛤仔和白蛤VpsHSP-1表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,野生蛤仔在胁迫12 h时、白蛤在胁迫6 h时表达量均达到最高值 (P<0.05);斑马蛤和白斑马蛤VpsHSP-1表达量呈先降低后升高的趋势,均在胁迫6 h时表达量达到最低值 (P<0.05)(图4-C)。野生蛤仔和白蛤VpsHSP-2表达量随着低氧胁迫时间的延长呈先升高后降低的趋势,野生蛤仔在胁迫12 h时、白蛤在胁迫6 h时表达量均达到最高值(P<0.05);斑马蛤和白斑马蛤VpsHSP-2表达量呈先降低后升高的趋势,均在胁迫6 h时表达量达到最低值 (P<0.05)(图4-D)。
3 讨论
3.1 低氧胁迫对4种壳色蛤仔体内抗氧化酶家族基因的影响
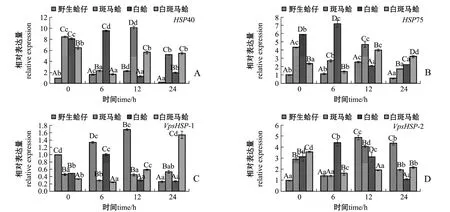
图4 低氧胁迫下4种壳色蛤仔鳃组织中热休克蛋白家族基因的相对表达量Fig.4 Relative expression levels of heat shock protein gene family in the gill of Manila clam Ruditapes philippinarum with four shell-colors exposed to hypoxia
在呼吸过程中,有0.1%~0.2%的氧气由体内的细胞转化成活性氧 (ROS)[25]。活性氧作为一种具有高度活性的分子能够氧化细胞成分,对于动物抵御病原微生物的感染具有重要作用[26]。低氧可以导致体内电子的蓄积,为活性氧的形成提供便利,结果导致体内产生较高水平的活性氧[27]。体内的抗氧化系统在控制活性氧含量防止细胞氧化损伤方面具有重要作用[28]。体内的抗氧化系统由抗氧化酶和其他 (非酶系统)分子组成,用于清除体内多余的活性氧。真核生物体内的抗氧化酶家族是抵御活性氧的第一道防线,通过超氧化物歧化酶(superoxide dismutase,SOD)活性氧转化成超氧自由基(O2-·)再转化成过氧化氢 (H2O2),再由过氧化氢酶 (catalase,CAT)转化成水,谷胱甘肽过氧化物酶 (glutathione peroxidase,GPx)、硫氧还原蛋白过氧化物酶 (thioredoxin peroxidase,TPx)和抗氧化蛋白 (peroxiredoxin,PRx)等也参与对过氧化物的解毒过程[26,29]。因此,抗氧化物酶表达量的高低,能够反映出动物对低氧耐受能力的差异。
本研究中发现,4种壳色蛤仔在低氧胁迫期间体内抗氧化酶具有显著性波动过程,白蛤外套膜组织和斑马蛤鳃组织中TPx基因表达量在胁迫的各个时间点均显著高于其他3种壳色蛤仔。Zoysa等[21]在对低氧胁迫下皱纹盘鲍Haliotis discus discus转录组的分析发现,皱纹盘鲍鳃组织中CAT、TPx和SOD基因受到胁迫后表达量显著升高。Woo等[30]对紫贻贝Mytilus galloprovincialis进行低氧胁迫研究时发现,在2 mg/L低氧环境中,胁迫24 h时紫贻贝肌肉组织CAT、SOD基因表达量显著降低。这表明,低氧会诱导抗氧化酶活性变化,导致氧化还原不平衡,进一步诱导氧化应激。研究发现,人类体内的活性氧能够通过调节酪氨酸羟化酶的活性控制酚氧化酶的活性,进而影响黑色素细胞内真黑素和褐黑素的合成和分布,导致呈现不同深浅的肤色[31-32]。表皮内的硫氧还蛋白还原酶/硫氧还原蛋白/硫氧还原蛋白过氧化物酶 (TR/T/TPx)系统能够降低体内过氧化氢的浓度,进而减小活性氧对酪氨酸羟化酶的毒性作用[33]。对贝类壳色的相关研究表明,不同壳色贝类体内的酪氨酸酶活性或表达量差异所导致的黑色素合成及分布的不同,是产生壳色变化的一个重要因素[24-26]。TPx基因的这种高表达量可能与这两种壳色体内具有相对多的黑色素含量及其对酪氨酸酶活性较高的依赖性所致。此外,研究表明,贝类的抗氧化酶系统具有高度的组织特异性[34-35]。鳃组织作为贝类的呼吸器官,具有一套完整有效的抗氧化防御体系,其中包括SOD、CAT等高效的抗氧化酶,TPx作为组分之一参与对ROS的反应[36-37]。贝类外套膜的主要功能是参与贝壳的形成和色素沉积,其中黑色素形成过程所依赖的酪氨酸羟化酶活性主要通过TPx系统进行保护[19,38]。因此,本研究中不同壳色蛤仔TPx基因表达量在鳃组织和外套膜组织中表现出不同的变化趋势,可能与其在不同组织中的作用不同有关。
3.2 低氧胁迫对4种壳色蛤仔体内热休克蛋白家族基因的影响
通常情况下,在正常的生理状态下,生物体内持续表达的HSPs主要作为分子伴侣参与生物过程,在应激条件下能够被大量诱导以防止蛋白质的聚合[39]。在氧化应激状态下,活性氧 (主要是H2O2)通过激活JAK/STAT信号通路诱导热休克蛋白家族基因特别是HSP70和HSP90的表达,高水平的HSP70基因能够提高受胁迫细胞或动物的存活能力[40-41]。HSP40作为一种伴侣蛋白基因,是HSP70家族基因行使其功能活动的重要辅助因子,通过促进ATP水解来发挥作用,并能调节HSP70和多肽形成复合物,使非天然结构的蛋白恢复天然结构[10]。本研究中,在低氧胁迫条件下,4种壳色蛤仔体内的HSP75和HSP40基因均表现出了升高的过程。David等[42]研究发现,长牡蛎Crassostrea gigas在30%氧含量的低氧环境中被胁迫3 d后,其外套膜、鳃组织中HSP70基因显著升高。因此,可以推断,蛤仔体内HSP75和HSP40的升高是蛤仔对低氧的一种适应性反应。曲凌云等[43]对栉孔扇贝Chlamys farreri进行热刺激后,其鳃组织中HSP70基因表达量发生显著变化,而外套膜、肌肉和性腺组织中变化不显著。福寿螺Pomacea canaliculata在受到高温胁迫时,鳃组织中HSP60、HSP70和HSP90表达量显著高于消化腺和肌肉组织中的表达量[25]。因此,本研究中,斑马蛤鳃组织和外套膜组织中热休克蛋白基因表达量变化趋势不同与热休克蛋白家族基因组织特异性有关。研究表明,栉孔扇贝热休克蛋白家族基因参与壳结构中壳多糖合成,在贝类的生物矿化过程中具有重要作用[44-45],而贝类壳色主要是由生物矿化过程形成的碳酸钙晶体结构以及其中的蛋白成分和色素所形成[20-21,46]。 本研究中, 在受到低氧胁迫后,同一热休克蛋白基因在不同壳色蛤仔的相同组织中也表现出不同的变化趋势,这可能与热休克蛋白基因在蛤仔不同壳色形成过程中的功能差异有关。
4 结语
本研究中,在1 mg/L低氧胁迫后,蛤仔鳃组织和外套膜中抗氧化酶家族基因 (TPx、CAT、Mn-SOD、Cu/Zn-SOD)和热休克蛋白家族基因(HSP40、 HSP75、 VpsHSP-1、 VpsHSP-2) 均表现出升高的过程,表明蛤仔体内的这些基因参与了其对低氧的耐受过程。此外,白蛤外套膜组织中的TPx和HSP40基因,以及斑马蛤鳃组织中TPx基因表达量在低氧胁迫的各个时间点均显著高于其他3种壳色蛤仔,这些基因的高表达能够提高蛤仔对活性氧的抵抗能力,对其体内黑色素合成途径具有重要的保护作用。黑色素合成能力的差异已被证实与贝类壳色的多样性具有重要的相关性。因此,不同壳色蛤仔抗氧化酶基因和热休克蛋白基因所表现出的表达差异,应与其壳色之间存在某种关联。白蛤和斑马蛤在低氧胁迫过程中表现出相对较好的低氧耐受能力,对其具体的影响途径和机制今后需进一步研究证实。
参考文献:
[1] Xue C B,Wang G L,Jin S.Review on the culture environment of the marine intertidal shellfish[J].Ecology and Environment,2003,13(1):116-118.
[2] 杨东敏,张艳丽,丁鉴锋,等.高温、低盐对菲律宾蛤仔免疫能力的影响[J].大连海洋大学学报,2017,32(3):302-309.
[3] Howe M R.Some direct measurements of the non-tidal drift on the continental shelf between cape cod and cape hatteras[J].Deep Sea Research and Oceanographic Abstracts,1962,9(11-12):445-455.
[4] Tallqvist M.Burrowing behaviour of the Baltic clam Macoma balthica:effects of sediment type,hypoxia and predator presence[J].Marine Ecology Progress,2001,212:183-191.
[5] Harris J O,Maguire G B,Edwards S J,et al.Low dissolved oxygen reduces growth rate and oxygen consumption rate of juvenile greenlip abalone,Haliotis laevigata Donovan[J].Aquaculture,1999,174(3-4):265-278.
[6] Baker S M,Mann R.Effects of hypoxia and anoxia on larval settlement, juvenile growth, and juvenile survival of the oyster Crassostrea virginica[J].The Biological Bulletin,1992,182(2):265-269.
[7] Baker S M,Mann R.Feeding ability during settlement and metamorphosis in the oyster Crassostrea virginica(Gmelin,1791)and the effects of hypoxia on post-settlement ingestion rates[J].Journal of Experimental Marine Biology and Ecology,1994,181(2):239-253.
[8] Cheng W,Liu C H,Cheng S Y,et al.Effect of dissolved oxygen on the acid-base balance and ion concentration of Taiwan abalone Haliotis diversicolor supertexta[J].Aquaculture,2004,231(1-4):573-586.
[9] Sobral P,Widdows J.Influence of hypoxia and anoxia on the physiological responses of the clam Ruditapes decussatus from southern Portugal[J].Marine Biology,1997,127(3):455-461.
[10] Yu J H,Choi M C,Park K I,et al.Effects of anoxia on immune functions in the surf clam Mactra veneriformis[J].Zoological Studies,2010,49(1):94-101.
[11] Wang Y J,Hu M H,Cheung S G,et al.Immune parameter changes of hemocytes in green-lipped mussel Perna viridis exposure to hypoxia and hyposalinity[J].Aquaculture,2012,356-357:22-29.
[12] 张文斌,吕振波,张莹,等.缺氧胁迫对菲律宾蛤仔(Ruditapes philippinarum)生理代谢的影响[J].生态学杂志,2014,33(9):2448-2453.
[13] 李道季,张经,黄大吉,等.长江口外氧的亏损[J].中国科学(D 辑:地球科学),2002,32(8):686-694.
[14] 周作强,丁晴晴,刘其根,等.缺氧对贝类的胁迫效应及对其免疫系统的影响[J].生态毒理学报,2013,8(3):324-330.
[15] 闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J].大连水产学院学报,2005,20(4):266-269.
[16] 闫喜武,张跃环,霍忠明,等.不同壳色菲律宾蛤仔品系F2的表型性状[J].水产学报,2010,34(6):881-889.
[17] 丁鉴锋,杨霏,闫喜武,等.不同壳色菲律宾蛤仔免疫机能的比较研究[J].大连海洋大学学报,2012,27(5):411-416.
[18] Yue X,Nie Q,Xiao G Q,et al.Transcriptome analysis of shell color-related genes in the clam Meretrix meretrix[J].Marine Biotechnology,2015,17(3):364-374.
[19] Ding J,Zhao L,Chang Y Q,et al.Transcriptome sequencing and characterization of Japanese scallop Patinopecten yessoensis from different shell color lines[J].PLoS One,2015,10(2):e0116406.
[20] Sun X J,Yang A G,Wu B,et al.Characterization of the mantle transcriptome of yesso scallop(Patinopecten yessoensis):identification of genes potentially involved in biomineralization and pigmentation[J].PLoS One,2015,10(4):e0122967.
[21] Zoysa M D,Ilson W,Lee L,et al.Transcriptional analysis of antioxidant and immune defense genes in disk abalone(Haliotis discus discus)during thermal,low-salinity and hypoxic stress[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2009,154(4):387-395.
[22] Cong M,Wu H F,Liu X L,et al.Effects of heavy metals on the expression of a zinc-inducible metallothionein-III gene and antioxidant enzyme activities in Crassostrea gigas[J].Ecotoxicology,2012,21(7):1928-1936.
[23] Li C H,Li L Y,Liu F,et al.Alternation of Venerupis philippinarum Hsp40 gene expression in response to pathogen challenge and heavy metal exposure[J].Fish & Shellfish Immunology,2011,30(1):447-450.
[24] Xu Y P,Zheng G W,Dong S Z,et al.Molecular cloning,characterization and expression analysis of HSP60,HSP70 and HSP90 in the golden apple snail,Pomacea canaliculata[J].Fish & Shellfish Immunology,2014,41(2):643-653.
[25] Fridovich I.Mitochondria:are they the seat of senescence[J].Aging Cell,2004,3(1):13-16.
[26] Halliwell B,Gutteridge J M C.Free Radicals in Biology and Medicine[M].Oxford:Oxford University Press,2015:383-385.
[27] Storey K B.Oxidative stress:animal adaptations in nature[J].Brazilian Journal of Medical and Biological Research,1996,29(12):1715-1733.
[28] Lesser M P.Oxidative stress in marine environments:biochemistry and physiological ecology[J].Annual Review of Physiology,2006,68(1):253-278.
[29] Di Giulio R T,Benson W H,Sanders B M,et al.Biochemical mechanisms:metabolism,adaptation,and toxicity[C]//Rand G M.Fundamentals of Aquatic Toxicology:Effects,Environmental Fate and Risk Assessment.Boca Raton:Lewis Publishers, Inc,1995.
[30] Woo S,Denis V,Won H,et al.Expressions of oxidative stress-related genes and antioxidant enzyme activities in Mytilus galloprovincialis(Bivalvia,Mollusca)exposed to hypoxia[J].Zoological Studies,2013,52:15.
[31] Prota G.Progress in the chemistry of melanins and related metabolites[J].Medicinal Research Reviews,1988,8(4):525-556.
[32] Wood J M,Schallreuterwood K U,Lindsey N J,et al.A specific tetrahydrobiopterin binding domain on tyrosinase controls melanogenesis[J].Biochemical and Biophysical Research Communications,1995,206(2):480-485.
[33] Schallreuter K U,Wood J M.Thioredoxin reductase—its role in epidermal redox status[J].Journal of Photochemistry and Photobiology B:Biology,2001,64(2-3):179-184.
[34] Box A,Sureda A,Deudero S.Antioxidant response of the bivalve Pinna nobilis colonised by invasive red macroalgae Lophocladia lallemandii[J].Comparative Biochemistry&Physiology Part C Toxicology & Pharmacology,2009,149(4):456-460.
[35] Regoli F,Principato G B,Bertoli E,et al.Biochemical characterization of the antioxidant system in the scallop Adamussium colbecki,a sentinel organism for monitoring the Antarctic environment[J].Polar Biology,1997,17(3):251-258.
[36] Almeida E A,Bainy A C D,Dafre A L,et al.Oxidative stress in digestive gland and gill of the brown mussel(Perna perna)exposed to air and re-submersed[J].Journal of Experimental Marine Biology and Ecology,2005,318(1):21-30.
[37] Abele D,Burlando B,Viarengo A,et al.Exposure to elevated temperatures and hydrogen peroxide elicits oxidative stress and antioxidant response in the Antarctic intertidal limpet Nacella concinna[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1998,120(2):425-435.
[38] Morse M P,Zardus J D.Bivalvia[M]//Harrison F W,Kohn A J.Microscopic Anatomy of Invertebrates.New York:Wiley,1997:7-118.
[39] Benjamin I J,Mcmillan D R.Stress(heat shock)proteins:molecular chaperones in cardiovascular biology and disease[J].Circulation Research,1998,83(2):117-132.
[40] Madamanchi N R,Li S Z,Patterson C,et al.Reactive oxygen species regulate heat-shock protein 70 via the JAK/STAT pathway[J].Arteriosclerosis Thrombosis, and Vascular Biology,2001,21(3):321-326.
[41] Morimoto R I,Santoro M G.Stress-inducible responses and heat shock proteins:new pharmacologic targets for cytoprotection[J].Nature Biotechnology,1998,16(9):833-838.
[42] David E,Tanguy A,Pichavant K,et al.Response of the Pacific oyster Crassostrea gigas,to hypoxia exposure under experimental conditions[J].FEBS Journal,2005,272(21):5635-5652.
[43] 曲凌云,相建海,孙修勤,等.温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究[J].高技术通讯,2005,15(5):96-100.
[44] Weiss I M,Schönitzer V,Eichner N,et al.The chitin synthase involved in marine bivalve mollusk shell formation contains a myosin domain[J].FEBS Letters,2006,580(7):1846-1852.
[45] Shi M J,Lin Y,Xu G R,et al.Characterization of the Zhikong scallop(Chlamys farreri)mantle transcriptome and identification of biomineralization- related genes[J].Marine Biotechnology,2013,15(6):706-715.
[46] Williams S T.Molluscan shell colour[J].Biological Reviews,2017,92(2):1039-1058.
