包装材料对贮藏期荔枝汁品质及非酶褐变的影响
2018-04-26胡卓炎
吴 敏,胡卓炎
(1.华南农业大学食品学院,广东广州 510642;2.广西大学轻工与食品工程学院,广西南宁 530004;3.广西清洁化制浆造纸与污染控制重点实验室,广西南宁 530004)
果汁在贮藏、流通和销售过程中,易受到温度、氧气、光照和微生物的影响,营养成分损耗,褐变加深,从而降低了消费者的接受程度[1]。包装作为食品生产的最后一个环节,能够有效地阻隔贮藏环境中的氧气、水蒸气、光线和微生物等进入到包装内部,从而降低食品受潮、霉变、腐烂和变味等的发生,以保持食品货架期内的营养成分及感官品质。包装材料的阻隔性能不同,在食品尤其是果汁包装中起的作用也不尽相同。目前,许多研究都在尝试采用单层聚酯(PET)瓶、PET/聚萘二甲酸乙二醇酯(PEN)瓶、含有吸氧剂的PET瓶、含有纳米氧化锌(ZnO)和银(Ag)的高密度聚乙烯(HDPE)袋、铝罐、可降解的聚乳酸(PLA)瓶及具有遮光功能的铝塑复合袋等包装材料以减缓果汁在贮藏过程中的理化指标和感官品质的变化[2-5]。
荔枝汁富含抗坏血酸、葡萄糖、果糖、蔗糖、柠檬酸、酒石酸、苹果酸、乙酸以及表儿茶素、芦丁等酚类物质,含有各种氨基酸成分,呈乳白颜色[6]。这些营养成分在贮藏过程中极易受到外界温度、氧气、光照、包装材料和微生物等的影响而发生品质劣变。目前的研究主要关注贮藏温度,忽略了包装材料阻隔性能对荔枝汁品质的影响,而且对影响褐变的品质指标研究也不够全面,不能充分揭示荔枝汁非酶褐变机理。因此,研究包装材料的阻隔性对荔枝汁品质的影响十分必要。
本文通过研究不同阻隔性能的PET瓶、PLA瓶和PET/铝箔(Al)/聚乙烯(PE)复合袋灌装荔枝汁,在25 ℃环境下避光贮藏,分析L-抗坏血酸、溶解氧浓度、蔗糖、果糖、葡萄糖、氨基酸、总酚、可溶性固形物、pH、5-羟甲基糠醛和褐变指数的变化,采用偏最小二乘法回归(PLSR)分析包装材料对荔枝汁贮藏过程中非酶褐变的影响,旨在为荔枝汁加工企业合理选择包装材料、改善荔枝汁品质和延长其货架寿命提供科学依据和指导。
1 材料与方法
1.1 材料与仪器
荔枝汁 由广西合浦果香园食品有限公司按DBS45/009-2013“广西食品安全地方标准 食品工业用荔枝汁”生产制得,荔枝品种为怀枝,从钦州市灵山县采购,当天运回工厂加工,卸料后由去枝机除去枝叶,果实经清洗机清洗后进入去皮机去皮,然后打浆去核,压榨过滤,离心分离,93 ℃瞬时杀菌,冷却后用无菌袋灌装,-18 ℃冻藏,并在冻藏状态下运回实验室待用;无菌袋(材料为PE/镀铝PET(MPET)/PE) 惠州宝柏包装有限公司;形状和尺寸完全相同的透明PET和PLA瓶 广州鑫科塑料制品有限公司;复合袋(复合材料为PET/Al/PE,PET为袋子的外层材料,Al为中间层材料,PE为袋子的内层材料) 广西乐达包装有限公司;蔗糖、葡萄糖、果糖、L-抗坏血酸、5-羟甲基糠醛、没食子酸(标准品) Sigma-Aldrich中国;甲醇、乙腈(色谱纯) 阿拉丁试剂(上海)有限公司;福林酚试剂(生化试剂) 国药集团上海化学试剂有限公司;其它试剂均为国产分析纯。
Bound Elut ENV(500 mg,6 mL)固相萃取柱 美国Agilent公司;高效液相色谱仪1260 美国Agilent公司;手入式气袋690323 美国Spilfyter公司;溶解氧传感器InPro 6850i(配多参数测试仪M400和无纸化记录仪VX2101R/U) 梅特勒-托利多仪器(上海)有限公司;紫外可见分光光度计8453 美国Agilent公司;氨基酸自动分析仪L-8900 日本日立公司;透氧仪OX-TRAN 2/21 美国MOCON公司;数字式厚度测量仪49-56 美国TMI公司。
1.2 实验方法
1.2.1 样品制备及贮藏 采用流动水浸渍对无菌袋装冷冻荔枝果汁进行解冻,水温控制在4~10 ℃,当无菌袋中的荔枝汁无块状体存在时解冻完成。解冻完成后剪开无菌袋,向荔枝汁中加入浓度为0.02%(W/W)的叠氮化钠以防止贮藏过程中因霉菌、酵母菌和细菌生长繁殖引起荔枝汁腐败变质对实验结果产生干扰[7]。然后立即测定荔枝汁的L-抗坏血酸、溶解氧、蔗糖、果糖、葡萄糖、氨基酸、总酚、可溶性固形物、pH、5-羟甲基糠醛和褐变指数的初始(0 w)值,并进行样品制备,即将一部分荔枝汁于无菌工作台上缓慢地灌装到已杀菌(60 ℃,35% H2O2)的PET瓶和PLA瓶中,无顶空气体存在,并用已杀菌的聚丙烯材质无内衬垫的塑料螺旋盖封口;将另一部分荔枝汁缓慢地灌装到已杀菌的复合袋中,真空包装,无顶空气体存在,热封口。
将灌装好的荔枝汁样品放在25 ℃的环境中避光贮藏,分别在第1、2、4、6、8、10、13和17 w时测定荔枝汁样品的L-抗坏血酸、溶解氧浓度、蔗糖、果糖、葡萄糖、氨基酸、总酚、可溶性固形物、pH、5-羟甲基糠醛和褐变指数,每种样品测试三个平行样。
1.2.2 包装材料厚度测定 采用GB/T6672-2001 塑料薄膜和薄片厚度的测定法,使用数字式厚度测量仪进行复合袋和塑料瓶厚度的测定,测定前把复合袋切成10 cm×10 cm的正方形,PET和PLA瓶瓶身切成1 cm×2 cm的长方形供测量使用,每种材料测量10个点。
1.2.3 包装材料透氧量测定 包装材料透氧量使用透氧仪进行测定,其中PET瓶和PLA瓶采用GB/T 31354-2014 包装件和容器氧气透过性测试方法-库仑计检测法,将待测试的PET瓶和PLA瓶瓶口部分全部用胶牢固地粘在样品架上,待测试瓶子内部为流动的氮气,瓶子外部为空气(氧气含量约为21%)。复合袋采用GB/T 19789-2005 包装材料-塑料薄膜和薄片氧气透过性实验-库仑计检测法,待测试的复合膜将测试腔隔成两个独立的气流系统,一侧为流动的氧气,另一侧为流动的氮气(载气)。测试环境温度为(23±1) ℃,相对湿度(50%±2%)。
1.2.4 L-抗坏血酸(L-Ascorbic Acid,L-AA)含量测定 样品处理:取荔枝汁5 mL,4 ℃下12000 r/min离心5 min,取上层清液2 mL过0.45 μm滤膜,转入标记好的棕色样品瓶中。采用高效液相色谱HPLC进行测定[8],色谱柱:Agilent Zorbax Stable Bond-AQ(4.6 mm×250 mm,5 μm);流动相:0.1%(W/W)草酸溶液;流速:0.8 mL/min;紫外检测器,检测波长254 nm;进样量5 μL;柱温箱温度25 ℃。
1.2.5 溶解氧浓度(Dissolved Oxygen Concentration,DOC)测定 采用溶解氧传感器在手入式气袋中的氮气环境下进行测定,测定过程把溶解氧传感器伸入到包装容器的中间位置,并用磁力搅拌器连续搅拌荔枝汁,以保证数据的准确性。溶解氧传感器连接的无纸化记录仪的信号采集时间设定为2 s采集一个数据。
1.2.6 糖含量测定 参照GB/T22221-2008食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定,高效液相色谱法进行样品处理,取10000 r/min离心5 min的荔枝汁上层清液25.0 g,分别加2.19 g乙酸锌和1.06 g亚铁氰化钾,用蒸馏水定容至500 mL,用磁力搅拌器搅拌20 min,用玻璃滤器(G3型)过滤,取10 mL滤液过0.45 μm滤膜后放入样品瓶中。采用HPLC测定蔗糖、果糖和葡萄糖含量[9],色谱柱:Agilent Zorbax Carbohydrate(4.6 mm×250 mm,5 μm);柱温30 ℃;流动相:乙腈∶超纯水(V/V)=75∶25的混合液;流速:l mL/min;进样量10 μL;示光折差检测器,检测器温度35 ℃。
1.2.7 氨基酸含量测定 参照GB/T 5009.124-2003 食品中氨基酸的测定中的方法,使用氨基酸自动分析仪进行测定。色谱柱:P/N 855-3506;柱温57 ℃;反应室温度135 ℃;流速:0.1 mL/min;进样量20 μL。
1.2.8 总酚含量测定 采用福林酚(Folin-Ciocalteau)法测定[10]。取荔枝汁5 mL,4 ℃下12000 r/min离心5 min,取上层清液1 mL,并用蒸馏水将其稀释10倍,取稀释液1 mL放入到10 mL的容量瓶中,首先加入1.5 mL 福林酚试剂,振荡混匀后放置5 min,然后加入75 g/L的碳酸钠溶液3 mL,最后用蒸馏水定容至10 mL,放置在30 ℃暗室中反应2 h,于765 nm波长处测定吸光度,用蒸馏水作为空白对照。样品中总酚含量表示为与每升果汁相当的没食子酸(Gallic Acid Equivalent,GAE)的毫克数(mg GAE/L)。
1.2.9 可溶性固形物(Total Soluble Solid,TSS)含量和pH测定 用数字阿贝折射仪测定荔枝汁的可溶性固形物含量。用pH计在(25±2) ℃环境中测定pH,使用前用pH为4.0和7.0的缓冲液对pH计进行两点校正。
1.2.10 5-羟甲基糠醛(5-Hydroxymethyl Furfural,5-HMF)含量测定 采用固相萃取-高效液相色谱法(SPE-HPLC)[11]进行测定,取在4 ℃下12000 r/min离心5 min的荔枝汁上层清液25 mL待用。Bound Elut ENV固相萃取小柱依次用5 mL色谱级甲醇和10 mL超纯水进行活化,然后将25 mL荔枝汁上层清液缓慢地倒入固相萃取小柱中,待荔枝汁流完后,用5 mL超纯水淋洗小柱,弃去全部淋洗液,最后用15 mL甲醇与超纯水2∶8 (V/V)的混合液分三次进行洗脱,收集全部洗脱液,取2 mL过0.45 μm微孔滤膜,放入样品瓶中待测。固相萃取全过程控制流速为2~3 mL/min。色谱柱:Agilent Zorbax Eclipse XDB-C18(4.6 mm×250 mm,5 μm);柱温:30 ℃;紫外检测波长285 nm;流动相:10%甲醇和90%水(含1%乙酸)的混合液;流速1 mL/min,进样量10 μL。
1.2.11 褐变指数(Browning Index,BI)测定 参照Zerdin等[4]的方法测定,取12000 r/min离心5 min的荔枝汁上层清液10 mL,按1∶1 (V/V)加入95%的乙醇溶液,混合振荡10 min后再12000 r/min离心5 min,去除样品中的纤维和颗粒成分。取10 mL上层清液,用紫外可见分光光度计测定其在420 nm处的吸光度A,以A420来表示荔枝汁的褐变指数。以蒸馏水与95%的乙醇1∶1 (V/V)的混合液做空白对照。
1.2.12 偏最小二乘法回归(Partial Least Squares Regression,PLSR)分析 PLSR是一种先进的多元分析方法,可以解决多元回归分析中的变量多重相关性或变量多于样本点等实际问题,PLSR分析集多元线性回归分析、主成分分析和典型相关分析为一体,实现了多种数据分析方法的综合应用,在建模过程中不是直接考虑因变量集合与自变量集合的回归建模,而是在变量系统中提取若干个对系统具有最佳解释能力的新综合变量(又称为主成分),然后利用它们回归建模[12]。进行PLSR分析有助于深入分析包装材料对荔枝汁非酶褐变的影响。PLSR分析时,L-抗坏血酸、溶解氧浓度、蔗糖、果糖、葡萄糖、氨基酸、总酚、可溶性固形物、pH、5-羟甲基糠醛为自变量X,褐变指数(BI)为因变量Y,进行单因变量的PLSR分析,计算变量标识系数,绘制双标图(Biplot)以直观地观察自变量X与因变量Y的相互关系。当自变量X位于Y向量同一方向时,表明该自变量的变化与褐变的变化成正向关系,即Y变量BI随着该自变量X的增加而增加;相反,自变量X位于Y向量相反方向时,则与褐变的变化成反向关系,即Y变量BI随着该自变量X的减少而增加。各品质指标对荔枝汁贮藏过程中颜色褐变影响的重要性,变量标识系数可以给出更多定量的认识。变量标识(Variable identification,VID)系数是原始变量X与回归得到的模型预测的Y变量间的相关系数,取值范围在-1~+1之间,VID系数绝对值越高,则该指标对荔枝汁非酶褐变的影响就越严重[13]。
1.3 数据处理与统计分析
数据用“平均值±标准差”表示。用SPSS 22.0进行单因素方差分析(p<0.05)。用Origine 8.6作图。用SIMCA 14.0进行PLSR分析。
2 结果与讨论
2.1 包装材料性能分析
PET瓶、PLA瓶和复合袋三种包装材料的性能见表1。由表1可知,PLA瓶的透氧量是618.98×10-3cc/package·day,该值分别是PET瓶(58.08×10-3cc/package·day)与复合袋(6.62×10-3cc/package·day)透氧量的近11倍和100倍,由此可知,复合袋的氧气阻隔性能最好,其次是PET瓶的,PLA瓶的氧气阻隔性能最差。而PLA瓶的厚度最厚,PET瓶的次之,复合袋的厚度最薄。

表1 包装材料性能Table 1 Performance of packaging materials
2.2 包装材料对荔枝汁L-AA含量的影响
L-AA是人体必需的营养物质,具有抗氧化性能,能够清除人体内的自由基,然而L-AA十分不稳定,在贮藏过程中极易受到环境温度及氧气的作用,同时包装材料的差异会影响到包装对氧气的阻隔性能,进一步影响L-AA的降解[14]。包装材料对荔枝汁L-AA含量的影响如图1所示,随着贮藏时间的延长,荔枝汁的L-AA含量均不断下降,其中PLA瓶装荔枝汁的L-AA降解速率最快,在第8 w基本降解完毕,PET瓶和复合袋的L-AA降解明显趋缓,贮藏结束时,PET瓶、PLA瓶和复合袋装荔枝汁的L-AA含量分别下降了83%、99%和60%。

图1 包装材料对荔枝汁L-AA含量的影响Fig.1 Effects of packaging materials on the L-ascorbic acid content of litchi juice
荔枝汁中的L-AA降解速率与溶解氧浓度及包装材料阻隔性能密切相关。三种包装材料中,PLA瓶的阻隔性能最差,因此,贮藏过程会有大量的氧气透过PLA瓶溶解到荔枝汁中,使溶解氧不断得到补充,从而导致PLA瓶中的L-AA速率降解最快。同时,荔枝汁有较高的初始溶解氧浓度(2034±7) μg/L,故推测PLA瓶中L-AA的快速有氧降解是初始溶解氧和包装材料透过氧共同作用的结果,且以透过氧为主。PET瓶和复合袋具有良好的阻隔性能,进入到包装内部的透过氧量较少,荔枝汁中溶解氧得不到补充,推测两者的L-AA初期较快速的有氧降解主要是由初始溶解氧引起的,受包装材料透过氧的影响较小;贮藏后期L-AA降解缓慢是因为有氧降解和无氧降解同时进行,且无氧降解速率缓慢。但由于PET瓶的透氧量大于复合袋的,出现了同期PET瓶中的L-AA降解速率高于复合袋中的速率的情况。三种包装材料中荔枝汁的L-AA含量差异显著,包装材料阻隔性能对L-AA含量有显著影响(p<0.05)。三种包装材料中,阻隔性能最好的复合袋最适宜包装荔枝汁,其次是PET瓶,PLA瓶不适宜包装荔枝汁。
2.3 包装材料对荔枝汁中溶解氧浓度的影响
果汁中的溶解氧不但能够引起L-AA有氧降解,还能够引起果汁风味劣变,好氧菌生长,降低了果汁的品质,缩短其货架寿命[15]。荔枝汁中有较高的初始溶解氧浓度,在2.2中推测L-AA的降解与包装容器内的DOC密切相关,因此分析荔枝汁的DOC变化情况以进一步说明荔枝汁组分发生氧化降解的原因。包装材料对荔枝汁中DOC的影响如图2所示,PET瓶和复合袋装荔枝汁的L-AA贮藏前期发生氧化降解,消耗了大量荔枝汁中的溶解氧,致使DOC在前两周快速下降;随着L-AA含量的不断降低,消耗的溶解氧也越来越少,故贮藏中期荔枝汁中的DOC下降趋于缓慢;同时这两种包装材料具有较低的氧气透过量,贮藏后期随着L-AA降解所消耗的溶解氧与溶解在荔枝汁中的透过氧的量基本一致时,即溶解与消耗处于动态平衡时,荔枝汁中的DOC基本保持不变。

图2 包装材料对荔枝汁中溶解氧浓度的影响Fig.2 Effects of packaging materials on the dissolved oxygen concentration of litchi juice
PLA瓶装荔枝汁在贮藏初期0~2 w,透过PLA瓶的氧气量较低,L-AA的快速降解消耗的主要是荔枝汁中的初始溶解氧,从而导致DOC迅速降低;但随着贮藏时间的延长2~6 w,外界的氧气不断地透过PLA瓶壁进入到容器内部,当透过氧的量与L-AA氧化降解所消耗的氧的量处于动态平衡时,则荔枝汁中的DOC呈现稳定状态;到贮藏中后期(6 w后),随着透过氧的不断溶解,L-AA降解消耗溶解氧的量远远小于透过氧溶解的量,荔枝汁中的DOC开始快速上升,贮藏结束时的DOC是(4296±15) μg/L。三种包装材料中荔枝汁的DOC差异显著,包装材料阻隔性能对DOC有显著影响(p<0.05),进而影响L-AA的氧化降解速率。
2.4 包装材料对荔枝汁糖含量的影响
贮藏过程,包装材料对荔枝汁的蔗糖、果糖和葡萄糖含量的影响如图3所示。由图3a可知,荔枝汁的蔗糖在酸性条件下发生了水解生成葡萄糖和果糖,使其含量随着贮藏时间的延长均不断减少,贮藏结束时,PET瓶、PLA瓶和复合袋装荔枝汁的蔗糖分别下降了75.1%、71.1%和88.3%,三种包装材料中蔗糖含量无显著差异,包装材料阻隔性能对蔗糖含量无显著影响(p>0.05)。由图3b和3c可知,三种包装材料中的果糖含量变化均呈先增加,后减少,然后又缓慢增加的趋势;葡萄糖的含量呈先增加,后一直缓慢减少的趋势,与侯雪等[16]研究发现贮藏过程苹果汁的糖含量呈折线型变化趋势类似。贮藏结束时,果糖和葡萄糖含量较其初始值均有所增加。贮藏初期,PET瓶、PLA瓶和复合袋装荔枝汁的果糖和葡萄糖含量较快速地增加,可能是由酸性条件下蔗糖不断地水解引起的;贮藏中期,随着美拉德反应加剧,将消耗更多的葡萄糖和果糖,导致两者的含量均出现了缓慢减少;贮藏后期,果糖含量又逐渐缓慢增加,可能是由于实验用荔枝汁中含有的果肉悬浮物里面的可溶性糖不断溶解和荔枝汁中的多糖水解增加了果糖和葡萄糖的含量,当增加量大于美拉德反应的消耗量时,果糖浓度便开始缓慢地增加。葡萄糖比果糖更容易参与美拉德反应[17],因此,三种包装材料中的葡萄糖含量没有出现同果糖一样的又缓慢增加的情况。

图3 包装材料对荔枝汁蔗糖、果糖和葡萄糖含量的影响Fig.3 Effects of packaging materials on the sucrose,fructose and glucose content of litchi juice
2.5 包装材料对荔枝汁氨基酸含量的影响
氨基酸是人体需要的重要营养物质,荔枝果实中氨基酸含量丰富,实验用荔枝汁初始共检测出15种氨基酸,总量为764 mg/100 g。PET瓶、PLA瓶和复合袋装的荔枝汁氨基酸含量如表2所示,荔枝汁的氨基酸总量较初始值均有所下降,贮藏结束时,氨基酸总量分别下降了59.3%、60.1%和58.0%。贮藏过程中,氨基酸会与L-AA降解形成的DHA以及二羰基化合物等一起参与斯特勒克降解,从而导致其含量不断降低。此外,氨基酸还参与酚类物质的氧化降解。三种包装材料中荔枝汁的苏氨酸、赖氨酸、组氨酸和精氨酸损失较多,是参与美拉德反应的主要氨基酸。

表2 包装材料对荔枝汁氨基酸含量的影响Table 2 Effects of packaging materials on the amino acid content of litchi juice
2.6 包装材料对荔枝汁总酚含量的影响
荔枝汁含有丰富的多酚与黄酮类物质,贮藏过程中这些酚类物质极易发生变化,造成荔枝汁品质劣变。贮藏过程中,包装材料对荔枝汁总酚含量的影响如图4所示,总酚含量随着贮藏时间的延长而不断下降,包装材料透氧量越大,总酚含量下降速度越快,贮藏结束时,PET瓶、PLA瓶和复合袋装荔枝汁总酚含量分别下降了14.6%、20.1%和13.6%,总酚含量有显著差异,包装材料阻隔性能对总酚含量有显著影响(p<0.05)。总酚含量的降低可能是由于酚类物质在贮藏过程中消耗溶解氧发生了氧化聚合。Van Bree等研究发现橙汁中的酚类化合物和类黄酮与L-AA竞争消耗掉了氧气,发生了氧化聚合[18]。此外,PET瓶、PLA瓶和复合袋装的荔枝汁的总酚含量下降幅度低于L-AA的,说明贮藏过程酚类物质比L-AA稳定。Zheng等同样研究发现贮藏过程中菠萝汁的总酚比L-AA稳定[19]。
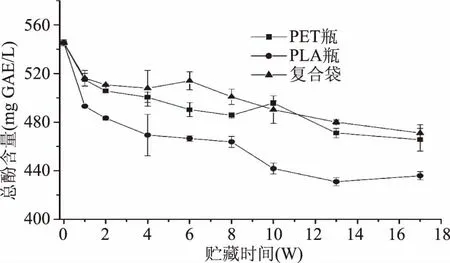
图4 包装材料对荔枝汁总酚含量的影响Fig.4 Effects of packaging materials on the total phenols content of litchi juice
2.7 包装材料对荔枝汁可溶性固形物含量和pH的影响
贮藏过程中,包装材料对荔枝汁TSS含量和pH的影响如图5所示。由图5a可知,随着贮藏时间的延长,PET瓶、PLA瓶和复合袋灌装的荔枝汁的TSS含量均呈上升趋势,且包装材料透氧量越大,TSS增加越快。由图5b可知,荔枝汁的pH均呈缓慢下降趋势,PLA瓶装的荔枝汁的pH最低,其次是PET瓶和复合袋装的,荔枝汁pH的轻微下降,可能是由于美拉德反应初级阶段的羰氨缩合反应过程,使得荔枝汁中游离氨基酸逐渐减少引起的。三种包装材料中荔枝汁的TSS含量差异显著,而pH差异不显著,包装材料阻隔性能对TSS含量有显著影响(p<0.05),对pH没有显著影响(p>0.05)。

图5 包装材料对荔枝汁可溶性固形物含量和pH的影响Fig.5 Effects of packaging materials on the total soluble solids content and pH of litchi juice
2.8 包装材料对荔枝汁5-HMF含量的影响
5-HMF经常被认为是果汁非酶褐变的标志物[20],美拉德反应及抗坏血酸氧化分解均能产生5-HMF。贮藏初始时(0 w)未在荔枝汁中检测到5-HMF。贮藏过程中,包装材料对荔枝汁5-HMF含量的影响如图6所示,随着贮藏时间的延长,PET瓶、PLA瓶和复合袋装荔枝汁的5-HMF含量均呈上升趋势,其中PLA瓶装荔枝汁的5-HMF含量最高,其次是PET瓶和复合袋的,这与2.2中荔枝汁的L-AA降解规律一致,说明5-HMF是美拉德反应的产物,也是L-AA降解的中间产物。贮藏结束时,三种包装材料中荔枝汁5-HFM含量没有显著差异,包装材料阻隔性能对5-HMF含量没有显著影响(p>0.05),25 ℃贮藏时,5-HMF是以美拉德反应生成为主。国际果汁生产商联合会规定:果汁中5-HMF的含量不应超过5 mg/L,贮藏结束时三种包装材料灌装的荔枝汁中5-HMF含量均未超过该规定。

图6 包装材料对荔枝汁5-HMF含量的影响Fig.6 Effects of packaging materials on the 5-HMF content of litchi juice
2.9 包装材料对荔枝汁褐变指数的影响
BI用来表征果汁贮藏过程中颜色褐变的情况,它被定义为褐色的纯度,是含有糖分的食品体系中指示褐变情况的一个重要指标[21]。贮藏过程中,包装材料对荔枝汁BI的影响如图7所示,随着贮藏时间的延长,荔枝汁的BI均呈上升趋势,其中,PLA瓶装荔枝汁的BI变化最大,其次是PET瓶和复合袋装的,这与L-AA的降解密切相关,L-AA降解后产生更多的中间产物参与美拉德反应,生成了更多的类黑色素物质,使得PLA瓶装荔枝汁的褐变最为严重。三种包装材料中荔枝汁BI差异显著,包装材料阻隔性能对BI有显著影响(p<0.05),推测L-AA降解产物本身导致的荔枝汁褐变不显著,L-AA降解产物参与美拉德反应生成的类黑精物质才是导致体系显著褐变的主要因素。三种包装材料灌装的荔枝汁的BI增加的规律与2.8中5-HMF变化的趋势一致,说明荔枝汁的褐变与5-HMF增加密切相关。

图7 包装材料对荔枝汁褐变指数的影响Fig.7 Effects of packaging materials on the browning index of litchi juice
2.10 荔枝汁非酶褐变分析
随着贮藏时间的延长,三种包装材料灌装的荔枝汁BI不断增加,肉眼观察到荔枝汁色泽逐渐从乳白色向褐色转变,发生了非酶褐变。由于非酶褐变的复杂性和不同反应产物间的相互作用,贮藏期荔枝汁非酶褐变不可能是一种反应机理作用的结果。为了系统地分析包装材料对荔枝汁非酶褐变的影响,进一步明确非酶褐变的机理,进行PLSR分析,计算VID系数,绘制双标图,以直观地反映不同包装材料灌装荔枝汁的品质指标与其非酶褐变间的关系。
PET瓶、PLA瓶和复合袋装荔枝汁褐变指数的PLSR模型建立选取了两个主成分t1和t2,t1和t2是原始X变量(品质指标)的线性组合,可以用来很好地解释荔枝汁品质指标(X变量)同非酶褐变(Y变量)的函数关系。选取两个主成分时,对PET瓶、PLA瓶和复合袋装荔枝汁BI的解释分别是98.77%、94.72%和97.42%,都有着很高的累计解释。荔枝汁品质指标与非酶褐变关系的偏最小二乘法回归分析双标图如图8所示。

图8 PET瓶,PLA瓶和复合袋装荔枝汁品质指标与非酶褐变关系的偏最小二乘法回归分析双标图Fig.8 PLSR biplots visualising the correlation betweennon-enzymatic browning and quality parameters of PET bottle,PLA bottle Multiply pocket litchi juice注:品质指标(●),不同贮藏时间的荔枝汁(▲)。
图8的双标图中内圆和外圆代表的VID系数分别为0.7和1.0,每个自变量旁标注的数值为其VID系数。本研究以VID系数绝对值>0.90时,表示该指标对贮藏过程中荔枝汁褐变有重要影响。由图8a可知,对PET瓶装荔枝汁的褐变有重要影响的是:5-HMF、L-AA、总酚、蔗糖和氨基酸总量;由图8b可知,对PLA瓶装荔枝汁的褐变有重要影响的是:5-HMF、总酚、蔗糖和TSS;由图8c可知,对复合袋装荔枝汁的褐变有重要影响的是:5-HMF、L-AA、总酚、蔗糖和氨基酸总量。包装材料阻隔性能不同,进入到容器内部的透过氧量也不同,使得荔枝汁中的溶解氧浓度有差异,溶解氧的存在能引起L-AA的降解和酚类物质氧化聚合,导致荔枝汁发生非酶褐变。经过PLSR分析,推测在25 ℃环境避光贮藏时,PET瓶、PLA瓶和复合袋灌装的荔枝汁非酶褐变除受L-AA降解和酚类物质氧化聚合影响外,体系中的美拉德反应也是非酶褐变的原因。为了在贮藏期内更好的保持荔枝汁颜色的稳定性,需要选择阻隔性能好的包装材料灌装荔枝汁,同时进行低温冷藏以延长荔枝汁的货架寿命。
3 结论
三种包装材料中荔枝汁的L-AA含量均不断减少,PLA瓶中L-AA的降解最快,其次是PET瓶和复合袋的。PLA中L-AA的降解受荔枝汁中初始溶解氧和包装材料透过氧的共同作用,并以透过氧的作用为主;PET瓶和复合袋中L-AA的降解主要受初始溶解氧的影响,受透过氧的影响较小。贮藏初期,三种包装材料中的DOC急剧下降,贮藏中后期,除PLA瓶中的DOC快速上升外,其它包装材料中的DOC平缓下降,趋于稳定,DOC的变化是L-AA降解耗氧和包装材料阻隔性共同作用的结果。
荔枝汁的蔗糖发生了水解,含量均不断地下降。贮藏初期,果糖和葡萄糖含量随着蔗糖的水解而相应的增加,贮藏中后期,由于美拉德反应的加剧及荔枝汁含有的果肉成分中可溶性糖的溶出,使得含量先减少后略有增加。荔枝汁氨基酸总量不断下降,其中苏氨酸、赖氨酸、组氨酸和精氨酸是参与美拉德反应的主要氨基酸。三种包装材料中荔枝汁的总酚含量不断下降,5-HMF含量和BI不断增加。
包装材料阻隔性能不同,进入到容器内部的透过氧量也不同,使得荔枝汁中的溶解氧浓度有差异。溶解氧的存在能引起L-AA的降解和酚类物质氧化聚合,导致荔枝汁发生非酶褐变。三种包装材料中,阻隔性能最好的复合袋最适宜包装荔枝汁,其次是PET瓶,PLA瓶不适宜包装荔枝汁。
[1]Wang Z,Zhang M,Wu Q. Effects of temperature,pH,and sunlight exposure on the color stability of strawberry juice during processing and storage[J]. Food Science and Technology,2015,60(2):1174-1178.
[2]Bacigalupi C,Lemaistre M H,Boutroy N,et al. Changes in nutritional and sensory properties of orange juice packed in PET bottles:An experimental and modelling approach[J]. Food Chemistry,2013,141(4):3827-3836.
[3]Dantas S T,Soares B M C,Saron E S,et al. Corrosion in aluminium cans with grape juice-influence of mechanical damage[J]. Packaging Technology and Science,2014,27(6):449-456.
[4]Zerdin K,Rooney M L,Vermu⊇ J. The vitamin C content of orange juice packed in an oxygen scavenger material[J]. Food Chemistry,2003,82(3):387-395.
[5]Siracusa V,Blanco I,Romani S,et al. Poly(lactic acid)-modified films for food packaging application:Physical,mechanical,and barrier behavior[J]. Journal of Applied Polymer Science,2012,125(S2):390-401.
[6]岳强,曾新安,于淑娟,等. 新鲜荔枝汁营养成分分析[J]. 食品工业科技,2006,27(4):173-174.
[7]Kim Y,Welt B A,Talcott S T. The impact of packaging materials on the antioxidant phytochemical stability of aqueous infusions of green tea(Camelliasinensis)and Yaupon Holly(Ilexvomitoria)during cold storage[J]. Journal of Agricultural and Food Chemistry,2011,59(9):4676-4683.
[8]Zanoni B,Pagliarini E,Galli A,et al. Shelf-life prediction of fresh blood orange juice[J]. Journal of Food Engineering,2005,70(4):512-517.
[9]徐程,余小林,胡卓炎,等. 3个品种荔枝果汁贮藏过程中的非酶褐变机理研究[J]. 食品与发酵工业,2010,36(9):175-180.
[10]Yang J,Gadi R,Paulino R,et al. Total phenolics,ascorbic acid and antioxidant capacity of noni(MorindacitrifoliaL.)juice and powder as affected by illumination during storage[J]. Food Chemistry,2010,122(3):627-632.
[11]刘学芝,何强,孔祥虹,等. 固相萃取-超高效液相色谱法测定浓缩石榴汁中羟甲基糠醛含量[J]. 食品工业科技,2013,34(10):62-64.
[12]Zielinski AAF,Haminiuk CWI,Nunes CA,et al. Chemical composition,sensory properties,provenance,and bioactivity of fruit juices as assessed by chemometrics:A Critical review and guideline[J]. Comprehensive Reviews in Food Science and Food Safety,2014,13(3):300-316.
[13]Vervoort L,Grauwet T,Kebede B T,et al. Headspace fingerprinting as an untargeted approach to compare novel and traditional processing technologies:A case-study on orange juice pasteurization[J]. Food Chemistry,2012,134(4):2303-2312.
[14]Ros-Chumillas M,Belissario Y,Iguaz A,et al. Quality and shelf life of orange juice aseptically packaged in PET bottles[J]. Journal of Food Engineering,2007,79(1):234-242.
[15]Pénicaud C,Broyart B,Peyron S,et al. Mechanistic model to couple oxygen transfer with ascorbic acid oxidation kinetics in model solid food[J]. Journal of Food Engineering,2011,104(1):96-104.
[16]侯雪,李喜宏,王思新,等. 包装材料对苹果浓缩汁贮藏期非酶褐变的影响[J]. 食品科技,2012(4):12-14.
[17]Zhang X,Tao N,Wang X,et al. The colorants,antioxidants,and toxicants from non-enzymatic browning reactions and the impacts of dietary polyphenols on their thermal formation[J]. Food & Function,2015,6(2):345-355.
[18]Van Bree I,Baetens J M,Samapundo S,et al. Modelling the degradation kinetics of vitamin C in fruit juice in relation to the initial headspace oxygen concentration[J]. Food Chemistry,2012,134(1):207-214.
[19]Zhang R,Zeng Q,Deng Y,et al. Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in Southern China[J]. Food Chemistry,2013,136(3-4):1169-1176.
[20]Bharate SS,Bharate SB. Non-enzymatic browning in citrus juice:chemical markers,their detection and ways to improve product quality[J]. Journal of Food Science and Technology,2014,51(10):2271-2288.
[21]Quitão-Teixeira L J,Aguiló-Aguayo I,Ramos A M,et al. Inactivation of oxidative enzymes by high intensity pulsed electric field for retention of color in carrot juice[J]. Food and Bioprocess Technology,2008,4(1):364-373.
