不同干燥方法对黄精干燥特性和品质的影响
2018-04-26衡银雪郑旭煦殷钟意边凤霞刘丹丹
衡银雪,郑旭煦,殷钟意,边凤霞,刘丹丹
(重庆工商大学环境与资源学院,重庆 400067)
黄精(PoLygonatumsibiricum)是一种多年生草本植物,具有宽中益气、滋补强身的养生功效。从古至今,黄精作为药材,熬制成汤,用以治疗各种疾病;或作为食材,烹制成具有特殊疗效的药膳,被广泛应用于人们的日常生活之中。黄精多糖是黄精中含量最多的活性成分[1],具有抗衰老[2]、抗肿瘤[3]、降血糖和血脂[4]及抗动脉粥样硬化、治疗糖尿病[5]等药理作用。此外,酚类化合物、皂苷类化合物是黄精含量较多的活性成分。
迄今为止,黄精产地加工主要采用自然晒干方法。受天气和晾晒条件的影响,该法得到的黄精干燥产品的品质不高,不仅存在易发霉变质和遭受虫蛀问题,而且还可能存在因晾晒时间过长导致活性成分损失较大的问题。为减少活性成分的损失,需要探究新的黄精干燥方法。但文献显示,随着干燥和炮制时间的延长,黄精中将产生5-羟甲基糠醛(5-HMF)等对人体健康有危害的物质[6],摄入过量5-HMF会对人体的肝脏、肾脏造成不良影响[7]。为此,本文旨在通过比较微波真空干燥法、自然晒干燥法、微波干燥法、真空干燥法、热风干燥法5种方法对黄精多糖、酚类化合物、皂苷类化合物和5-羟甲基糠醛含量以及多糖活性的影响,为获得高品质黄精的干燥方法提供实验依据。
1 材料与方法
1.1 材料与仪器
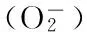
高效液相色谱仪126P/166P 美国贝克曼库尔特有限公司;UV-1900紫外可见分光光度计 翱艺仪器(上海)有限公司;101-OA电热恒温鼓风干燥箱 天津市泰斯特仪器有限公司;WBZ-10PLC微波真空干燥机 贵阳新奇微波工业有限责任公司;INFINITE-200酶制仪 Tecan Austria GmbH;移液器 四川吉尔森仪器有限公司;KQ5200DA超声波清洗仪 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 干燥方法的操作步骤 将鲜黄精洗净后,切除霉变部分,刀切成厚约0.5 cm左右的片状,并将鲜黄精片于-4 ℃贮存备用。不同干燥方法的操作步骤如下。
1.2.1.1 微波真空干燥法 将1000 g鲜黄精片均匀铺放于微波真空干燥机的物料箱内,在温度为(47±3) ℃、厚度为1 cm、真空度为0.08 MPa、平均微波功率为1.5 kW的条件下干燥55 min,实验条件由前期预实验所得。
1.2.1.2 自然晒干法 将500 g鲜黄精片平铺于100目筛子里,放于阳光强烈照射的天台上干燥约3~4 d。
1.2.1.3 微波干燥法 将1000 g鲜黄精片均匀平铺于微波真空干燥仪的物料盘中,不启动真空,在温度为(42±3) ℃、微波功率为0.5 kW的条件下干燥165 min,实验条件由前期预实验所得。
1.2.1.4 真空干燥法 将300 g鲜黄精片平铺于真空干燥仪的物料盘内,在温度为60 ℃、真空度为0.09 MPa的条件下干燥135 min[8]。
1.2.1.5 热风干燥法 将300 g鲜黄精片均匀铺在电热恒温鼓风干燥箱内,在温度为75 ℃、在风机频率为50 Hz·s-1的条件下干燥120 min[9]。
待干燥结束后(样品含水率低于10%),分别将不同干燥方法所得的黄精干燥产品粉碎,且过180目筛,备用。
1.2.2 黄精干燥曲线的绘制 分别采用微波真空干燥法、自然晒干法、微波干燥法、真空干燥法和热风干燥法5种方法对同一批次的鲜黄精片进行干燥,每隔一段时间取样测定黄精片含水率,其含水率测定按照国标法(GB/T 5009.3-2010)[10],以干燥时间为横坐标,含水率为纵坐标绘制曲线。
1.2.3 黄精多糖含量及其抗氧化活性的测定
1.2.3.1 黄精多糖待测液的制备 参考陶淘的提取方法[11],准确称取黄精干燥样品粉末2.00 g,加入20 mL蒸馏水,于锥形瓶中在功率为200 W的条件下超声40 min;取混合液进行真空抽滤,得澄清溶液,用蒸馏水定容于25 mL容量瓶中;再移取5 mL澄清液于试管中,加入20 mL无水乙醇,振荡混匀,静置30 min后放入4000 r·min-1的离心机中离心5 min;取沉淀溶于10 mL水中制成黄精多糖水溶液A。并将沉淀干燥后,取其多糖制成浓度为20 mg·mL-1的黄精多糖溶液B。
1.2.3.2 黄精多糖溶液A中黄精多糖含量的测定 参考张静的测定方法[12],以葡萄糖标准品绘制标准曲线,测得葡萄糖浓度X和吸光度值Y在浓度范围为0~32 mg·mL-1内存在良好线性关系,其线性回归方程式为Y=5.7224X+0.1689,相关系数R2=0.9991。按黄精多糖溶液A∶6%苯酚∶硫酸=1∶1∶5的比例添加试剂,加热10 min后冷却至室温,用蒸馏水稀释10倍,于490 nm下测定吸光度,计算多糖含量。
1.2.3.3 FRAP值的测定 取黄精多糖溶液B,按照试剂盒说明书方法测定,以FeSO4·7H2O为标准品绘制标准曲线,测得FeSO4·7H2O浓度X和吸光度值Y之间的线性回归方程式为Y=0.1046X+0.0594,相关系数R2=0.9996。样品溶液实验所得结果以FeSO4标准浓度(mmol/L)表示。
1.2.3.4 对超氧阴离子自由基清除能力的测定 取黄精多糖溶液B,按照试剂盒说明书方法测定,以抑制率衡量抗氧化能力大小。
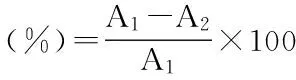
式中:A1为空白溶液的吸光度;A2为样品上溶液的吸光度。
1.2.4 总酚含量的测定 准确称取不同干燥方法黄精干燥样品粉末1.00 g,加入20 mL体积分数为70%乙醇溶液,超声提取30 min后;再经 4000 r·min-1离心8 min,取上清液定容于25 mL容量瓶,作为样品待测液C。
参考焦劼[13]的测定方法,以没食子酸为标准品绘制标准曲线,测得没食子酸浓度X和吸光度值Y在浓度为10~60 μg·mL-1范围内存在良好线性关系,线性回归方程式为Y=0.0019X-0.0045,相关系数R2=0.9994。测定时,准确移取样品待测液C的0.1 mL,加入3 mL水和10%福林酚溶液200 μL,静置10 min,加7.5%碳酸钠溶液500 μL,摇匀,避光静置1.5 h,在765 nm处测定吸光度,且重复实验3次。
1.2.5 总皂苷含量的测定 准确称取黄精干燥样品粉末1.00 g,加入20 mL体积分数70%乙醇溶液,60 ℃下超声提取3 h后,经4000 r·min-1离心8 min,取上清液定容于25 mL容量瓶,作为样品待测液D。
参照喻祖文[14]的测定方法对样品待测液D进行测定,且重复实验3次。以人参皂苷Rb1标准品绘制标准曲线,测得人参皂苷Rb1浓度X和吸光度值Y在浓度范围为16~83 μg·mL-1内存在良好线性关系,其线性回归方程式为Y=17.88X-0.112,相关系数R2=0.9984。
1.2.6 5-HMF含量的测定 参考杨云[15]的测定方法对样品待测液C进行测定,且重复实验3次。以5-HMF标准品绘制标准曲线,测得5-HMF浓度X和吸光度值Y在浓度为1~6 μg·mL-1范围内存在良好线性关系,线性回归方程式为Y=44.031X-0.6907,相关系数R2=0.9998;加标回收率为96.64%。
色谱条件:CoLumn:AQ-C18色谱柱(5 um,4.6 mm×250 mm);流动相:甲醇-水(13∶87),流速:1.0 mL/min,检测波长:280 nm,柱温:30 ℃,进样量:5 μL。
1.3 数据处理
每个样品设3个平行,采用Origin 8.5和SPSS Statistics软件进行数据处理。测定结果以平均值±标准方差表示。
2 结果与分析
2.1 不同干燥方法对黄精干燥曲线的影响
由图1可以看出,要使物料含水率达到10%以下,微波真空干燥法的干燥速率最大、干燥时间最短,其次是真空干燥法和热风干燥法,微波干燥法耗时较长。因自然晒干法要使黄精含水率<10%,需耗时3~4 d,所以不同干燥方法的干燥时间由小到大排序为:微波真空干燥法<热风干燥法<真空干燥法<微波干燥法<自然晒干法。

图1 不同干燥方法的干燥特性曲线Fig.1 Drying characteristic curves of different drying methods注:自然晒干法需耗时3~4 d,无法在同一坐标系中绘制。
2.2 不同干燥方法对黄精多糖含量及其抗氧化活性的影响
2.2.1 不同干燥方法对黄精多糖含量的影响 由图2可知,不同干燥方法制得的黄精干燥产品的黄精多糖含量从小到大的顺序为:热风干燥法<自然晒干法<微波干燥法<真空干燥法<微波真空干燥法。经计算,微波真空干燥法的黄精多糖含量最多,达(63.59±1.25) mg·g-1;热风干燥法的黄精多糖含量最少,为(34.30±0.54) mg·g-1。

图2 不同干燥方法对黄精多糖含量的影响Fig.2 Effect of different drying methods on the content of polysaccharides注:1:微波真空干燥法;2:自然晒干法;3:微波干燥法;4:真空干燥法;5:热风干燥法;图3、图4同。
2.2.2 不同干燥方法对黄精多糖的FRAP值影响 由图3可知,不同干燥方法制得的黄精干燥产品的FRAP值大小顺序为:微波真空干燥法>自然晒干法>真空干燥法>微波干燥法>热风干燥法。

图3 不同干燥方法对黄精多糖FRAP值的影响Fig.3 Effect of different drying methods on the FRAP values of polysaccharides
2.2.3 不同干燥方法的对黄精多糖的超氧阴离子自由基清除能力的影响 由图4可知,不同干燥方法所得的黄精干燥产品的多糖清除超氧阴离子自由基能力的顺序为:微波真空干燥法>自然晒干燥法>真空干燥法>微波干法燥>热风干燥法,与FRAP值排序相同,其抑制率分别为(30.01%±1.3%)、(25.14%±0.5%)、(19.18%±1.2%)、(13.83%±0.7%)、(11.71%±1.1%)。综合图3~图4的结果可知,微波真空干燥法所得黄精干燥产品中的黄精多糖抗氧化活性最强,热风干燥法所得黄精干燥产品中的黄精多糖抗氧化活性最弱。
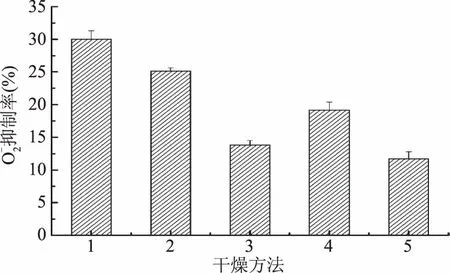
图4 不同干燥方法对黄精多糖清除超氧阴离子自由基能力的影响Fig.4 Effect of different drying methods on the capability of polysaccharide to scavenge superoxide anion free radical
综合图2~图4可知,自然晒干法因晾晒时间长,紫外照射和微生物代谢使黄精多糖含量受到较大损失,但对多糖抗氧化活性影响较小;热风干燥法因干燥温度最高,干燥时间较长,造成黄精多糖大量损失,抗氧化活性大幅降低。真空干燥法的温度较热风干燥法低,有效地减小了多糖的损失,提高多糖的抗氧化活性。微波干燥法的微波具有穿透性,能使介质内外同时加热,传热速度快,干燥温度最低,所以该法得到的黄精多糖含量较高,但长时间微波辐射可能导致多糖分子内的极性键极化,进而降低多糖的抗氧化活性。微波真空干燥法的干燥速率最大、干燥时间最短,较高的真空度既加速水分的蒸发又在一定程度上避免了活性成分的氧化,所以黄精多糖含量损失最小,多糖抗氧化活性最高。
2.3 不同干燥方法对黄精总酚、总皂苷和5-羟甲基糠醛含量的影响
由表1可知,热风干燥法所得的黄精干燥产品中总酚含量最低,微波真空干燥法最高,是热风干燥法样品的3.14倍。总皂苷含量从小到大的顺序为:自然干燥法<热风干燥法<真空干燥法<微波真空干燥法<微波干燥法,这是因为皂苷含量易受温度的影响,除自然晒干法外,其含量降低顺序与加热温度升高顺序密切相关。5-HMF的含量从小到大的顺序为:自然干燥法<真空干燥法<微波真空干燥法<热风干燥法<微波干燥法,其中,微波真空干燥法所得黄精干燥产品中的5-HMF含量较少。

表1 不同黄精干燥样品中总酚、总皂苷和5-羟甲基糠醛的含量Table 1 content of total phenolics,total saponins and 5-hydroxymethylfurfural in different dried semen
自然晒干法因晾晒时间长,使多酚和皂苷受到较大损失,但较低的温度条件使黄精中5-HMF生成量最少。热风干燥法因干燥温度最高,造成酚类和皂苷类物质受损较大,较高的温度还加速了5-HMF的生成。真空干燥法的温度较热风干燥法的温度低,对皂苷类化合物含量、5-HMF生成量的影响较小,真空环境还避免了酚类物质的氧化,减小酚类物质的损失。微波干燥法因温度最低,皂苷类化合物受损最小;但该法干燥时间较长,使黄精切片长时间与空气接触而造成酚类物质氧化,长时间受热也增大了5-HMF的生成量。微波真空干燥法集成了真空干燥法和微波干燥法的优点,较高的真空度既加速水分的蒸发又在一定程度上避免了活性成分的氧化,所以酚类物质和皂苷类化合物损失近乎最小,5-HMF的生成量较少。
3 结论
五种干燥方法因其干燥原理不同,干燥环境不同,对黄精干燥曲线影响也不同,所用干燥时间由小到大排序为:微波真空干燥法<75 ℃热风干燥法<60 ℃真空干燥法<微波干燥法<自然晒干法;而且不同干燥方法对黄精中多糖、总酚、总皂苷、5-HMF含量的影响也不同,相比而言,微波真空干燥法更能有效保留黄精中的多糖、酚类化合物、皂苷类化合物等活性成分,5-HMF生成量较少,其干燥品中黄精多糖含量达(63.59±1.25) mg·g-1,该多糖对超氧阴离子自由基的抑制率达(30.01%±1.3%)。提示微波真空干燥法更适于得到高品质的黄精干燥产品。
[1]Cheng M E,Wang D Q. Anatomical structure and his to chemical localization about rhizomes of five species ofPolygonatum[J]. Chin J Chin Materia Med,2013,38(13):2068-2072.
[2]刘萍. 黄精多糖对老龄大鼠老化相关酶的影响[J]. 华西医学,2010,25(7):1259-1261.
[3]Wang S,Yu Q,Bao J,et al.Polygonatumcyrtonema lectin,a potential antineoplastic drug targeting programmed cell death pathways[J]. Biochemical and Biophysical Research Communications,2011,406(4):497.
[4]王艺,彭国庆,江新泉,等.黄精多糖对糖尿病大鼠模型的保护机制研究[J].中医药导报,2017(2):8-16.
[5]Li D,Jing M N. Preliminary study of anα-glucosidase inhibitor from the roots and stems ofPolygonatumsibiricumred[J]. Asian Journal of Traditional Medicines,2008,3(5):179-185.
[6]曾林燕,宋志前,魏征,等.黄精炮制过程中新产生成分分离及含量变化[J].中草药,2013,44(12):1584-1588.
[7]张玉玉,宋弋,李全宏.食品中糠醛5-羟甲基糠醛的产生机理、含量检测及安全性评价研究进展[J].食品科学,2012,33(5):275-280.
[8]韩燕全,洪 燕,左 冬,等.不同干燥工艺干姜的UPLC特征指纹图谱比较研究[J].中成药,2012,34(6):987-990.
[9]李维新,董铁生,何志刚,等.真空浓缩糖液渗糖及热风干燥对糖浆含量的影响[J].福建农业学报,2011,21(5):837-841.
[10]GB/T 5009.3-2010,食品中水分的测定[S].
[11]陶涛,李立祥,张芳,等.超声波协同纤维素酶对黄精多糖和皂苷的提取研究[J].食品工业科技,2012,33(9):271-275.
[12]张静,张艳贞,陈文,等.四产地黄精中多糖含量及抗氧化活性比较[J].食品工业科技,2013,34(2):147-148.
[13]焦劼,陈黎明,孙瑞泽,等.不同产地黄精主要化学成分比较及主成分分析[J].中药材,2016,39(3):519-522.
[14]喻祖文,张旺凡.多倍体黄精中多糖和皂苷的提取及含量测定[J].中国现代中药,2011,13(5):20-22.
[15]杨云,许闽,冯云霞,等.黄精不同炮制品中5-羟甲基糠醛的含量测定[J].中药材,2008,31(1):17-19.
