新辅助化疗及营养支持治疗胃癌合并幽门梗阻一例
2018-04-26杨东郑志超赵岩张涛刘勇
杨东,郑志超,赵岩,张涛,刘勇
胃癌是我国常见的消化道肿瘤之一,发病率、死亡率均较高,80%的患者确诊时已为进展期,仅半数患者可获根治性手术,且总体预后不良[1-2]。进展期远端胃癌常伴有幽门梗阻,导致患者出现营养不良和生活质量下降[3]。进展期胃癌行新辅助化疗可有效降期,并提高手术切除率,其已获得高级别临床证据[4-13]。进展期胃癌伴幽门梗阻,通常被认定为手术适应证,对于这部分患者采用直接手术治疗,可能失去有效降期及根治性切除的机会。本例进展期胃癌伴幽门梗阻患者在多学科协作组(multidisciplinary team,MDT)讨论后给予营养支持的同时试用新辅助化疗,在改善患者营养不良的同时获得了有效降期,幽门梗阻缓解,手术根治性切除的良好疗效,故现将治疗方法及体会总结如下。
1 病例报告
患者 男,63岁,主因呕吐伴上腹不适2周,于2017年3月5日就诊于我院。患者2周前出现上腹不适伴呕吐,呕吐物为进食食物,偶有反酸、烧心,无呕血、黑便,于2017年2月24日就诊于沈阳医学院附属第二医院消化内科门诊,胃镜示:“胃窦近幽门见一溃疡病变;表面有破溃、糜烂、出血;幽门变形,胃镜无法通过”。病理示:“不排除未分化癌及淋巴瘤或组织细胞的炎症反应”。为进一步诊治,以“胃占位性病变,幽门梗阻”为诊断入我科。患者既往平素身体健康;否认家族肿瘤病史。入院查体:上腹部及脐周轻压痛,无反跳痛。实验室检查:血红蛋白105 g/L;血钾3.29 mmol/L;肿瘤标志物未见异常:糖类抗原12 524.3 U/mL,糖类抗原19 924.65 U/mL,癌胚抗原3.32 U/mL,甲胎蛋白11.01 U/mL。入院复查胃镜检查提示:“胃窦远端见溃疡性肿物假幽门形成,大小约5.0 cm×4.0 cm,病变下缘累及幽门,胃镜无法通过”。病理活检提示:“胃窦低分化腺癌”。超声胃镜检查提示:胃窦病变处胃壁破坏代之以低回声肿块影,回声不均匀,肿物侵透浆膜层,胃周可见肿大淋巴结影。增强CT示:胃窦占位,胃壁浆膜面毛糙,胃周多发肿大淋巴结,见图1。入院诊断“胃恶性肿瘤(T4aN+M0Ⅲ期)、幽门梗阻”,患者整体营养状况主观评估(PG-SGA)评分7分,营养风险筛查表(NRS 2002)评分3分。经MDT讨论后,入院第10天在营养支持治疗基础上给予新辅助化疗,获知情同意后,给予化疗(XELOX方案,卡培他滨1 000 mg/m2,奥沙利铂130 mg/m2,体表面积:1.78 m2)及鼻空肠营养管肠内营养支持治疗,治疗1周期后患者自行拔除营养管,经口进食无不适。治疗2周期后复查胃镜:胃窦病变局部可见瘢痕样改变,胃镜可通过。增强CT:与治疗前对比,胃窦病灶变薄,胃周肿大淋巴结较前缩小。根据肿瘤缓解标准RESIST 1.1进行评估疾病达部分缓解(PR)。考虑患者目前治疗有效,继续行化疗,2周期后复查胃镜:胃窦可见结节样改变,局部可见瘢痕样改变。增强CT:胃窦病灶进一步缩小,胃周淋巴结进一步缩小。疾病评估达PR,依据病情于2017年7月11日全麻下行根治性远端胃大部切除,Billroth-Ⅱ式消化道重建。术后恢复顺利,术后病理:胃窦腺癌,低分化,浸润浆膜,化疗后反应TRG2 级(Mandard 系统[14]),Lauren 分型:弥漫型,淋巴结见转移癌 4/37。免疫组织化学染色:CK(+),CK8/18(+),Vim(-),Ki67约20%~30%(+)。术后继续给予辅助化疗4周期(XELOX方案,卡培他滨1 000 mg/m2,奥沙利铂130 mg/m2,体表面积:1.75 m2)。术后3个月复查胃镜:胃毕-Ⅱ式术后,残胃体黏膜充血,吻合口黏膜光滑,吻合口通畅。增强CT:胃术后改变,腹部可见多处吻合口影,左腹部结构稍紊乱,胃周、肝门未见肿大淋巴结。
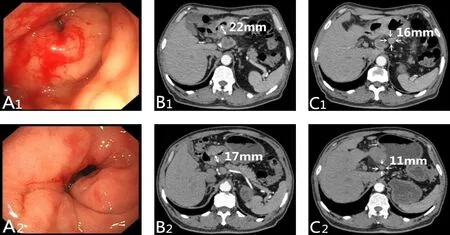
Fig.1 Imaging comparison before and after neoadjuvant chemotherapy图1 新辅助化疗前后影像学对比
2 讨论
进展期胃癌伴幽门梗阻通常被认为是手术适应证。自从1989年将新辅助化疗用于治疗晚期胃癌患者以来,随着大量高级别临床试验结果的发表,目前新辅助化疗在国际上已经成为进展期胃癌综合治疗的主要手段,并取得显著的疗效,而且新辅助化疗并不会增加手术并发症的发生率[4-13]。胃癌伴幽门梗阻的患者采用直接手术治疗,可能失去有效降期及根治性切除的机会,但患者多在入院时已不能正常进食,存在明显营养风险,很难耐受新辅助化疗。有研究报道营养支持可以明显改善胃癌伴幽门梗阻患者的营养状态,提高其生活质量,有助于新辅助化疗的实施[15]。随着内镜技术的不断发展,内镜下置入鼻肠营养管、金属支架等,使得幽门梗阻患者能够获得确切营养支持,特别是肠内营养支持(enteral nutrition,EN)[16]。EN 具有保护肠黏膜屏障功能、减少细菌易位、促进患者胃肠道功能恢复、预防肠源性感染的作用[17],因而是优先推荐的营养支持方式。准确评估患者的营养状态可干预制订相应的营养治疗方案,提高患者生活质量,改善预后[18]。目前评估患者营养状态的方法很多,而对于肿瘤患者来说,美国营养师协会(ADA)、中国抗癌协会肿瘤营养与支持治疗专业委员会推荐应用PG-SGA评估法。
基于上述研究,本例患者入院时PG-SGA评分为7分,按照营养风险评估已达中度营养风险,应进行营养支持治疗,并在内镜技术的支持下给予肠内营养治疗。在给予营养支持的同时试用新辅助化疗,与既往直接手术的病例比较,此例患者在改善营养不良的同时获得了有效降期,幽门梗阻缓解,手术根治性切除的良好疗效。本例患者新辅助化疗期间未出现明显化疗不良反应,术后未出现明显并发症,这与治疗前给予肠内营养有直接关系,与相关文献报道结果一致[15-17]。本例报告局限之处在于,营养指标、手术并发症、病理缓解率等指标均为近期指标,生存率、无病生存率等远期指标并未涉及,仍有待随访进一步验证。
[1]Jiao X,Zhou Y.Investigation of the potential role of preoperative chemotherapy in treatment for gastric cancer with outlet obstruction[J].Mol Clin Oncol,2015,3(5):1177-1183.doi:10.3892/mco.2015.587.
[2]孙元水,许晓东,胡俊峰,等.新辅助化疗联合营养支持在胃癌伴幽门梗阻患者的应用[J].中华医学杂志,2014,94(8):584-586.Sun YS,Xu XD,Hu JF,et al.Efficacies of neoadjuvant chemotherapy plus nutritional support in advanced gastric cancer complicated with pylori obstruction[J].Natl Med J China,2014,94(8):584-586.doi:10.3760/cma.j.issn.0376-2491.2014.08.007.
[3]Thirion PG,Michiels S,Le Maitre A,et al.Individual patient data based meta-analysis assessing pre-operative chemotherapy in resectable oesophageal carcinoma[J].Asco Meeting Abstracts,2007,25(18):4512.
[4]Xu AM,Huang L,Liu W,et al.Neoadjuvant chemotherapy followed by surgery versus surgery alone for gastric carcinoma:systematic review and meta-analysis of randomized controlled trials[J].PLoS One,2014,9(1):e86941.doi:10.1371/journal.pone.0086941.
[5]Yoshikawa T,Tanabe K,Nishikawa K,et al.Induction of a pathological complete response by four courses of neoadjuvant chemotherapy for gastric cancer:early results of the randomized phase Ⅱ COMPASS trial[J].Ann Surg Oncol,2014,21(1):213-219.doi:10.1245/s10434-013-3055-x.
[6]Cho H,Nakamura J,Asaumi Y,et al.Long-term survival outcomes of advanced gastric cancer patients who achieved a pathological complete response with neoadjuvant chemotherapy:a systematic review of the literature[J].Ann Surg Oncol,2015,22(3):787-792.doi:10.1245/s10434-014-4084-9.
[7]Yoshikawa T,Rino Y,Yukawa N,et al.Neoadjuvant chemotherapy for gastric cancer in Japan:a standing position by comparing with adjuvant chemotherapy[J].Surg Today,2014,44(1):11-21.doi:10.1007/s00595-013-0529-1.
[8]Sherman KL,Merkow RP,Bilimoria KY,et al.Treatment trends and predictors of adjuvant and neoadjuvant therapy for gastric adenocarcinoma in the United States[J].Ann Surg Oncol,2013,20(2):362-370.doi:10.1245/s10434-012-2552-7.
[9]Wilke H,Preusser P,Fink U,et al.Preoperative chemotherapy in locally advanced and nonresectable gastric cancer:a phaseⅡstudy with etoposide,doxorubicin,and cisplatin[J].J Clin Oncol,1989,7(9):1318-1326.doi:10.1200/JCO.1989.7.9.1318.
[10]Tsuburaya A,Mizusawa J,Tanaka Y,etal.Neoadjuvant chemotherapy with S-1 and cisplatin followed by D2 gastrectomy with para-aortic lymph node dissection for gastric cancer with extensive lymph node metastasis[J].Br J Surg,2014,101:653-660.doi:10.1002/bjs.9484.
[11]Hirakawa M,Sato Y,Ohnuma H,et al.A phase Ⅱ study of neoadjuvant combination chemotherapy with docetaxel,cisplatin,and S-1 for locally advanced resectable gastric cancer:Nucleotideexcision repair(NER)as potential chemoresistance marker[J].Cancer Chemother Pharmacol,2013,71:789-797.doi:10.1007/s00280-013-2073-5.
[12]Valenti V,Hemandez-Lizoaln JL,Beorlegui MC,et al.Morbidity,mortality,and pathological response in patients with gastric cancer preoperatively treated with chemotherapy or chemoradiotherapy[J].J Surg Oncol,2011,104:124-129.doi:10.1002/jso.21947.
[13]Conroy T,Galais MP,Raoul JL,et al.Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer(PRODIGE5/ACCORD17):final results of a randomised,phase 2/3 trial[J].Lancet Oncol,2014,15(3):305-314.doi:10.1016/S1470-2045(14)70028-2.
[14]Mandard AM,Dalibard F,Mandard JC,et al.Pathologic assessment oftumorregression afterpreoperative chemoradiotherapy of esophageal carcinoma.Clinicopathologic correlations[J].Cancer,1994,73(11):2680-2686.
[15]Wang ZM,Li GL,Wang ZL,et al.Application of enteral nutrition support in patients with gastric cancer with outlet obstruction[J].J Med Postgrad,2010,23:1182-1183.
[16]Fiori E,Lamazza A,Demasi E,et al.Endoscopic stenting for gastric outlet obstruction in patients with unresectable antro pyloric cancer.Systematic review of the literature and final results of a prospective study.The point of view of a surgical group[J].Am J Surg,2013,206(2):210-217.doi:10.1016/j.amjsurg.2012.08.018.
[17]Li B,Liu HY,Guo SH,et al.Impact of early postoperative enteral nutrition on clinical outcomes in patients with gastric cancer[J].Genet Mol Res,2015,14(2):7136-7141.doi:10.4238/2015.June.29.7.
[18]Choi WJ,Kim J.Nutritional care of gastric cancer patients with clinical outcomes and complications:A review[J].Clin Nutr Res,2016,5(2):65-78.doi:10.7762/cnr.2016.5.2.65.
