内镜黏膜下剥离术治疗结直肠黏膜下肿瘤的疗效分析
2018-04-25颜小丹周金虎张金顺王超张玉叶丽萍
颜小丹,周金虎,张金顺,王超,张玉,叶丽萍
(温州医科大学附属台州医院 消化内科,浙江 临海 317000)
消化道黏膜下肿瘤是一类起源于黏膜上皮层以下组织的由多种病变共同组成的一大类消化道疾病,临床上常见的包括具有恶变倾向的神经内分泌肿瘤、胃肠间质瘤等,也包括会逐渐增大,并对邻近脏器会产生一定压迫并引发一系列临床症状的良性肿瘤,如脂肪瘤等[1]。随着医学的发展,消化道病变的内镜下治疗技术越来越成熟。从传统的内镜下黏膜切除术(endoscopic mucosal resection,EMR)发展而来的内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)可以整块切除较大的黏膜层及黏膜下层病变,越来越被大家所熟悉及使用[2-3]。本文回顾分析了本科2011年1月-2017年1月对67例结直肠黏膜下肿瘤行ESD治疗的病例数据,来评估其疗效和安全性。现报道如下:
1 资料与方法
1.1 一般资料
收集2011年1月-2017年1月在浙江省台州医院消化内镜中心行ESD治疗的结直肠黏膜下肿瘤的患者67例。其中,男39例,女28例;中位年龄51岁(19~76岁)。病灶68处,症状无特异性,排便习惯及性状改变21例(31.3%),腹痛腹胀16例(23.9%),便血4例(6.0%),无症状22例(32.8%);肠镜检查时同时发现合并结直肠息肉的22例(32.8%)。所有病灶均经术后病理证实。术前常规行血生化、血常规、凝血功能、心电图、胸片、腹部CT或B超等检查,排除内镜检查及治疗的禁忌证,并排除术前明确有转移的患者,术前签署知情同意书,告知患者手术的必要性、优势及风险。
1.2 器械
Olympus CF-Q260电子肠镜;EU-M30内镜超声系统;ERBE ICC 200高频电切装置、APC 300氩离子凝固器;NM-4L-1注射针、Olympus IT刀(KD-611L)、Hook刀(KD-620LR),夹子装置本体为Olympus HX-110UR型及HX-110QR型,HX-610-135止血钛夹,FD-1U-1热活检钳,电圈套器为Olympus SD-221U-25型、SD-230U-20型,透明帽(D-201-13404)。ESD治疗全程采用注入二氧化碳CO2代替空气。
1.3 治疗方法
1.3.1 术前肠道准备 予复方聚乙二醇电解质散3包或33.00%硫酸镁溶液200 ml口服,再饮水3 000 ml,至解清水样大便,如肠道准备不充分,必要时可增加清肠药物。术前不常规使用抗生素。
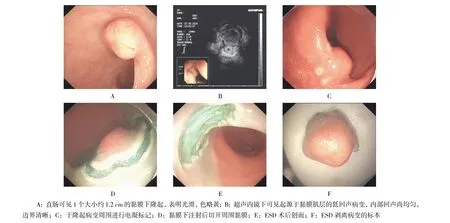
附图 直肠黏膜下肿瘤ESD切除图像Attached fig. Images of ESD for rectal submucosal tumor
1.3.2 ESD治疗方法 直肠黏膜下肿瘤ESD切除过程见附图。①标记:于隆起性病灶边缘用APC进行电凝标记;②黏膜下注射:1∶10 000肾上腺素生理盐水或0.02%亚甲蓝溶液于隆起性病灶的边缘标记点的外侧进行多点黏膜下注射;③切开病灶外侧缘黏膜:应用Hook刀沿着病灶边缘标记点切开黏膜;④剥离病变:应用Hook刀或IT刀切开黏膜下层显露病变,在病变的边缘及基底对病变进行逐渐剥离至完整切下,在剥离过程中视情况重复进行黏膜下注射;⑤创面处理:对于创面可见的小血管,予APC或热活检钳电凝止血,视情况予止血钛夹夹闭或缩小创面;对于有穿孔的创面,尽量内镜下止血钛夹夹闭或联合尼龙绳封闭创面。
1.4 术后处理及随访
术后第1天常规禁食,观察有无消化道出血、穿孔等症状,不常规使用抗生素,第2天如无出血、腹痛等情况,可进流质,第3天进软食。视术后病理情况处理,如术后病理为可疑恶性倾向的病变,如神经内分泌肿瘤,术后3、6和12个月常规复查结肠镜,以后每年随访1次,随访病变有无残留或复发情况,术后每年不定期随访腹部超声等情况。复发转移情况通过出院后门诊复查及电话随访获得。
2 结果
2.1 超声内镜下表现
本研究67例患者共68处病灶,其中有1例患者为2处病灶。68处病灶中,行超声内镜检查46处,位于黏膜肌层6处(13.1%),黏膜下层38处(82.6%),固有肌层2处(4.3%),低回声31处(67.4%),高回声13处(28.3%),无回声2处(4.3%)。
2.2 结直肠黏膜下肿瘤发生部位、大小与病理类型的关系
本组68处病灶中,组织学方面:神经内分泌肿瘤42处(61.8%),胃肠间质瘤1处(1.5%),颗粒细胞瘤1处(1.5%),脂肪瘤20处(29.4%),淋巴管瘤2处(2.9%),囊肿2处(2.9%)。分布部位:直肠44处(64.7%)居多,左半结肠8处(11.8%),右半结肠16处(23.5%);42处神经内分泌肿瘤位于直肠41处,以直肠分布为主,20处脂肪瘤位于结肠18处,以结肠分布为主。本组资料中显示肿瘤长径为3~50 mm,平均(11.9±1.0)mm;其中<10 mm有44处(64.7%),10~ 20 mm有 15处(22.1%), ≥ 20 mm的 9处(13.2%);神经内分泌肿瘤中不超过10 mm的有38处。
2.3 治疗及并发症情况
67例患者中,52例(77.6%)患者采用全身麻醉;住院费用(10 183.3±3 814.6)元;总住院天数(5.8±3.1)d。围手术期不常规抗感染治疗。并发症情况:有4例(6.0%)患者出现穿孔,其中1例术中发现穿孔,予钛夹及尼龙环夹闭,3例术后出现发热腹痛情况,查CT提示肠腔周围有游离气体,均予禁食抗感染等保守治疗数天后逐渐恢复饮食后好转出院;术后出血1例(1.5%),经再次内镜下止血术好转。所有病例均未因并发症转外科手术治疗。
2.4 病理及随访情况
68处病灶,ESD术全部整块切除,整块切除率100.0%,病理切缘阳性4处,病理完全切除率为94.1%;切缘阳性的4处全部为神经内分泌肿瘤。67例患者中,以2017年4月为随访终点,有64例患者随访,随访率95.5%,中位随访时间33个月(3~75个月)。3例失访,均为病理切缘阴性的患者。64例患者术后密切随访复查,均无复发及远处转移情况。
3 讨论
大部分结直肠黏膜下肿瘤缺乏特异性或根本无不适症状,本组患者中大部分症状不典型,其中32.8%为无症状的患者,所以其诊断主要靠肠镜检查发现。肠镜下结直肠黏膜下肿瘤一般表现为基底宽大、表面光滑、质地柔软、色泽同周围黏膜的球形或半球形隆起性病变,由于生长在黏膜上皮层以下,活检不容易取到肿物的病理组织,所以常规结肠镜检查很难对黏膜下肿瘤的起源和定性做出确切诊断[4]。有报道结直肠黏膜下肿瘤治疗前通过超声内镜对其大小及浸润深度进行判断,与术后的组织病理学所获得的结果相符率可达100.0%[4-5]。本组研究资料中,有46处病灶行超声肠镜检查,术后病理与术前超声诊断对于肿瘤浸润深度和大小的判断也是符合的。超声内镜下回声的强度对于黏膜下肿瘤性质的鉴别也尤为重要,超声内镜下神经内分泌肿瘤、间质瘤常为低回声结构,脂肪瘤常为高回声结构,囊肿、淋巴管瘤常为无回声结构。所以,超声内镜检查对于确定肿块浸润深度、大小及肿瘤性质判断是一个很好的方法[4,6]。
结直肠黏膜下肿瘤中,神经内分泌肿瘤、颗粒细胞瘤及胃肠道间质瘤都是有恶变倾向的[7-9]。针对不同性质的肿瘤有不同的治疗方法,以往常选择根治性的外科手术切除,较小的或考虑良性的瘤体常选择内镜监测随访[8]。但随着内镜技术的发展,目前内镜下切除早期的黏膜下肿瘤技术日趋成熟,从早期的圈套术、EMR术,到目前的ESD术。ESD最早是用于局限于黏膜层且无淋巴结转移的胃早癌的治疗[9]。与EMR相比,凭借着高的整块切除率及病理完整切除率,ESD有着更低的复发率[2]。但是因为它难度大,且容易穿孔,所以在一定程度上限制了其推广应用。本组67例患者中,穿孔率6.0%,均未予外科手术干预,所以说穿孔不是致命的并发症,比较明显的穿孔术中一般都能及时发现,有经验的医师用金属夹或联合尼龙环一般都能夹闭穿孔[9-10]。ESD术前都要进行肠道准备并且都是禁食状态,即使穿孔所致的腹膜炎体征往往也较轻,对于结直肠ESD术或预测穿孔风险较高的患者,往往对肠道准备的要求较严格,肠道准备不佳者,会追加清肠药物。另外本研究ESD治疗全程采用注入CO2代替空气,其对于加快腹腔气体的吸收速度及减少术后腹胀等情况有较好疗效。本组术后出血发生率1.5%(1/67),术后第3天再次行内镜下止血夹夹闭止血。近年来的内镜下全层切除术及OTSC金属夹的临床应用也为内镜下治疗结直肠黏膜下肿瘤提供更广阔的空间[11-12]。
结直肠黏膜下肿瘤中,有恶性倾向的神经内分泌瘤最常见,目前报道内镜下治疗结直肠神经内分泌肿瘤的相关研究也越来越多,有研究[13]通过较长时间的随访观察,提出ESD在治小于2.0 cm的直肠内分泌肿瘤中是有效和安全的。本研究68处病灶,结直肠内分泌肿瘤占42处,占61.8%,虽然有4处病理切缘阳性,但是随访过程中没有复发或转移的病例,这可能和本组资料中大部分的神经内分泌肿瘤都小于1.0 cm有关。所以对于此类肿瘤也提倡早期发现及早期治疗,预后可能相对较好。良性病变中,最常见的是脂肪瘤,本研究中脂肪瘤占29.4%,且以结肠分布为主,良性肿瘤如无症状可考虑内镜下随访,但是脂肪瘤逐渐增大时可能出现肠梗阻、肠套叠等情况,本组资料中有一个较大的约5.0 cm的脂肪瘤就出现了肠套叠,ESD术避免了外科手术治疗,提高了患者的生活质量。
综上所述,结直肠黏膜下肿瘤以直肠病变多见,肠镜检查时尤其要注意直肠病变的观察。超声内镜有助于黏膜下病变的诊断;对可疑恶性倾向的早期黏膜下肿瘤,尽早行ESD治疗是一个安全有效的治疗方法。
参 考 文 献:
[1]齐志鹏, 钟芸诗, 周平红,等.内镜切除结直肠黏膜下肿瘤临床病理学特征分析(附559例报告)[J]. 中国实用外科杂志, 2016,36(1): 115-118.
[1]QI Z P, ZHONG Y S, ZHOU P H, et al. Clinicpathological analysis of colorectal submucosal tumors: a report of 559 cases resected under endoscopic[J]. Chinese Journal of Practical Surgery, 2016,36(1): 115-118. Chinese
[2]LEE E J, LEE J B, LEE S H, et al. Endoscopic submucosal dissection for colorectal tumors-1000 colorectal ESD cases: one specialized institute’s experiences[J]. Surg Endosc, 2013, 27(1):31-39.
[3]KIM Y J, KIM E S, CHO K B, et al. Comparison of clinical outcomes among different endoscopic resection methods for treating colorectal neoplasia[J]. Dig Dis Sci, 2013, 58(6): 1727-1736.
[4]马玲玲, 孔文洁, 黄晓玲, 等. 经内镜微探头超声检查对直肠黏膜下肿物的诊断意义[J]. 中华消化内镜杂志, 2015, 32(11):758-759.
[4]MA L L, KONG W J, HUANG X L, et al. Endosonographic diagonosis of rectal submucosal tumors by ultrasound microprobe[J]. Chin J Dig Endoc, 2015, 32(11): 758-759. Chinese
[5]ISHII N, HORIKI N, ITOH T, et al. Endoscopic submucosal dissection and preoperative assessment with endoscopic ultrasonography for the treatment of rectal carcinoid tumors[J].Surg Endosc, 2010, 24(6): 1413-1419.
[6]ZHOU P, YAO L, HE G, et al. Clinical application of ultrasonic probing for preoperative staging of colorectal carcinoma[J]. Asian J Surg, 2003, 26(1): 13-16.
[7]2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组.中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志, 2013, 42(10): 691-694.
[7]Chinese Expert Group of Pathology of Gastrointestinal Neuroendocrine Tumors in 2013. Chinese pathological consensus for standard diagnosis of gastro-entero-pancreatic neuroendocrine tumors(2013)[J]. Chinese Journal of Pathology, 2013, 42(10): 691-694. Chinese
[8]陈天音, 周平红. 胃肠道间质瘤的微创手术治疗进展[J].中华消化内镜杂志, 2015, 32(11): 782-784.
[8]CHEN T Y, ZHOU P H. Progress in minimally invasive surgery of gastrointestinal stromal tumor[J]. Chin J Dig Endosc, 2015, 32(11):782-784. Chinese
[9]武逸人, 时强, 姚礼庆, 等. 内镜下切除结直肠颗粒细胞瘤11例临床分析[J]. 中华消化内镜杂志, 2016, 33(8): 555-557.
[9]WU Y R, SHI Q, YAO L Q, et al. Endoscopic excision for colorectal granular cell tumors: a report of 11 cases[J]. Chin J Dig Endosc,2016, 33(8): 555-557. Chinese
[10]YE L P, MAO X L, ZHENG H H, et al. Safety of endoscopic resection for duodenal subepithelial lesions with wound closure using clips and an endoloop:an analysis of 68 cases[J]. Surg Endosc, 2003, 31(3): 1070-1077.
[11]牛琼, 刘成霞, 王伟, 等. OTSC金属夹在封闭急性医源性消化道穿孔中的临床应用[J]. 中国内镜杂志, 2017, 23(1): 84-86.
[11]NIU Q, LIU C X, WANG W, et al. efficacy of OTSC closure to the acute iatrogenic gastrointestinal perforation[J]. China Journal of Endoscopy, 2017, 23(1): 84-86. Chinese
[12]ZHOU P H, YAL L Q, QIN X Y, et al. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria[J]. Surg Endosc,2011, 25(9): 2926-2931.
[13]CHEN T, YAO L Q, XU M D, et al. Efficacy and safety of endoscopic submucosal dissection for colorectal carcinoids[J].Clin Gastroenterol Hepatol, 2016, 14(4): 575-581.
