上消化道转移癌的内镜表现和临床病理分析(附10例报告)*
2018-04-25郑末张宝芹孙雅静孙光斌
郑末,张宝芹,孙雅静,孙光斌
(天津市第五中心医院 1.病理科;2.消化科,天津 300450)
恶性肿瘤严重威胁人类健康,并且发病率呈逐年上升趋势。消化道外恶性肿瘤转移至消化道并不常见,发生于上消化道的转移癌更为少见,特别是患者以转移灶引发的症状为首诊症状而就诊时,非常容易误诊为上消化道原发癌,致使错误的根治性手术治疗[1]。笔者收集3例上消化道转移癌病例,分析其内镜表现、病理及临床特征和治疗情况,并复习国内外相关文献报道7例,综合分析和认识上消化道转移癌的特征。现报道如下:
1 资料与方法
1.1 一般资料
本文收集自2016年-2017年在天津市第五中心医院以胃肠道表现为首发症状的上消化道转移癌患者的内镜和病理等资料,共3例。并检索相关文献中报道病例的内镜、病理等资料,检索策略:计算机检索PubMed、Web of Science、万方数据库和中国知网数据库,检索时间为2008年1月-2017年10月。英 文 检 索 词 :metastasis,upper gastrointestinal tract,endoscopy;中文检索词:转移癌,上消化道,内镜。检索过程以自由词联合主题词方式检索,同时检索收集文献的参考文献,以避免遗漏,共检索到7例[2-8]。我院诊治的3例患者,年龄分别为67、58和55岁,其中女1例,男2例。就诊时的临床表现均以消化道症状为主,病例1进食哽噎感2个月、上腹不适2周,呕血11 h来院就诊。病例2间断腹痛20余d,食欲减退伴进食哽噎感10余d,外院内镜检查考虑“胃癌”,但活检病理结果为“未见癌”,转至我院就诊。病例3因间断黑色不成形大便1个月,大便次数每日1或2次或7或8次不等,伴头晕、乏力,便常规示潜血(+)。其中病例3既往2年前曾于外院行影像学检查及穿刺活检诊断为肾细胞癌,进行靶向药物治疗有效,现已停药。其余2例无肿瘤既往史。文献检索到的7例患者,年龄30~81岁,多为中老年患者,男女都有,无明显性别差异,均以各种消化道不适症状而就诊,并且既往均无肿瘤病史,病变累及胃或十二指肠。
1.2 内镜资料分析
内镜资料分析内容包括:内镜所见病变部位、数量、形态、大小、病变表面情况、质地及是否伴有其他异常。
1.3 病理组织学检查和免疫组化染色
标本均经4%中性甲醛固定,常规脱水,石蜡包埋,4μm厚切片,HE染色,两位或两位以上病理医师光镜观察。免疫组化采用EnVision两步法,所用一抗 CD10、CK、CK7、CK20、CgA、EMA、HMB45、Ki67、NapsinA、Pax-8、P63、P40、RCC、S-100、Syn、TTF-1、Vimentin以及二抗均购自福州迈新生物技术开发有限公司。染色步骤按相关说明书进行。
1.4 观察指标
总结临床资料,包括患者的一般情况、主要临床表现、现病史、影像学检查结果及治疗情况等。
2 结果
2.1 内镜资料
2.1.1 本院收治的3例患者 3例患者均行内镜检查。病例1于食管距门齿25.0 cm处见一溃疡性病变,占据管腔2/3,覆污秽苔,触之易出血,质脆,未见其余异常。病例2于胃体上部大弯见一类圆形占位,直径约5.0 cm,中央略凹陷,浅溃疡形成,质脆,另距门齿35.0 cm处可见一外压性狭窄,该处黏膜无异常,内镜可通过。病例3于胃体大弯可见一广基息肉样肿物,约1.0 cm×1.0 cm,表面粗糙,触之易出血,质软,并于十二指肠球后见一广基息肉样肿物,大小约1.5 cm×1.5 cm,表面粗糙呈菜花状,触之易出血,质软。见图1。
2.1.2 检索到的7例患者 7例患者均以各种消化道不适症状而就诊,并且既往均无肿瘤病史,病变累及胃或十二指肠,内镜所见多为隆起型肿物,常伴糜烂或浅溃疡。
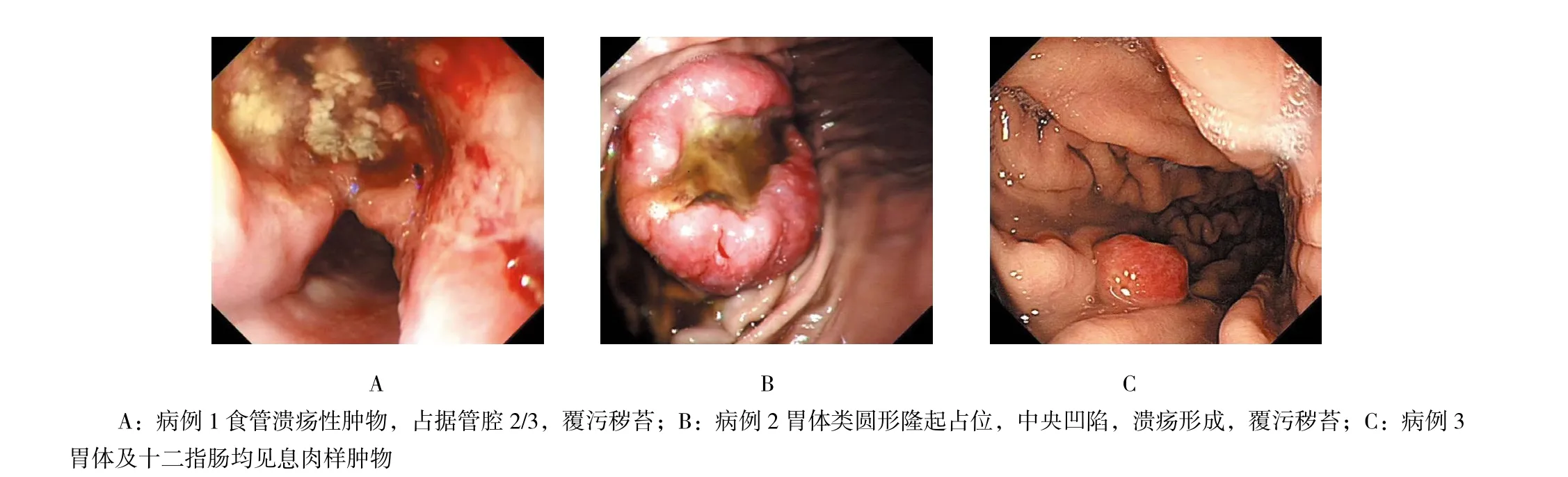
图1 上消化道转移癌的内镜检查Fig.1 Endoscopy of metastatic carcinoma of upper gastrointestinal tract
2.2 病理诊断资料
2.2.1 本院收治的3例患者 3例本院收治的病例病理诊断结果见图2和3。①病例1:肿瘤细胞分化差,异型性显著,与正常鳞状上皮无移行,免疫组化染色显示 CK(+),TTF-1(+),NapsinA(+),P63(-),P40(-),CD117(-),S-100(-),Tg(-),desmin(-)。病理诊断:(食管)低分化癌,考虑为转移癌,肺来源可能性大;②病例2:肿瘤细胞呈巢分布,显示鳞状分化,周边可见正常胃体黏膜,免疫组化染色显示P63(+)和 P40(+),CK7(-)CK20(-)。病理诊断:(胃体)鳞状细胞癌(鳞状细胞癌为此部位胃癌少见组织学亚型,建议临床进一步检查除外转移性病变);③病例3:肿瘤细胞呈小巢状排列,瘤巢间见丰富的薄壁血管,肿瘤细胞形态较温和、一致,核染色质稍细腻,免疫组化染色显示 CK(+)、EMA(+)、Pax8(+)、CD10(+)、RCC(+)、Vimentin(+)、CD56(部分 +),Ki-67 热点区20%,CgA(-)、Syn(-)。病理诊断:(胃体大弯及十二指肠)结合免疫组化染色及既往病史符合转移性肾细胞癌。

图2 上消化道转移癌的活检病理Fig.2 Biopsy pathology of metastatic carcinoma of upper gastrointestinal tract

图3 上消化道转移癌的免疫组化Fig.3 Immunohistochemical of metastatic carcinoma of upper gastrointestinal tract
2.2.2 检索到的7例患者 病理诊断中均进行免疫组化染色,原发肿瘤有肺癌、乳腺癌、卵巢癌、肝癌、肾上腺皮质癌和精原细胞瘤,无明显器官特异性。
2.3 相关影像学检查及治疗
3例患者随后进行影像学检查均已证实诊断,进行相关治疗。病例1胸CT检查考虑左肺周围型肺癌,转入胸外科进行治疗并送基因检测。病例2胸CT左肺中心型肺癌,支气管镜活检病理结果为鳞状细胞癌,组织形态与前次内镜活检一致,后转肿瘤科治疗。病例3腹CT检查发现左肾占位较前次检查明显增大,口服靶向药物治疗。
3 讨论
食管癌、胃癌等上消化道原发癌是较常见的恶性肿瘤,在我国的发病率极高,然而,消化道外的恶性肿瘤转移到上消化道并不多见。文献报道消化道外的某些恶性肿瘤可转移到上消化道,例如肺癌、乳腺癌、肝癌、肾癌、骨肉瘤和恶性黑色素瘤等[9-13],但是以上消化道出血等消化道症状为首发表现的上消化道转移癌更为罕见,文献报道较少。
包括本文在内的10例报道中,患者年龄从30~81岁,中位年龄58(55,64)岁,男性和女性均可发生,无明显性别差异。患者的首诊症状均以消化道表现为主,例如进食哽噎感、黑便、上腹疼痛不适、食欲减退和恶心呕吐等,部分患者伴有消瘦、头晕和乏力等继发症状,并且通常没有明确的既往肿瘤病史,极易漏诊和误诊[14]。内镜检查和活检病理诊断是明确诊断的重要因素。
内镜检查发现病变可发生于上消化道任何部位,发生于胃者最多见,其次为十二指肠,食道最少见。病灶通常为单发,偶尔可多发。内镜下见病灶多为各种形态的隆起性病变,如息肉样、半球形和菜花状等,偶尔可为凹陷性病变,常伴有糜烂、溃疡和出血,几乎从不并发穿孔。病变较大时常引起局部管腔狭窄。内镜活检时感觉到组织质地通常较脆。偶尔可出现特殊表现,本研究中的病例2于距门齿35.0 cm处可见一外压性管腔狭窄,该处黏膜无明显异常,后期患者影像学检查证实为肺占位局部压迫所致。由于其内镜表现常无特殊性,易与消化道原发肿瘤相混淆,发生于食管和胃者常与原发癌不易鉴别,部分发生于胃和十二指肠的息肉样病变还易误诊为神经内分泌肿瘤[15-16]。此类病变的病理诊断有难度,病理医师在诊断中要拓宽诊断思路,合理应用免疫组化染色辅助诊断,更要重视与内镜医师的沟通。本院收治的3个病例遵循上述原则均得到正确诊断,随后的影像学检查找到原发灶,使患者得到相应治疗,与国外的相关报道[16-17]一致。
以胃肠道表现为首发症状的上消化道转移癌非常少见,患者多为晚期肿瘤患者,已失去手术机会、错过最佳治疗时机,但明确的诊断能使患者得到有针对性的治疗和处理,适度减轻痛苦和改善生活质量。因此,熟知其内镜表现和临床病理特征,建立内镜医师、病理医师和临床医师之间的良好沟通,通过多学科协作可以显著降低漏诊、误诊的概率,使患者受益。
参 考 文 献:
[1]DENG X, WEI W, HUANG N, et al. Tumor repressor gene chondroadherin oppose migration and proliferation in hepatocellular carcinoma and predicts a good survival[J].Oncotarget, 2017, 8(36): 60270-60279.
[2]胡何节, 汤志刚, 许戈良. 双侧肾上腺皮质癌合并胃肠道广泛转移[J]. 中国医师进修杂志, 2008, 31(35): 70-71.
[2]HU H J, TANG Z G, XU G L. Bilateral adrenal cortical carcinoma with widely gastrointestinal metastasis[J]. Chin J Postgrad Med,2008, 31(35): 70-71. Chinese
[3]邱江锋, 林天胜, 吴培仁, 等. 原发性肝细胞肝癌胃转移一例[J].中华胃肠外科杂志, 2008, 11(5): 506.
[3]QIU J F, LIN T H, WU P R, et al. Gastric metastasis of primary hepatocellular carcinoma,a case report[J]. Chin J Gastrointest Surg,2008, 11(5): 506. Chinese
[4]MEMON Z, FERM S, FISHER C, et al. Rare case of duodenal metastasis from pulmonary squamous cell carcinoma[J]. J Investig Med High Impact Case Rep, 2017, 5(4): 98-101.
[5]KONO M, NAGAMI Y, OMINAMI M, et al. A metastatic gastric tumor from ovarian cancer[J]. Intern Med, 2018, 57(3): 345-349.
[6]KLIIGER J, GORBATY M. Metastasis to the pancreas and stomach from a breast cancer primary: a case report[J]. J Community Hosp Intern Med Perspect, 2017, 7(4): 234-237.
[7]AL ANI A H, AL ANI H A. Testicular seminoma metastasis to duodenum. Misdiagnosed as primary duodenal tumor[J]. Int J Surg Case Rep, 2016, 25: 149-152.
[8]ALSAEED E F, TUNIO M A, ALSAYARI K, et al. Duodenal metastasis from lung adenocarcinoma: a rare cause of melena[J].Int J Surg Case Rep, 2015, 13: 91-94.
[9]SATO Y, HORIGUCHI H, YOSHIDA M, et al. Four cases of esophageal metastasis from breast cancer[J]. Nihon Shokakibyo Gakkai Zasshi, 2012, 109(6): 921-928.
[10]ONUR M R, KOCAKOÇ E, POYRAZ A K, et al. Bone tissue in esophagus: an osteogenic metastasis[J]. Dis Esophagus, 2012,25(2): 176.
[11]FIDAN S, KOCAK G, FIDAN E. An unusual metastasis of prostate cancer to duodenum[J]. J Coll Physicians Surg Pak,2016, 26(11): 133-134.
[12]CHAWHAN S M, DANI A A, MESHRAM S A, et al. Metastases of squamous cell carcinoma of uterine cervix to duodenum: a case report[J]. J Clin Diagn Res, 2015, 9(1): ED03-ED04.
[13]KASWALA D H, PATEL N, JADALLAH S, et al. Metastatic prostate cancer to the duodenum: a rare case[J]. J Family Med Prim Care, 2014, 3(2): 166-168.
[14]BHARDWAJ R, BHARDWAJ G, GAUTAM A, et al. Upper gastrointestinal bleed as a manifestation of poorly differentiated metastatic squamous cell carcinoma of the lung[J]. J Clin Diagn Res, 2017, 11(6): OD13-OD14.
[15]SIAU K, YEW A C, HINGLEY S, et al. The 2015 upper gastrointestinal “Be Clear on Cancer” campaign: its impact on gastroenterology services and malignant and premalignant diagnoses[J]. Frontline Gastroenterol, 2017, 8(4): 284-289.
[16]INAGAKI C, SUZUKI T, KITAGAWA Y, et al. A case report of prostate cancer metastasis to the stomach resembling undifferentiated-type early gastric cancer[J]. BMC Gastroenterol,2017, 17(1): 93.
[17]STINTZING S, TEJPAR S, GIBBS P, et al. Understanding the role of primary tumour localisation in colorectal cancer treatment and outcomes[J]. Eur J Cancer, 2017, 84: 69-80.
