以新生儿胆汁淤积症为首要表现的垂体柄阻断综合征4例
2018-04-25李玉川谢新宝方微园库尔班江阿布都西库尔张雪媛王建设
李玉川 谢新宝,2 陆 怡 赵 静 方微园 库尔班江阿布都西库尔 张雪媛 王建设
1 病例资料
1.1 一般资料 2017年2月至2018年5月在复旦大学附属儿科医院(我院)确诊的新生儿期以胆汁淤积症为首发表现的垂体柄阻断综合征(PSIS)患儿4例,主要临床特征见表1。男3例,女1例,起病年龄生后1~3 d,诊断年龄2~3月龄。4例患儿父母均为非近亲结婚,家族史均未诉异常。2例足月儿,均无窒息抢救史;2例早产儿,其中例3因“妊娠期高血压”剖宫产,出生时有窒息抢救史。
1.2 临床表现 4例均因“生后皮肤黄染”就诊,均有低血糖和生长发育迟缓,均无尿崩症表现。3例男性患儿中,隐睾症和小阴茎各1例。
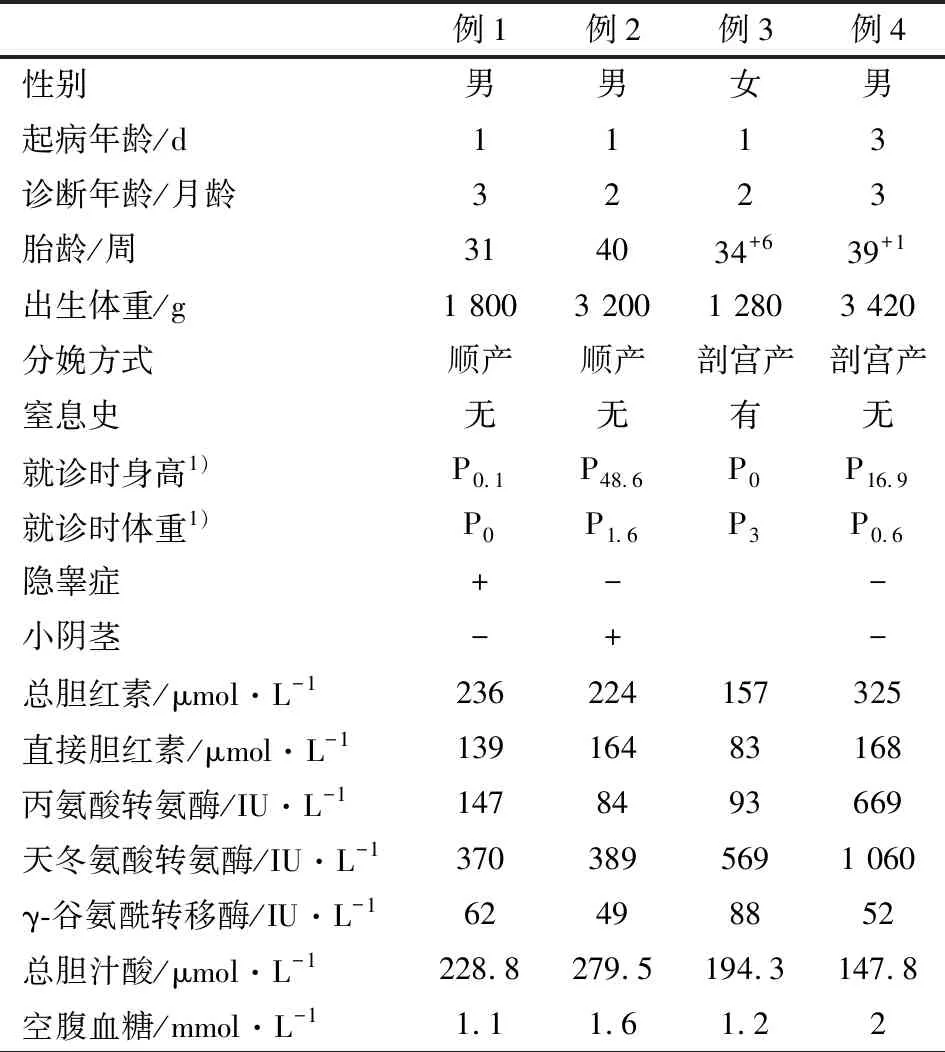
表1 4例垂体柄阻断综合征患儿临床特征及初诊时血生化检查结果
注 1) 位于同年龄、同性别正常儿童百分位数
1.3 实验室检查
1.3.1 血生化 4例均行肝功能、肾功能、电解质和空腹血糖检查,肾功能和电解质均未见异常。表1显示,4例总胆红素均升高,以直接胆红素升高为主;丙氨酸转氨酶和天冬氨酸转氨酶均升高,以AST升高更明显;γ-谷氨酰转移酶均正常(6月内婴儿正常值[1]:男12~122 U·L-1,女15~132 U·L-1);总胆汁酸均升高;均有低血糖。
1.3.2 激素水平 因年龄较小,4例患儿均未行生长激素激发试验。表2显示,3例在低血糖时查生长激素水平均低,2例胰岛素样生长因子1(IGF-1)均低于正常值;4例低血糖发作时皮质醇水平均降低,同时段促肾上腺皮质激素均无升高;例2、3甲状腺功能减退,但促甲状腺素无反馈性增高。
1.3.3 基因检测 例1、3和4在获得患儿父母知情同意后,抽取患儿静脉血2 mL(EDTA抗凝)用于提取DNA,采用肝病panel检测已知的2 703种基因。3例均未检测到与临床表型相关的致病基因突变。
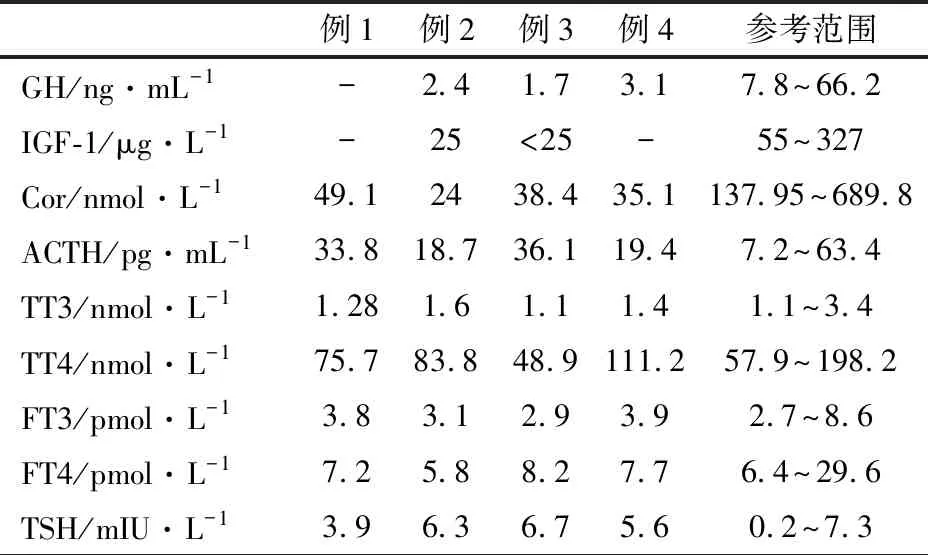
表2 4例垂体柄阻断综合征患儿初诊时激素水平
注 GH:生长激素;IGF-1:胰岛素样生长因子1;Cor:皮质醇,上午8点检测;ACTH:促肾上腺皮质激素;TT3:三碘甲状腺原氨酸;TT4:甲状腺素;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TSH:促甲状腺素;-:未行该项检查
1.4 肝脏病理 例2和4经监护人签署同意书后,排除禁忌证,全身麻醉于B超引导下行经皮肝穿刺术。2例肝脏病理HE染色均提示肝细胞气球样变并相互融合形成多核巨细胞,肝细胞内胆汁淤积,毛细胆管内胆栓形成(图1A、C)。例2胆盐输出泵(BSEP)免疫组化染色无表达(图1B),例4部分表达(图1D)。
1.5 垂体MRI 4例均行垂体增强MRI检查(图2),垂体柄均未显示,垂体前叶发育不良3例(例2~4),垂体后叶异位于第三脑室漏斗隐窝3例(例1~3),垂体后叶异位于鞍区上方1例(例4)。
1.6 治疗和随访 4例均予熊去氧胆酸和氢化可的松口服替代治疗,并补充脂溶性维生素A、D、E、K。2例甲状腺功能减退患儿予左甲状腺素钠口服替代治疗。随访期间,每半月至1月随访血常规和肝功能;每月监测患儿甲状腺激素和皮质醇水平,并根据病情变化调整药物剂量。4例患儿随访4~19个月,分别于诊断后6、3、6和4个月黄疸消退,皮质醇水平分别于诊断后1、1、2和2个月恢复正常。例2、3甲状腺功能减退的患儿甲状腺功能于诊断后1个月恢复正常。4例患儿均未出现严重感染。随访至2018年9月,4例患儿身高分别为同年龄同性别儿童的P0.2、P50、P4.6和P14.9,体重分别为同年龄、同性别儿童的P0.1、P18.4、P23.7和P2.8。
2 讨论
垂体是内分泌系统中主要的中枢性内分泌腺,位于颅中窝蝶鞍垂体窝内,通过垂体柄向上以漏斗部与下丘脑相连。垂体由腺垂体和神经垂体组成,腺垂体分泌促肾上腺皮质激素、生长激素、促甲状腺激素、促性腺激素和泌乳素等, 作用于周围内分泌腺及全身各脏器和组织,对代谢、生长和发育发挥重要的调控作用。神经垂体与下丘脑直接相连,贮藏下丘脑分泌的抗利尿激素及催产素,对浓缩尿液和分娩发挥作用。

图1 垂体柄阻断综合征患儿肝脏病理
注 A和C分别为例2和例4,肝细胞气球样变并相互融合形成多核巨细胞(箭头所示),肝细胞内胆汁淤积,毛细胆管内胆栓形成(HE,×400);B:例2,BSEP无表达(BSEP染色,×400);D:例4,BSEP部分表达(箭头所示)(BSEP染色,×400)
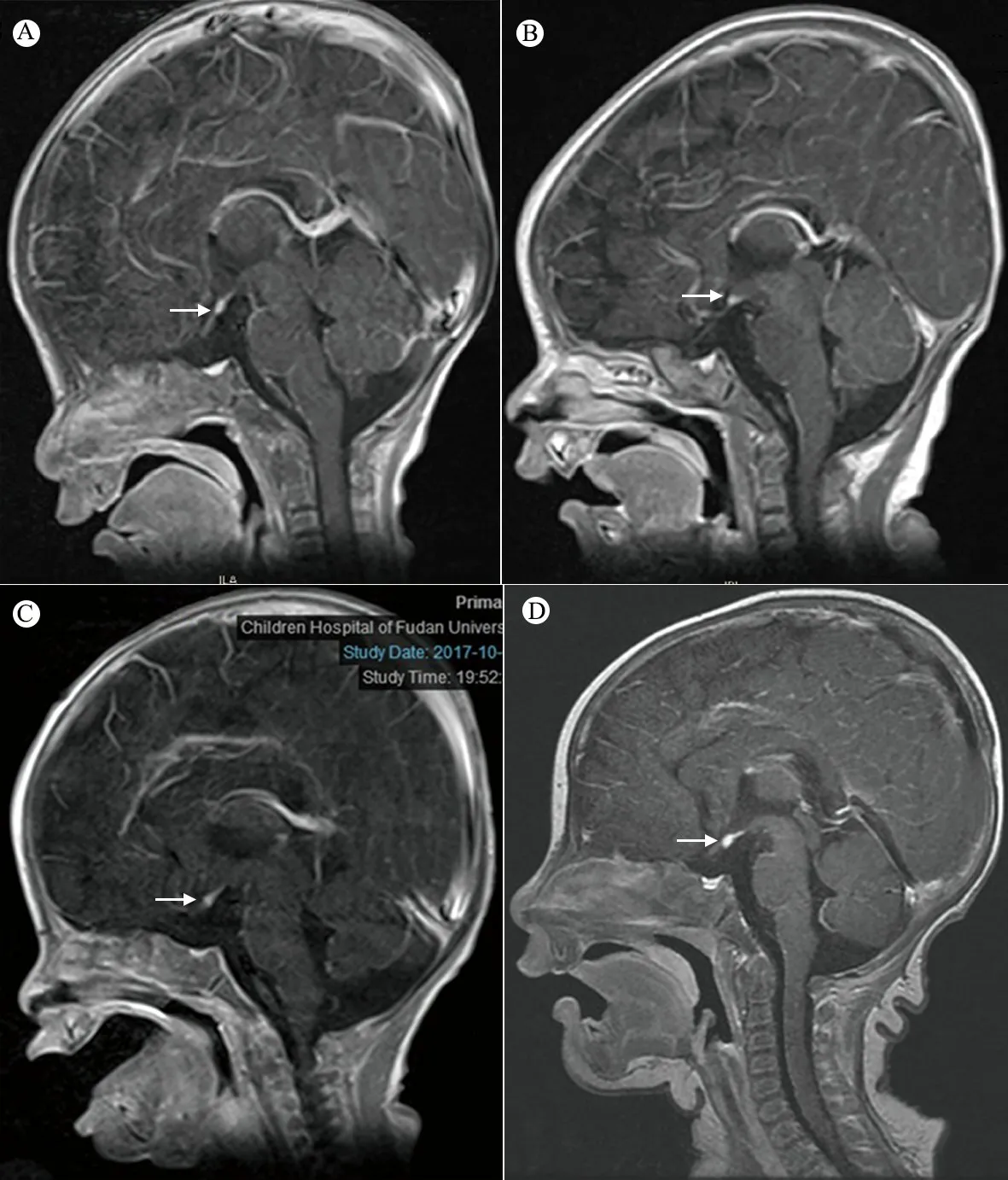
图2 垂体柄阻断综合征患儿垂体MRI
注 A~D分别为例1~4,箭头所示异位垂体后叶
PSIS是由于垂体柄缺如或变细合并垂体后叶异位,导致下丘脑分泌的激素不能通过垂体柄输送至垂体后叶,无法通过垂体门脉系统作用于垂体前叶而导致的一系列临床症候群[2]。该病由Fujisawa于1987年首次报告[3]。国外报道,PSIS在新生儿中的发病率约为0.5/100 000[4-6],目前国内的发病率尚不清楚。PSIS可存在一种或多种激素缺乏,几乎都有生长激素缺乏,多数以矮小就诊,也有以反复低血糖发作就诊[7]。以胆汁淤积症为首发表现的PSIS国内尚未见报道,国内报道的PSIS多数为学龄期儿童甚至成年人[8-11]。PSIS以垂体柄缺如或变细合并垂体后叶异位,垂体前叶发育不良为特征[3]。目前,PSIS的发病机制尚不明确。有学者认为与围生期损伤如臀位产、足先露、剖宫产、围生期窒息和颅脑损伤有关,但是,部分PSIS并无围生期损伤史,本文例3存在剖宫产和围生期窒息史,另有1例为剖宫产,余2例均无围产期损伤。近年来,越来越多的研究认为,基因突变可能与垂体发育异常有关。目前已报道HESX1、LHX4、OTX2、SOX3和PROKR2基因突变与PSIS有关,然而只有不到5%的PSIS患者发现存在这些基因突变,提示可能存在其他尚未发现的基因突变[12-15]。本文例1、3和4进行了基因检查,均未发现相关致病基因突变。
PSIS可存在1或多种激素缺乏,根据激素缺乏程度的不同,临床表现多样,其中以生长激素缺乏最常见,多数患者以矮小就诊。PSIS在新生儿期多表现为低血糖、黄疸延长、隐睾症和小阴茎等,在儿童和成年人表现为生长迟缓和性腺发育迟缓[12, 14]。韩白玉等[11]报告114例PSIS病例,年龄8~43(21.1±6.1)岁,89例(71.8%)身材矮小,第二性征普遍发育不良,生长激素缺乏、性功能低下、肾上腺功能低下和甲状腺功能低下者分别占100%、94.0%、84.2%和74.6%,105例(92.1%)存在≥3种垂体激素异常。刘子勤等[10]报告13例儿童PSIS病例,诊断年龄8个月至16岁,11例(84.6%)生长迟缓,4例(30.7%)低血糖后抽搐发作,12例(92.3%)生长激素和甲状腺激素缺乏,10例(76.9%)存在继发性皮质功能减退。Bar等[15]报告了67例PSIS患者(平均诊断年龄2.5岁),主要表现为低血糖(25%)、黄疸(22%)、小阴茎(31%)和隐睾症(24%),其中10例(15%)在新生儿期起病,均以低血糖就诊,在临床上表现更重,临床表现的严重性与垂体发育异常有关,新生儿期起病的患者垂体前叶发育不良更重。国外研究发现,在新生儿期起病的PSIS患儿有1/3临床上表现为低血糖、胆汁淤积,男性存在小阴茎、隐睾症,尽早的诊断和治疗可明显改善预后[2, 12, 15]。本文在国内首次报告新生儿期起病的PSIS患儿,4例均以“生后皮肤黄染”为主诉入院,临床表现除黄疸外,还有低血糖和生长迟缓。目前国内报道的儿童PSIS病例多表现为低血糖和生长迟缓。然而,生长迟缓在2岁以内可能表现并不明显,导致临床医生易忽略垂体激素水平缺乏[16]。隐睾症和小阴茎也是PSIS在新生儿期常见的临床表现[16],本组2例男性患儿分别存在隐睾和小阴茎。
胆汁淤积症是垂体功能减退患者在新生儿期的常见临床表现,但并不是PSIS新生儿特异的临床表现[16]。目前,国内尚未见以胆汁淤积症为首发表现的儿童PSIS报道。本文4例患儿均表现为胆汁淤积症,血生化提示总胆红素升高,以直接胆红素升高为主,总胆汁酸均升高,γ-谷氨酰转移酶均正常。由于PSIS存在多种激素水平异常,考虑胆汁淤积症可能与患者激素水平异常有关,具体发病机制尚不清楚。Mauvais等[17]回顾了16例1岁以内诊断为PSIS患儿的临床资料,根据是否存在胆汁淤积症分为胆汁淤积症组(n=5)和无胆汁淤积症组(n=11),结果显示,胆汁淤积症组皮质醇水平下降更明显,而IGF-1和FT4水平两组差异无统计学意义,胆汁淤积症组5例患者在补充激素治疗后,随访9个月内胆汁淤积症减退,在中位随访9.4年内未发生慢性肝脏疾病。本文4例患儿皮质醇水平均明显降低,在补充氢化可的松口服替代治疗后,肝功能均在6个月内恢复正常。Bauman等[18]研究发现,肾上腺切除术后的小鼠由于皮质醇缺乏会引起胆汁流减少,而皮质醇替代治疗后会改善这一现象,从动物试验方面证明了糖皮质激素缺乏可能与胆汁淤积有关。
Grammatikopoulos等[19]对21例新生儿期存在胆汁淤积症的先天性垂体功能减退患儿进行回顾性分析,12例(57%)γ-谷氨酰转移酶正常;10例行肝穿刺术,肝脏病理结果提示存在中至重度胆汁淤积,且大部分患儿存在显著的多核巨肝细胞转化,所有患儿免疫组化BSEP表达均减少;6例肝穿刺患儿经基因检查排除了进行性家族性肝内胆汁淤积症(PFIC)Ⅰ、Ⅱ型,该研究认为糖皮质激素水平可能与先天性垂体功能减退患儿存在胆汁淤积症有关。在正常肝脏,糖皮质激素可以通过增加胆盐依赖的胆汁流来增加胆汁排泄[20],糖皮质激素已经被经验性用于改善胆道闭锁等疾病引起的胆汁淤积症[21-25]。另外,有研究发现,糖皮质激素可以通过不同的受体来调节BSEP和MDR3蛋白的基因转录,糖皮质激素缺乏时可引起胆汁淤积[26]。本文4例胆汁淤积症患儿γ-谷氨酰转移酶均正常,总胆汁酸升高,3例进行基因检查排除了PFIC Ⅰ、Ⅱ型等遗传代谢性疾病。2例行肝穿刺活检术,肝脏病理结果提示肝细胞气球样变并相互融合形成多核巨细胞,肝细胞内胆汁淤积,毛细胆管内胆栓形成,免疫组化BSEP染色1例无表达,另1例部分表达。与Grammatikopoulos等结果一致,进一步支持糖皮质激素缺乏可引起胆汁淤积症。
垂体增强MRI是诊断PSIS的主要影像学方法。PSIS的垂体增强MRI表现为:①垂体柄缺如或纤细;②垂体后叶高信号异位,异位可发生于沿漏斗区任何部位,最常见于第三脑室漏斗隐窝,垂体后叶异位是PSIS的特征性标志;③垂体前叶发育不良[27, 28]。本文4例垂体增强MRI均未显示垂体柄,垂体前叶发育不良3例(75.0%),垂体后叶异位于第三脑室漏斗隐窝3例(75.0%),垂体后叶异位于鞍区上方1例(25.0%)。垂体MRI检查可直观、清晰地显示垂体和垂体柄等细微结构,对PSIS的诊断具有较高的特异性,结合临床表现和实验室检查可明确诊断。同时也为临床判定PSIS造成的单一激素缺乏能否发展为多种腺垂体激素缺乏提供有效的影像学支持[29, 30]。
PSIS的治疗主要根据缺乏的激素进行相应的药物替代治疗。肾上腺功能减退者补充生理剂量糖皮质激素,甲状腺功能减退者补充左甲状腺素,生长激素缺乏者补充生长激素,性激素缺乏者补充性腺激素,中枢性尿崩症者补充醋酸去氨加压素。对于多种激素缺乏,替代顺序为糖皮质激素、甲状腺激素、生长激素和性激素。同时存在肾上腺皮质功能减退和甲状腺功能减退时,糖皮质激素替代应在甲状腺激素之前,并定期监测血糖、血压、电解质和甲状腺功能等,避免发生垂体前叶危象[31]。本文4例均予生理剂量的氢化可的松口服替代治疗,2例甲状腺功能减退者予左甲状腺素替代治疗,经治疗4例患儿胆汁淤积缓解,皮质醇水平、甲状腺激素水平恢复正常,监测血糖、血压、电解质正常;4例患儿生长发育水平较就诊时有改善,但仍较同年龄同性别儿童落后,考虑与生长激素缺乏有关。
由于PSIS存在多种激素水平异常,若延误治疗可严重影响患儿生长发育,甚至威胁患儿生命,因此早期诊断和治疗至关重要。PSIS在生后即可发病,然而临床就诊大多为学龄期甚至成年患者,若能在新生儿期诊断,早期进行激素替代治疗,可显著改善患儿预后。临床上,对于新生儿期存在胆汁淤积症、低血糖、生长发育迟缓、隐睾症或小阴茎的患儿,若无法用其他原因解释时,应考虑PSIS可能,早期进行激素水平检测,存在多种激素水平异常的患儿需进一步完善垂体增强MRI检查以明确诊断。
