基于高通量检测发现并验证胆道闭锁血清标志物
2018-04-25余发星
郑 超 董 瑞 余发星 郑 珊
胆道闭锁是一种以婴儿肝内胆汁淤积、肝内外胆管阻塞、肝脏进行性纤维化并恶性进展至肝硬化为特征的罕见的破坏性炎症性疾病[1],若不及时采取有效治疗手段,多在2岁时因进行性肝硬化而死亡[2]。早期筛查胆道闭锁并尽快施行Kasai手术能够很大程度地改善患儿的长期预后[3]。随着许多与胆道闭锁发病机制密切相关的差异表达蛋白被不断发现,采用分子标志物独立或联合早期筛查胆道闭锁成为可能。传统的ELISA法、蛋白印迹法或免疫组织化学染色法,1次实验只能检测1种或几种蛋白含量,无法进行大规模、高通量的结果分析。抗体芯片技术具有微型化、集成化、高通量化的特点,在研究信号转导异常、蛋白质组学、肿瘤标志物和细胞周期调控等领域有广泛的应用。本研究利用抗体芯片技术检测胆道闭锁患儿血清中细胞因子的表达水平,为进一步探索胆道闭锁的发病机制及诊断策略奠定新的研究基础。
1 方法
1.1 伦理和知情同意 本研究方案经复旦大学附属儿科医院(我院)伦理委员会批准。所有研究对象的父母均签署知情同意书。
1.2 研究对象纳入标准 2017年1~5月于我院外科初诊且未治疗,经我院外科术中探查、胆道造影及术后病理切片诊断为胆道闭锁(胆道闭锁组)或胆总管囊肿(对照组),且均无肝外合并畸形。
1.3 血清样本采集 采用惰性分离胶促凝采血管,在消毒无菌情况下,采集患儿入院后未输血情况下的术前静脉血5 mL,室温下静置30 min后,3 000 r·min-1离心15 min,取上清分装,置于-80 ℃保存待用。
1.4 抗体芯片检测方法 抗体芯片购自广州瑞博奥生物科技有限公司 (Quantibody®Human Cytokine Antibody Array X00,catalog#:QAH-CAA-X00)。该抗体芯片可检测血清样本中的1 002种蛋白指标,通过抗体芯片检测阵列图并释放荧光信号,收集荧光信号数据后,经过归一化处理及t检验分析。
1.5 酶联免疫吸附试验(ELISA) 根据抗体芯片检测结果,通过复习文献选取部分分子标志物,采用ELISA(试剂盒购自广州瑞博奥生物科技有限公司,ELH-IL6-1,ELH-IL8-1,ELH-IL10-1)进行扩大样本(2015年1月至2017年1月收集我院胆道闭锁和胆总管囊肿患儿的血清样本)的验证。

2 结果
2.1 一般资料 胆道闭锁组5例(表1,例1~5),平均年龄(88.2±22.3) d,男4例,女1例;对照组3例(表1,例6~8),平均年龄(104±9.5) d,男2例,女1例。两组患儿年龄分布差异无统计学意义(P=0.299,t=2.447)。
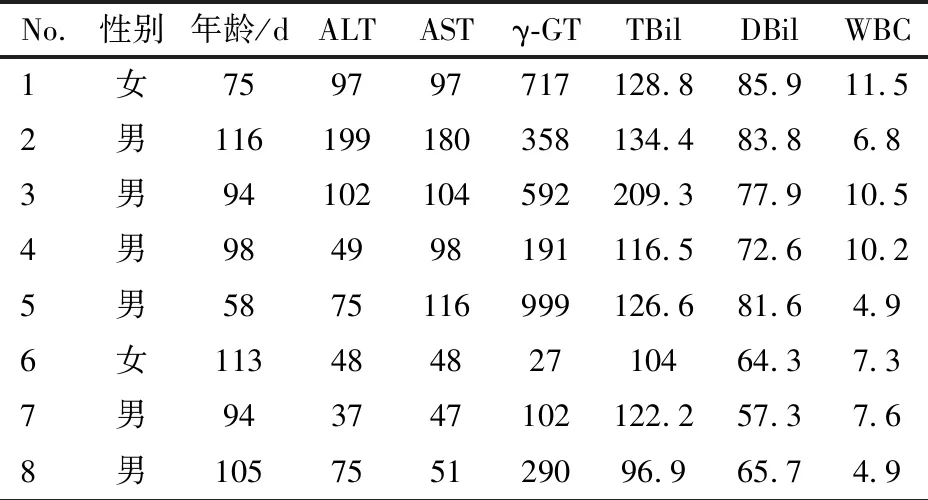
表1 胆道闭锁组和对照组患儿的基本情况
注 ALT:IU·L-1;AST:IU·L-1;γ-GT:γ-谷氨酰转移酶,IU·L-1;TBil:总胆红素,μmol·L-1;DBil:直接胆红素,μmol·L-1;WBC:×109·L-1
2.2 抗体芯片检测情况 表2显示,47/1 002个蛋白在两组样本中的表达差异有统计学意义(P均<0.05),且两者相差倍数均>1.2倍,在胆道闭锁组中表达上调的蛋白34个,下调13个。图1显示表达差异蛋白的火山分布图。
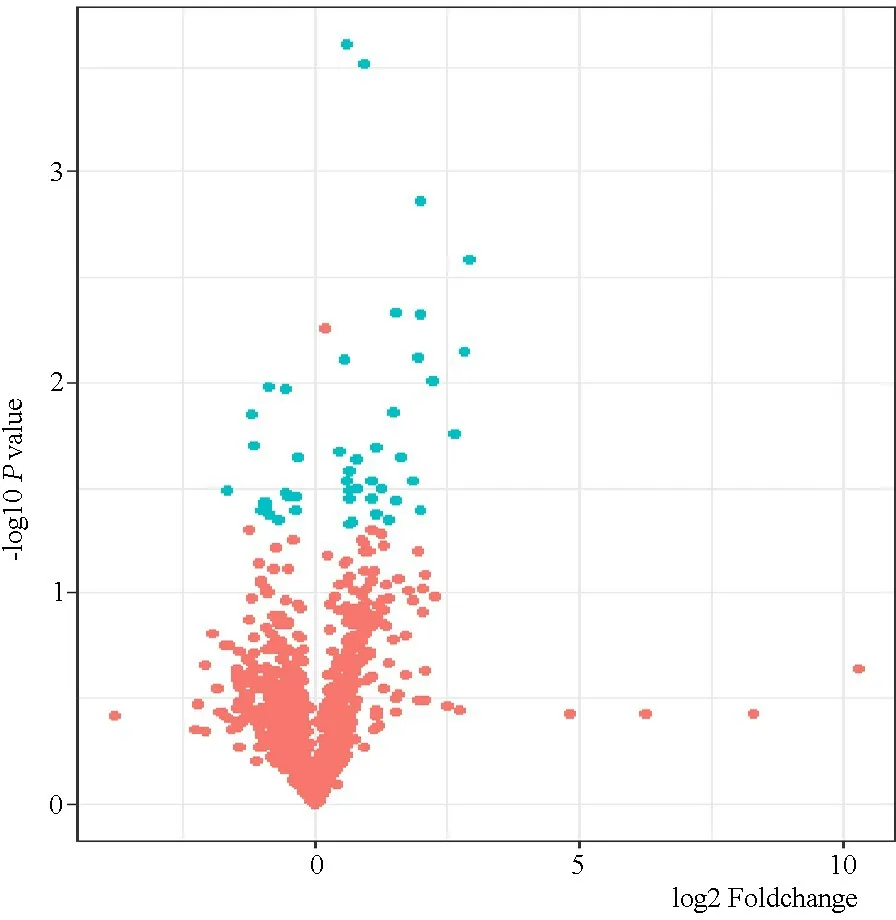
图1 胆道闭锁和对照组血清抗体芯片1 002个蛋白火山分布图
注 绿色圆点代表差异有统计学意义(P<0.05,即-log 10Pvalue>1.30)且两者倍数相差>1.2倍(即log 2 Foldchange的绝对值>0.263)的47个蛋白;红色圆点代表差异无统计学意义的蛋白
2.3 抗体芯片蛋白信号通路和生物功能富集分析结果 对胆道闭锁组和对照组血清差异表达蛋白进行KEGG信号通路富集分析和GO生物分子功能以及生物功能分析。
图2显示,232个差异有统计学意义的富集GO生化过程中所包含差异蛋白个数最多的前10个生化过程,即与胆道闭锁差异表达蛋白相关程度最高的生化过程,结果提示胆道闭锁主要与白细胞介导免疫、白细胞迁移和适应性免疫应答等生化过程高度相关。
图3显示差异有统计学意义的5个包含差异蛋白相关的细胞组成成分,即与胆道闭锁差异表达蛋白相关程度最高的细胞组成成分,包括受体复合物、蛋白质细胞外基质、胞膜受体复合物、基底膜和HEF-转铁蛋白受体复合物。
图4显示24个差异有统计学意义的富集GO分子功能中所包含差异蛋白个数最多的前10个生物分子功能,结果提示胆道闭锁主要与代谢物结合、受体信号蛋白活性和趋化因子活性等分子功能高度相关。
图5显示差异有统计学意义的4个包含差异蛋白相关的KEGG信号通路,即与胆道闭锁差异表达蛋白相关程度最高的信号通路,包括细胞因子-受体相互作用、流体剪应力和动脉粥样硬化、TNF信号通路和疟疾。
表2 胆道闭锁组和对照组血清中的差异表达蛋白
注 1):胆道闭锁组蛋白表达均值/对照组蛋白表达均值
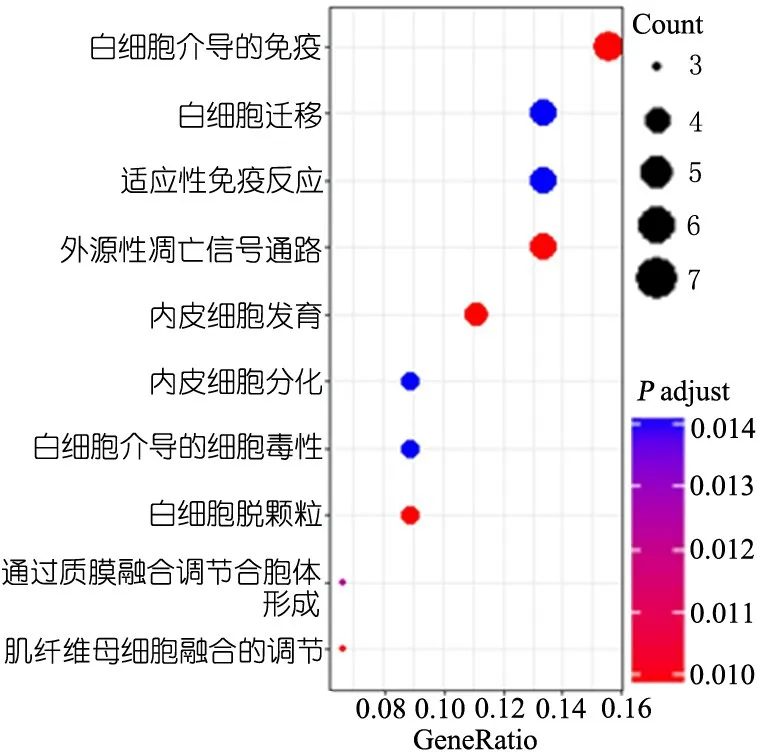
图2 胆道闭锁组和对照组血清差异表达蛋白相关的生化过程(部分显示)
注 横坐标表示对应差异基因数/能够对应到GO数据库中同类型的差异基因数

图3 胆道闭锁组和对照组血清差异表达蛋白相关的细胞组成成分
注 横坐标表示对应差异基因数/能够对应到GO数据库中同类型的差异基因数

图4 胆道闭锁组和对照组血清差异表达蛋白相关的生物分子功能(部分显示)
注 横坐标表示对应差异基因数/能够对应到GO数据库中同类型的差异基因数

图5 胆道闭锁组和对照组血清差异表达蛋白相关的信号通路
注 横坐标表示所包含的差异蛋白个数
2.4 扩大样本验证结果 根据抗体芯片检测结果,本研究选取IL-6、IL-8和IL-10指标[20~23]进行验证,表3显示,50例胆道闭锁患儿和30例胆总管囊肿患儿血清IL-6、IL-8和IL-10浓度差异均有统计学意义。IL-6、IL-8和IL-10在胆道闭锁患儿血清中浓度均高于胆总管囊肿患儿。
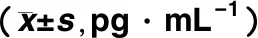

胆道闭锁(n=50)胆总管囊肿(n=30)tPIL-6387.753±215.113141.778±116.1144.916<0.000 1IL-8279.102±204.65795.963±109.7424.607<0.000 1IL-1095.416±104.81745.135±41.5572.3780.020 2
3 讨论
胆道闭锁是一种重大先天性胆道畸形疾病,其较差的预后及后期可能的肝移植所带来的经济负担已成为威胁新生儿健康的重大问题。实验室常规血液检查发现,胆道闭锁患儿结合胆红素升高,碱性磷酸酶和γ-谷氨酰转肽酶亦可升高,但缺乏特异性,无法与其他婴儿肝脏疾病进行鉴别,必须进一步行超声检查[4,5]和经皮穿刺肝脏活检[6]等。尽早诊断、行Kasai手术治疗,方能较大改善胆道闭锁患儿的长期预后[3,7~9]。
胆道闭锁的血清学检查常作为辅助诊断手段,如ALT、AST、碱性磷酸酶、γ-谷氨酰转移酶、胆红素和胆汁酸等,并不能作为确诊手段[10,11]。血清中含有种类繁多的蛋白质, 且这些蛋白质的含量存在着巨大的差异。高通量技术的发展使得血清中差异表达蛋白的研究更全面和广泛。抗体芯片技术的应用主要是发现蛋白质新的功能、了解蛋白功能的分子机制、分析特定刺激因素激发的信号通路、筛选药物候选的效应分子和发现新的肿瘤生物标志物等[12]。近年来,抗体芯片技术在肿瘤、免疫性疾病、神经性疾病等罕见病中的应用已有不少文献报道[13,14]。本研究采用抗体芯片检测血清指标,结合其潜在的相关生物学功能信号通路分析,进一步探索胆道闭锁的发病机制以及诊断策略。
本研究通过比较两组蛋白表达情况,筛选出47个差异表达蛋白,在胆道闭锁患儿血清中表达上调34个,下调13个,部分结果与既往文献报道一致。Kobayashi等[15]和Ghoneim等[16]均报道胆道闭锁血清中ICAM-1含量高于对照组,与本研究检测结果一致,表明ICAM-1对胆道闭锁患儿具有诊断价值。而Leonhardt等[17]在胆道闭锁RRV注射小鼠动物模型的RNA检测中检出Granzyme A的基因表达在造模组小鼠肝脏中升高,本研究检测结果可能进一步揭示GranzymeA表达在胆道闭锁中不仅在基因层面上升高,在蛋白层面上亦升高。Kobayashi等[18]还检测到胆道闭锁患儿血清中IP-10升高且其含量与胆道闭锁患儿术后肝功能及门静脉压力密切相关,肝功能损害越严重患儿血清中IP-10含量越高,本研究检测结果同样显示胆道闭锁血清中IP-10含量增加,但是由于样本数量有限,因此无法判断其是否与胆道闭锁患儿术后肝功能损害相关。既往文献报道MMP-7[19]、IL-6[20]、IL-8[20~22]和IL-10[23]在胆道闭锁患儿血清中升高,与本研究抗体芯片检测结果一致。本研究通过扩大样本量检测血清IL-6、IL-8和IL-10水平,结果显示胆道闭锁患儿血清中IL-6、IL-8和IL-10水平均升高,与抗体芯片结果一致,但考虑到实验方法及所选样本数量和来源有所差别,因此其相差的倍数与抗体芯片结果有所差异。
本研究的结果初步表明,利用血清抗体芯片分析技术,不仅能够对血清样本中繁杂的多种蛋白进行微型化、集成化、高通量化地检测分析,也可能筛选出一些具有临床诊断价值的胆道闭锁血清标志蛋白,为进一步探索胆道闭锁发病机制以及诊断策略奠定新的研究基础。
