松郁安神方对异相睡眠剥夺大鼠海马CREB表达的影响
2018-04-24曾雪爱周春权王秀峰张一帆黄俊山福建省中医药研究院福建福州350003福建省中医睡眠医学重点实验室福建福州350003
曾雪爱 ,周春权 ,王秀峰 ,张一帆 ,黄俊山 (1.福建省中医药研究院,福建 福州 350003;2.福建省中医睡眠医学重点实验室,福建 福州 350003)
睡眠是机体复原、整合和巩固记忆的重要环节,是维持生命所必须的过程,根据睡眠过程中脑电图、眼球运动情况,睡眠可分为快速眼球运动(rapid eye movement,REM)和非快速眼球运动(non rapideye movement,NREM)两个时相。其中 REM 睡眠亦称异相睡眠(paradoxical sleep),它对于保证学习、记忆和情感等大脑高级功能正常具有非常重要的作用[1]。随着生活节奏的加快和社会竞争的增加,睡眠障碍或睡眠相关疾病的发生率逐年增加,越来越多的人处于慢性睡眠剥夺状态。长期睡眠不足或异相睡眠剥夺(paradoxical sleep deprivation,PSD)严重影响人们的生活质量、身心健康和学习记忆。松郁安神方是黄俊山教授临床上治疗失眠的经验效方,临床上用于治疗失眠疗效显著。前期实验已证实该方能改善REM睡眠剥夺所致的大鼠学习记忆能力下降[2],本实验进一步通过检测大鼠海马学习记忆的关键蛋白——cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)的表达和变化,探讨松郁安神方改善PSD大鼠学习记忆能力的作用机制。
1 材料
1.1 动物 健康雄性Sprague-Dawley大鼠,清洁级,体质量(200±10)g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005。动物置于实验环境中饲养3 d,给予充足食物和水。实验前将大鼠随机分为4组:对照组、PSD模型组、中药高剂量组、中药低剂量组,每组5只。
1.2 主要药品与试剂 RNAprep pure动物组织总RNA提取试剂盒、cDNA合成试剂盒(北京天根生化科技有限公司);SYBR Premix Ex Taq(大连TaKaRa公司);细胞裂解液、PMSF(碧云天生物技术有限公司);蛋白 Marker(美国 Thermo 公司);一抗:CREB及 p-CREB(美国 Cell Signaling Technology公司);GAPDH(美国 Cell Signaling Technology公司);二抗:辣根过氧化物酶标记二抗(美国 SAB公司);显影液(美国Thermo公司);引物(上海捷瑞生物工程有限公司)。中药松郁安神方由福建省中医药研究院提供。
1.3 主要仪器 睡眠剥夺装置(中国医学科学院药物研究所);微量紫外分光光度计(美国Thermo公司);7 500 fast型荧光定量PCR仪(美国ABI公司);蛋白电泳和电转仪(美国Bio-Rad公司);Alpha多色荧光、化学发光凝胶成像系统(美国ProteinSimple公司)。
2 方 法
2.1 PSD模型建立 采用改良多平台睡眠剥夺法建立模型[3]。每次取8只大鼠放入睡眠剥夺装置内,内有9个小平台,平台直径6.5 cm,平台周围注满水,平台高出水面约1.0 cm。当大鼠进入异相睡眠时,由于全身肌肉张力降低,出现垂头触水而觉醒,使动物不能进入异相睡眠,连续睡眠剥夺96 h。对照组采用与睡眠剥夺组一样的装置,只是把大鼠放在直径为12.0 cm的大平台上,在大平台上的动物能够进入异相睡眠,使其所处环境与其它组完全一致。2.2 给药方法 睡眠剥夺第1天开始进行灌胃给药。松郁安神方由甘松10 g,郁金15 g,玫瑰花10 g,丹参 15 g,酸枣仁 15 g,首乌藤 30 g,珍珠母30 g,生龙骨30 g,合欢皮 15 g组成,药材加 10倍量的水浸泡30 min,珍珠母和生龙骨先煎30 min后,加入其余中药,先武火煮沸,再文火煮30 min,过滤,残渣加水煎煮,重复2遍,合并滤液,浓缩至所需浓度。中药高剂量组、中药低剂量组分别按34 g/kg、17 g/kg体质量灌胃给药,对照组和PSD模型组均给予等体积蒸馏水,每天1次,共7 d。于第7天灌胃2 h后取材,在冰面上迅速分离海马组织,-80℃冰箱保存。
2.3 实时荧光定量PCR检测 总RNA提取参照试剂盒说明书进行。提取的总RNA纯度及完整性检测后,选用天根Quant cDNA第一链合成试剂盒合成cDNA。在进行RT-PCR实验前,用普通PCR检验引物的特异性,PCR扩增产物用1.7%琼脂糖凝胶电泳检测。PCR反应体系为:SYBR Premix Ex Taq(2×) 10 μL,50×ROX Reference DyeⅡ 0.4 μL,上下 游 引 物分别 为 1 μL,cDNA 模 板 7.5 μL,加DEPC水补至20 μL。PCR的反应条件为:95℃预变性 30 s,95℃变性 3 s,60℃延伸 30 s,40 个循环。
2.4 蛋白印迹法检测 取海马研磨,使组织细碎,加入裂解液,置于冰上裂解,匀浆液离心,采用微量紫外分光光度计测定组织总蛋白含量。总蛋白按1∶1加入2×上样缓冲液,混匀,变性处理后进行蛋白印迹法检测,其步骤大致如下:经过灌胶、加样、电泳、转膜后,将膜放入5%脱脂奶粉封闭液置室温摇床上封闭 2 h,加一抗(CREB,兔抗,1∶500;p-CREB,兔抗,1∶500;GAPDH,兔抗,1∶1 000)于 4℃孵育过夜。然后加入辣根过氧化物酶标记(HRP)的二抗(羊抗兔 1∶5 000),二抗室温摇床上孵育 1 h,最后将膜正面朝上放置在显影板上,曝光显影。用AlphaView SA软件分析光密度,根据光密度对蛋白条带进行分析,以GAPDH作为内参,计算目的蛋白与内参光密度比值。将对照组的光密度比值设定为1,其余各组与对照组的比值作为最后结果进行统计。
2.5 统计学方法 采用SPSS 18.0软件进行数据分析。计量资料属正态分布以(x±s)表示,采用单因素方差分析。
3 结果
3.1 松郁安神方对PSD大鼠海马CREB mRNA表达的影响 实时荧光定量PCR结果显示:连续睡眠剥夺96 h后,大鼠海马CREB mRNA表达明显降低,相对表达量为(0.63±0.10),与对照组比较有统计学意义(P<0.01);不同剂量松郁安神方干预后CREB mRNA表达明显升高,并呈明显的剂量效应,中药高剂量组相对表达量为(0.86±0.09),与模型组比较有统计意义(P<0.01),中药低剂量组相对表达量为(0.75±0.08),差异也有统计学意义(P<0.05)。 见图 1。3.2 松郁安神方对PSD大鼠海马CREB蛋白表达的影响 蛋白印迹法结果显示:连续睡眠剥夺96 h后,大鼠海马磷酸化CREB(p-CREB)蛋白表达降低,相对表达量为(0.63±0.03),与对照组比较,有统计学意义(P<0.01);中药高、低剂量组干预后p-CREB表达明显升高,中药高剂量组相对表达量为(0.91±0.03),中药低剂量组相对表达量为(0.78±0.09),与模型组比较,均有统计学意义(P<0.01)。见图2。
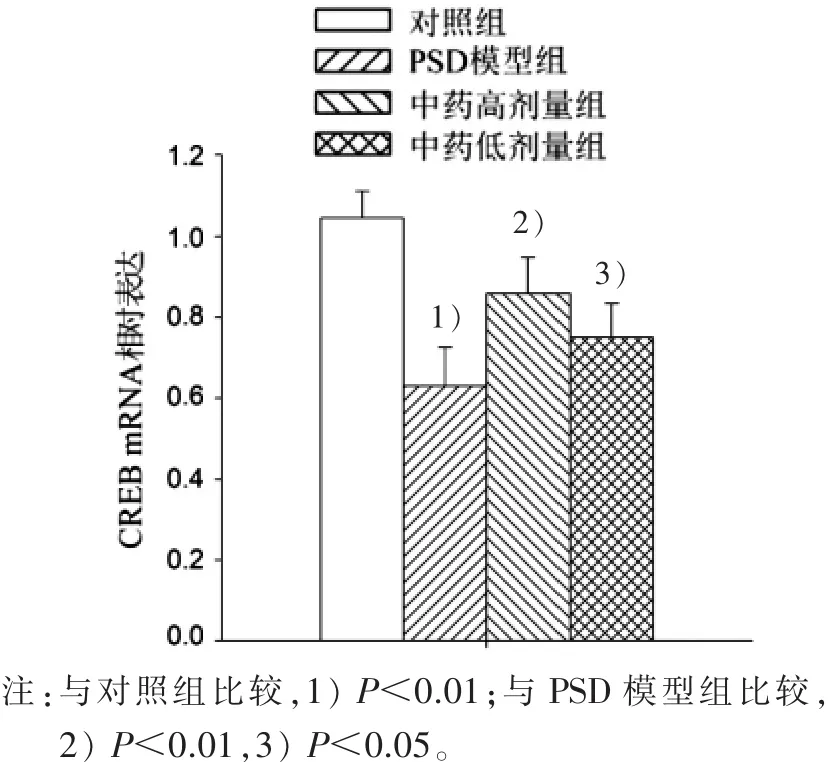
图1 4组PSD大鼠海马CREB mRNA表达量比较
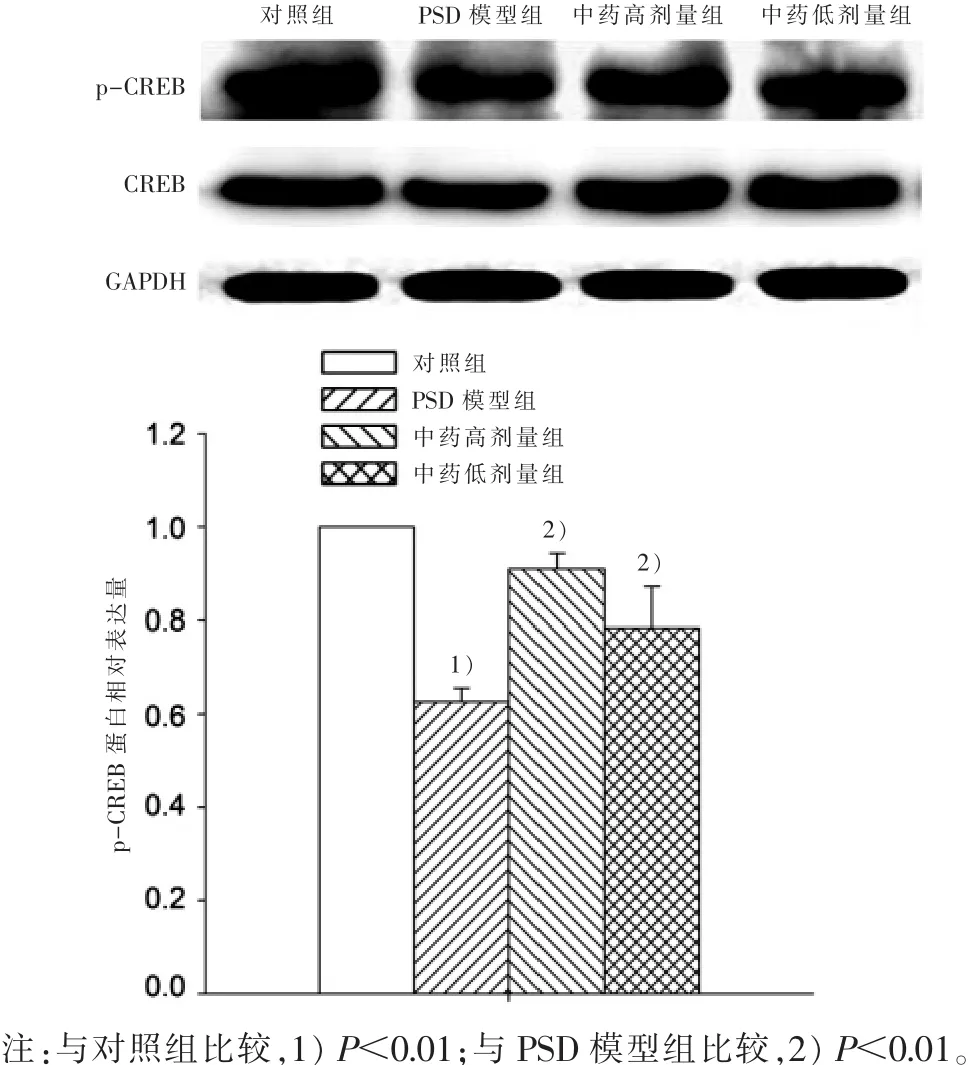
图2 4组PSD大鼠海马p-CREB蛋白表达量比较
4 讨 论
在异相睡眠期,除眼肌和中耳肌外,其它肌肉尤其是颈后肌和四肢肌肉的张力极度下降,不能维持某种姿势[3],改良多平台睡眠剥夺法是根据这一原理设计。此外,为了避免水环境对动物造成一定的应激反应,本实验采用大平台进行对照。大平台的直径允许大鼠进入异相睡眠,其他环境均与小平台相同。目前该方法是研究睡眠剥夺较常用且成熟的动物模型建立方案。
学习记忆与睡眠是相互影响的过程,学习记忆能影响睡眠的结构和时间,睡眠也可对觉醒时所获信息进行加工、整理并巩固成长时记忆,其中,异相睡眠与学习记忆关系较大。有研究报道:异相睡眠剥夺对大鼠的学习记忆能力存在一定的损害,其学习和记忆的获得与巩固过程下降[4];异相期睡眠剥夺可引起大鼠空间参考记忆能力低下[5]。
CREB是一种关键的核转录因子,在各系统中均发挥着重要的作用,能调节神经可塑性相关基因的表达[6]。很多与睡眠相关的神经递质和调质可影响脑内cAMP的含量[7]。当神经递质与细胞膜上的特异受体结合后,激活腺苷酸环化酶,水解生成第二信使cAMP,cAMP进一步激活蛋白激酶A(protein kinase A,PKA),即激活cAMP-PKA信号通路,CREB在神经系统中通常作为许多信号通路的终止与交汇点,其调控的上下游信号分子及其靶基因和CREB一起参与了神经细胞存活、再生、分化等过程,与突触的可塑性和学习记忆等正常生理活动密切相关[6,8]。 研究表明:睡眠剥夺阻碍海马 cAMPPKA信号通路,可扰乱认知过程[9]。对啮齿动物的研究也表明:REM睡眠剥夺能降低海马磷酸化CREB (P-CREB)水平[10]。可见海马中磷酸化 CREB水平与学习记忆关系密切。
松郁安神方既能改善大鼠REM睡眠剥夺大鼠的学习记忆能力[2],又能够镇静安神,增加睡眠时间和深度,从而改善记忆。本实验结果显示:REM睡眠剥夺96 h后,大鼠海马CREB mRNA及磷酸化CREB蛋白表达均降低,这与之前的研究报道一致。松郁安神方干预后,能明显升高海马CREB mRNA及磷酸化CREB蛋白表达,提示松郁安神方改善大鼠学习记忆能力可能通过调节CREB而发挥作用。但该方是否进一步调控CREB相关的信号通路,还有待于进一步的研究。
参考文献:
[1] 尹贞云,赵忠新.镇静催眠作用药物对失眠患者睡眠结构的影响[J].中华神经科杂志,2010,43(1):69-71.
[2] 曾雪爱,黄俊山,王雅丽.松郁安神方对REM睡眠剥夺大鼠认知功能及神经递质的影响[J].中国中医基础医学杂志,2012,18(4):392-393,397.
[3] 黄建欧,赵忠新.大鼠睡眠剥夺方法的研究进展[J].中华神经医学杂志,2004,3(3):229-230.
[4] 叶晨静,赵忠新.快速眼球运动睡眠剥夺对大鼠学习、记忆能力及其海马组织脑源性神经营养因子表达的影响[J].第二军医大学学报,2007,28(1):82-86.
[5] 张微胜,侯一平,王德贵,等.异相睡眠剥夺对大鼠空间学习记忆的影响[J].中国行为医学科学.2004,13(5):496-498.
[6] HEYWARD P.Presenilin dysfunction leads to memory and plasticit defects [J].Lancet Neurol,2004,3(6):327.
[7] 朱国庆,张惠秀,王敏,等.中枢应用外源性cAMP和ATP对大鼠睡眠的影响[J]. 中国应用生理学杂志,1993,9(2):189-190.
[8] LONZE B E,GINTY D D.Function and regulation of CREB family transcription factors in the nervous system [J].Neuron,2002,35(4):605-623.
[9] LUO J,PHAN T X,YANG Y,et al.Increases in cAMP,MAPK activity,and CREB phosphorylation during REM sleep:implications for REM sleep and memory consolidation [J].J Neurosci,2013,33(15):6460-6468.
[10] ALHAIDER I A,ALEISA A M,TRAN T T,et al.Sleep deprivation prevents stimulation-induced increases of levels of P-CREB and BDNF:protection by caffeine [J].Molecular and Cellular Neuroscience,2011,46(4):742-751.
