肠道微生态与非消化系统疾病的研究进展
2018-04-24任慧妍蒋建霞
任慧妍,蒋建霞
1. 南京医科大学 基础医学院,江苏 南京 210029;2. 南京医科大学第一附属医院 消化科,江苏 南京 210029
肠道是人类微生物群栖息的重要的生态环境,其内的微生物群体丰富多样,参与了机体代谢、免疫等各方面的生理作用[1],其中主要的4种肠道菌是厚壁菌、拟杆菌、放线菌和变形菌[2]。肠道微生物组成作为人体微生态系统中最重要最复杂的一部分,它的稳定对于肠道黏膜屏障的构建具有重要作用[3]。内外源性的病理因素可破坏肠道微生态,引起一系列消化道与非消化道疾病。随着肠道微生态与消化系统疾病研究的不断深入,人们越来越多地关注起肠道微生态与非消化系统疾病的关系。本文主要着重讨论肠道微生态改变对于非消化系统相关疾病的影响,对临床文献进行综合,简要阐述肠道微生态改变与非消化系统相关疾病的现状、研究进展及临床治疗。
1 肠道微生态系统及其与消化系统疾病的相关性
肠道微生物群是一组生活在人体和其他动物消化道中的复杂微生物的总称。在人类中,菌群的组成不仅受遗传和年龄影响,还受到饮食和环境的影响[2]。事实上,肠内细菌数量约为人类所有细胞的数量的10倍[4]。肠道微生物群的成熟大都发生在生命的最初三年[5]。有关肠道的微生物基因分析显示,人体肠道菌群的基因总数超过人类基因总数的150倍,并且肠道不同部位和不同生理结构的菌种存在差异[6],不同个体还可能存在许多相同的细菌种类[7]。在机体正常情况下,肠道微生物群不仅能促进肠道消化吸收,在促进体内平衡作用如调节免疫功能、上调细胞保护基因、预防和调节细胞凋亡以及维持屏障功能方面也发挥着重要作用[8]。
近年来,多项研究表明,肠道微生态系统紊乱和消化系统疾病具有密切联系。使用广谱抗生素破坏肠道微生态能导致抗生素相关性腹泻[4],儿童早期缺乏微生物的暴露,缺乏膳食纤维,会抑制抗体的适当发展,能使宿主易于患炎症性肠病(包括克罗恩病和溃疡性结肠炎)[9]。血浆中促炎细胞因子的增加以及肠屏障功能、菌群分布和数量的改变与肠易激综合征有关[10]。肠道微生态可能通过诱导肠道黏膜炎症反应信号异常和在机体营养物质代谢过程中产生致癌的有毒代谢物质,参与结直肠癌的发生发展[11]。还有研究报道,肠道微生物可能通过影响常规腺瘤的发展在结肠直肠癌发生的早期阶段发挥作用[12]。并且不同肠道肿瘤干细胞群表型之间潜在的相互转化可能受到肠道微环境的影响[13]。
2 肠道微生态与非消化系统疾病的相关性
肠道微生态不仅与消化系统疾病息息相关,还与消化系统外的疾病有着密不可分的联系。微生物和宿主之间有益相互作用的核心,是细菌和肠道内其他微生物与宿主免疫系统的相互交流,并参与各种对宿主和微生物都有利的代谢过程[4]。因此肠道菌群结构与数量的改变,或正常菌群的移位都有可能使宿主机体免疫力降低,产生炎性反应,从而造成各种局部及全身性疾病。
2.1超重/肥胖与肠道微生态 超重和肥胖是指可损害人体健康的异常或过量脂肪累积。当前,由于经济社会的发展,人们生活水平提高,饮食习惯发生改变,肥胖已经成为了一种常见的社会性疾病。根据中国家庭营养与健康调查(CHNS)数据,2009年中国超重人口达到5.29亿,肥胖人口达到1.28亿,从1989到2009年的20年间净肥胖人口年均增长率达38.1%[14]。而肠道微生态的变化在肥胖的产生中起到了不可忽视的作用。
肠道是能量吸收的重要器官。当能量的摄取超过能量的消耗时,多余的能量将会以甘油三酯的方式储存于白色脂肪组织中[15]。肠道微生物可以通过肠道中的信号通路影响宿主新陈代谢,对脂肪储存中的炎症、胰岛素抵抗和能量沉积产生影响,从而进一步调节机体肥胖程度,其效率取决于菌群组成。与此同时,肥胖也能反作用于肠道微生态,影响肠道微生物的组成[16]。肥胖宿主的微生物群多样性减少,并且在其体内的微生物中,从食物里提取能量的基因富集,宿主血清葡萄糖水平和短链脂肪酸(SCFAs)水平增加,进而增加肝脏产甘油三酯,能够使肥胖程度进一步加强[17]。宁光院士团队[18]的一项针对中国肥胖者的研究显示,在肥胖者肠道中多形拟杆菌的丰度下降,血清谷氨酸浓度升高;其对小鼠实验的结果显示,多形拟杆菌可通过抑制脂肪生成、促进脂类分解和脂肪酸氧化,来降低小鼠脂肪量、增加瘦肉组织;而袖状胃切除术可以部分恢复肥胖患者的肠道健康菌群,这可能有利于他们的减重。
2.2神经精神病与肠道微生态 脑和肠道微生物群之间的作用是相互的。一方面在抑郁症、慢性应激和自闭症患者观察到的生理障碍状态可能改变肠道的信号转导[19],中枢神经系统也可以通过调节饱腹感来控制机体食物摄入的饮食习惯的变化,来影响肠道微生物群的营养供应,从而影响其组成[20];另一方面,肠道微生物可以通过神经、内分泌、代谢和免疫机制来调控神经系统的功能,并与抑郁症、精神分裂症和帕金森等神经精神疾病相关[20]。肠道菌群对脑代谢的影响,取决于肠上皮和血脑屏障的完整性。这种影响很大程度上可以通过由肠细菌分泌的外膜囊泡(OMV)来调节,OMV可以进入体循环并被传递到包括大脑在内的不同的器官,引发各种免疫和代谢反应[21]。有研究显示,在急性抑郁症患者粪便中,拟杆菌、变形菌和放线菌的水平显著增加,而厚壁菌显著降低。并且粪便杆菌与抑郁症状的严重程度呈负相关[22]。第三军医大学魏泓教授课题组[23]采用无菌小鼠验证了肠道菌群对抑郁症的影响,利用粪菌移植技术将重度抑郁症患者的肠道菌群移植入无菌小鼠内,小鼠的碳水化合物及氨基酸代谢和相关微生物群基因受到干扰,可导致其出现抑郁症样的行为。这揭示了肠道微生态紊乱在抑郁症样行为发展过程中可能存在的因果作用。啮齿动物在受亚慢性苯环利定(subPCP)处理后,肠道核心微生物组发生改变,能产生精神分裂样综合征[24]。肠道微生态系统对帕金森的发病机制有重要的推动作用,肠道可能作为帕金森病向中枢神经系统传播的病理学起点,并且肠道α-突触核蛋白可以作为早期帕金森的可能生物标志物[25]。
2.3皮肤病与肠道微生态 肠道菌群影响皮肤发病的机制尚不完全清楚,仍然是研究的活跃领域。目前已知,肠道菌群可以通过至少3种途径来影响皮肤:肠道菌群产生特定化学因子进入循环系统到达皮肤、肠道菌群自身进入循环到达皮肤和免疫引起皮肤炎症[26]。Clark等[27]指出肠道微生物可能增加寻常痤疮患者血液中循环内毒素的存在。虽然肠道和皮肤相互作用的机制了解甚少,但是痤疮似乎具有潜在的肠道—皮肤连接。一组研究表明皮肤牛皮癣患者肠道放线菌水平低于健康对照组,并且与牛皮癣面积和严重程度(PASI)呈统计学负相关,同时牛皮癣患者和对照组厚壁菌/拟杆菌比值与PASI呈显著正相关[28]。另一项调查显示,过敏性紫癜(HSP)患儿肠黏膜上皮损伤,影响肠道共生菌的能量供给及受体识别结合,产生异常排斥反应,造成急性期肠道菌群结构失调,主要表现为乳杆菌、双歧杆菌含量下降。当肠道菌群紊乱时,肠道内共生菌阻止致病菌入侵、抑制炎症反应等作用减弱,从而有助于HSP的发生发展[29]。还有学者认为可能存在肠道—皮肤轴的参与,通过影响Th17细胞反应活性,参与了皮肤炎症反应[30]。
2.4心脑血管疾病与肠道微生态 改革开放以来,由于生活条件和饮食条件的改变,中国心血管疾病发病率急剧上升。《中国心血管报告2016》推算目前我国心血管患病人数达2.9亿,心血管病死亡率居首位,高于肿瘤和其他疾病[31]。而急性脑血管病是单病种致残率最高的疾病,其高发病率、高病死率和高致残率给社会、家庭和患者带来沉重的负担和巨大的痛苦[32]。
大量研究表明,肠道微生态与动脉粥样硬化、高血压、心力衰竭等心血管疾病相关。肠道微生物发酵产生SCFAs,通过嗅觉受体Olfr78和G蛋白偶联受体41(Gpr41)影响血管舒缩从而调节血压[33]。三甲胺-N-氧化物(TMAO)是一种特殊的膳食营养素的肠道微生物依赖代谢物,有研究者发现食物可以增加血浆中TMAO水平,使心脏中的炎症和间质纤维化升高,导致心脏功能障碍[34],还能促进动脉粥样性硬化的发展,使颅内外动脉狭窄[35]。肠道通透性增加、病原菌和真菌的增加,可促进心血管疾病的进展。此外,严重的心力衰竭可以直接改变豚鼠体内的粪便菌群,而不会造成明显的充血[36],这表明在排除其他因素的情况下,心血管疾病本身也会破坏肠道微生态。此外,心血管疾病的发生发展与口腔菌群的变化也有一定相关性,尤其是动脉粥样硬化[37],在此不做详细赘述。
肠道微生物群可以通过感染免疫系统、代谢胆固醇和脂肪、产生TMAO来影响动脉粥样硬化的发生发展[38]。有研究显示,症状性颅内外动脉狭窄患者肠道菌群结构明显改变,主要表现为肠杆菌属、脱硫弧菌属等有害机会定植菌含量的增加和有益菌含量的减少[35]。肠道微生物菌群的改变可能是诱发卒中后感染的关键因素[39],会影响卒中后的损伤修复以及导致卒中后抑郁[38]。
2.5消化道外肿瘤与肠道微生态 研究发现,肠道微生态不仅和结肠直肠癌有关,还能触发乳腺癌和前列腺癌。一些肠道细菌可能与雌激素的调节作用有关,肠道菌群的破坏可能会改变雌激素的再吸收,也会降低肠道黏膜的完整性,肠道细菌多样性与乳腺癌患病风险呈负相关[40]。胃肠道细菌感染能增强小鼠模型中的前列腺上皮内瘤变和微小浸润癌。在wnt信号通路调节异常、Apc(Min/+)突变的小鼠中,用幽门螺杆菌进行胃肠道感染后,患前列腺癌的风险增加。早期肿瘤还可以通过腹膜内注射来自突变小鼠的肠系膜淋巴结(MLN)细胞进行传播[41]。

3 肠道微生态制剂在相关疾病中的治疗作用
3.1微生态制剂 微生态制剂的主要成分为正常的微生物群,其中大部分为益生菌。WHO和联合国粮食及农业组织将益生菌定义为“对宿主有益的活性微生物群”。其主要通过抑制有害菌的生长、刺激酵解作用、刺激肠黏膜细胞增生和激活免疫系统来维持肠道微生态的平衡及肠黏膜屏障的完整[49]。当前,微生态制剂主要用于临床防治胃肠道消化系统疾病,但多种研究显示其对于非消化系统疾病的疗效也是十分显著。乳杆菌和双歧杆菌可以改变肠道细菌的丰度、减少巨噬细胞浸润到脂肪组织,有效地减轻高脂饮食喂养小鼠产生的肥胖[50]。长双歧杆菌能减少健康受试者的焦虑水平,还能降低应激皮质醇激素水平,同时受试者的视觉空间记忆也得到细微改善[51]。甚至早在上世纪30年代,就有医生用嗜酸乳杆菌培养物作为益生菌来治疗皮肤病[27]。有研究证实益生菌可以通过减少皮肤炎症细胞因子的释放来缓解过敏性和炎症性皮肤病[52]。在一项随机、双盲、安慰剂对照试验中,使用益生菌治疗的慢性收缩期心力衰竭患者在短期尿酸和总胆固醇水平降低,左室射血分数改善,这种治疗方法安全且耐受性良好[53]。益生菌能保护心脏,降低心血管疾病的危险因素[54]。在另一项关于干酪乳杆菌CRL431和乳腺癌关系的研究中,益生菌抑制了小鼠的肿瘤生长,减少了肿瘤血管分布,还降低肿瘤细胞外渗和肺转移[55]。益生菌还能减轻HIV患者局部和系统性炎症[47]。目前,微生态制剂在长期治疗效用方面还缺乏相关的研究报道。
3.2粪菌移植(FMT) 粪便微生物移植是指将健康人体的肠道微生物菌群转移到患者胃肠道内,使其肠道微生态恢复平衡,来治疗肠道微生物群紊乱相关性疾病。其实FMT作为一种治疗方式早在1 700多年前就被传统中医所使用[56]。我国学者张发明率先开展了标准化FMT,并且在标准化FMT治疗复发性艰难梭菌感染(CDI)中取得可喜进展[57]。FMT在消化系统疾病的治疗中的作用已经被很多研究所证实,甚至有专家推荐FMT作为CDI治疗的一线方案。FMT也有希望应用于治疗非消化系统疾病的领域。一项针对人体的研究显示,通过粪菌移植将瘦供体的肠道菌群移植到肥胖者的肠道后,肥胖者的胰岛素敏感性增加,粪便微生物多样性也显著增加[58]。这表明FMT可能成为未来治疗肥胖、代谢综合征和耐药性高血压方案的一部分。此外,FMT也对帕金森病和孤独症等神经精神疾病的症状有改善作用[59]。目前,尽管FMT对消化道疾病的治疗的研究已经相对成熟,但是FMT对其他非消化系统疾病的治疗缺乏更多的报道。其对部分非消化道疾病短期有效性已经得到证实,但是长期治疗的效用及安全性尚不明确。FMT标准化流程及工业化前景依然需要更加深入的研究。
4 总结与展望
综上所述,肠道微生态与众多非消化系统疾病息息相关。近年来,随着肠道微生态与消化系统疾病相关性研究方面取得巨大进展,肠道微生态与非消化系统疾病相关性的研究也进入了新阶段。特别是微生态制剂和标准化FMT的应用,将肠道微生态与相关性疾病的治疗紧密联系起来。但是,目前肠道微生态与很多非消化系统疾病的发病机制之间的关系尚未明确,肠道微生物群结构改变的比例和肠道菌移位的具体定位对疾病的发病影响还不清楚,因此对这些疾病的预防和治疗也受到限制。
未来需利用不断发展的分子生物学研究方法,将肠道微生态和非消化系统疾病的关联性变得更加明确,更多关于肠道微生态的治疗才能获得突破性进展。同时疾病的预防才会更加具有针对性。
[1] 赵青. 微生态环境与常见疾病[C]//中国药学会. 2014年中国药学大会暨第十四届中国药师周论文集. 石家庄: 中国药学会, 2014: 10.
[2]Lozupone CA, Stombaugh JI, Gordon JI, et al. Diversity, stability and resilience of the human gut microbiota[J]. Nature, 2012, 489(7415): 220-230.
[3]吴仲文. 肠道屏障与肠道微生态[J]. 中国危重病急救医学, 2004, 16(12): 768-770.
[4]Quigley EM. Gut bacteria in health and disease[J]. Gastroenterol Hepatol(NY), 2013, 9(9): 560-569.
[5]Yatsunenko T, Rey FE, Manary MJ, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486(7402): 222-227.
[6]Shen TY, Qin HL, Gao ZG, et al. Influences of enteral nutrition combined with probiotics on gut microflora and barrier function of rats with abdominal infection[J]. World J Gastroenterol, 2006, 12(27): 4352-4358.
[7]Qin J, Li R, Raes J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65.
[8]Patel RM, Lin PW. Developmental biology of gut-probiotic interaction[J]. Gut Microb, 2010, 1(3): 186-195.
[9]Shen S, Wong CH. Bugging inflammation: Role of the gut microbiota[J]. Clin Transl Immunol, 2016, 5(4): e72.
[10] Dinan TG, Cryan JF. The impact of gut microbiota on brain and behaviour[J]. Curr Opin Clin Nutr Metabol Care, 2015, 18(6): 552-558.
[11] PAN Fei, REN Rongrong, YANG Yunsheng. Research progress on the relationship between gut microbiota and colorectal cancer[J]. EBM, 2017, 17(2): 120-124. (in Chinese)
潘飞, 任荣荣, 杨云生. 肠道微生态与结直肠癌关系的研究进展[J]. 循证医学, 2017, 17(2): 120-124.
[12] Peters BA, Dominianni C, Shapiro JA, et al. The gut microbiota in conventional and serrated precursors of colorectal cancer[J]. Microbiome, 2016, 4(1): 69.
[13] Dalerba P. The dynamic identity of intestinal cancer stem cells[J]. Cell Stem Cell, 2017, 20(6): 743-745.
[14] 中国超重肥胖医学营养治疗专家共识编写委员会. 中国超重/肥胖医学营养治疗专家共识(2016年版)[J]. 中华糖尿病杂志, 2016, 8(9): 525-540.
[15] YU Jinhai, ZHOU Linkang, WU Lizhen, et al. Basic research in obesity[J]. Chin Bull Life Sci, 2015, 27(3): 268-279. (in Chinese)
于进海, 周林康, 吴丽贞, 等. 肥胖的基础研究[J]. 生命科学, 2015, 27(3): 268-279.
[16] Hakkak R, Korourian S, Foley SL, et al. Assessment of gut microbiota populations in lean and obese Zucker rats[J]. PLoS One, 2017, 12(7): e181451.
[17] Ley RE. Obesity and the human microbiome[J]. Curr Opin Gastroenterol, 2010, 26(1): 5-11.
[18] Liu R, Hong J, Xu X, et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention[J]. Nat Med, 2017, 23(7): 859-868.
[19] Martin CR, Mayer EA. Gut-brain axis and behavior[J]. Nestle Nutr Inst Workshop Ser, 2017, 88: 45-53.
[20] Wang Y, Kasper LH. The role of microbiome in central nervous system disorders[J]. Brain Behav Immunity, 2014, 38(5): 1-12.
[21] Muraca M, Putignani L, Fierabracci A, et al. Gut microbiota-derived outer membrane vesicles: Under-recognized major players in health and disease?[J]. Discov Med, 2015, 19(106): 343-348.
[22] Jiang H, Ling Z, Zhang Y, et al. Altered fecal microbiota composition in patients with major depressive disorder[J]. Brain Behav Immunity, 2015, 48(4): 186-194.
[23] Zheng P, Zeng B, Zhou C, et al. Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host′s metabolism[J]. Mol Psychiatry, 2016, 21(6): 786-796.
[24] Pyndt JB, Krych L, Pedersen TB, et al. Investigating the long-term effect of subchronic phencyclidine-treatment on novel object recognition and the association between the gut microbiota and behavior in the animal model of schizophrenia[J]. Physiol Behav, 2015, 141(1): 32-39.
[25] Mukherjee A, Biswas A, Das SK. Gut dysfunction in Parkinson′s disease[J]. World J Gastroenterol, 2016, 22(25): 5742.
[26] O′Neill CA, Monteleone G, Mclaughlin JT, et al. The gut-skin axis in health and disease: A paradigm with therapeutic implications[J]. Bioessays, 2016, 38(11): 1167-1176.
[27] Clark A, Haas K, Sivamani R. Edible plants and their influence on the gut microbiome and acne[J]. Int J Mol Sci, 2017, 18(5): 1070.
[28] Doaa M, Dalia M, Ahmed FS. Gut bacterial microbiota in psoriasis: A case control study[J]. Afr J Microbiol Res, 2016, 10(33): 1337-1343.
[29] LUO Wen, XU Hua, CHEN Xiaoqing, et al. Intestinal microflora changes in children with Henoch-Schönlein purpura[J]. J Clin Pediatr, 2014, 32(10): 907-911. (in Chinese)
罗文, 许华, 陈晓晴, 等. 过敏性紫癜患儿肠道菌群的变化[J]. 临床儿科杂志, 2014, 32(10): 907-911.
[30] Zákostelská Z, Málková J, Klime?ová K, et al. Intestinal microbiota promotes psoriasis-like skin inflammation by enhancing Th17 response[J]. PLoS One, 2016, 11(7): e159539.
[31] 中国心血管病报告编写组. 《中国心血管病报告2016》概要[J]. 中国循环杂志, 2017, 32(6): 521-530.
[32] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国脑血管病一级预防指南2015[J]. 中华神经科杂志, 2015, 48(8): 629-643.
[33] Pluznick JL, Protzko RJ, Gevorgyan H, et al. Olfactory receptor responding to gut microbiota-derived signals plays a role in renin secretion and blood pressure regulation[J]. Proc Natl Acad Sci U S A, 2013, 110(11): 4410-4415.
[34] Chen K, Zheng X, Feng M, et al. Gut microbiota-dependent metabolite trimethylamine N-oxide contributes to cardiac dysfunction in western diet-induced obese mice[J]. Front Physiol, 2017, 8: 139.
[35] 尹恝, 周宏伟. 症状性颅内外动脉粥样硬化性狭窄患者肠道菌群特征[C]//中华医学会, 中华医学会神经病学分会. 中华医学会第十八次全国神经病学学术会议论文汇编(上). 成都: 中华医学会, 2015: 2.
[36] Phillips CR, Duffourc MM, Schoborg RV, et al. Aberrant fecal flora observed in guinea pigs with pressure overload is mitigated in animals receiving vagus nerve stimulation therapy[J]. Am J Physiol Gastrointest Liver Physiol, 2016, 311(4): G754-G762.
[37] TU Yan, CHEN Hui. Mechanism of cardiovascular disease caused by oral infection[J]. Int J Stom, 2010, 37(2): 182-185. (in Chinese)
屠彦, 陈晖. 口腔感染引发心血管疾病的机制[J]. 国际口腔医学杂志. 2010, 37(2): 182-185.
[38] XU Jie, WANG Yilong, WANG Yongjun. Gut microbiome and ischemic stroke[J]. Chin J Stroke, 2017, 12(2): 179-182. (in Chinese)
许杰, 王伊龙, 王拥军. 肠道菌群与缺血性卒中[J]. 中国卒中杂志, 2017, 12(2): 179-182.
[39] Wen SW, Wong C. An unexplored brain-gut microbiota axis in stroke[J]. Gut Microb, 2017, 8(6): 1-6.
[40] Fuhrman BJ, Feigelson HS, Flores R, et al. Associations of the fecal microbiome with urinary estrogens and estrogen metabolites in postmenopausal women[J]. J Clin Endocrinol Metab, 2014, 99(12): 4632-4640.
[41] Poutahidis T, Cappelle K, Levkovich T, et al. Pathogenic intestinal bacteria enhance prostate cancer development via systemic activation of immune cells in mice[J]. PLoS One, 2013, 8(8): e73933.
[42] McAleer JP, Kolls JK. Contributions of the intestinal microbiome in lung immunity[J]. Eur J Immunol, 2017, 48(1): 39-49.
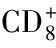
[44] Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota[J]. Proc Natl Acad Sci, 2010, 107(27): 12204-12209.
[45] Sommer F, Backhed F. The gut microbiota-masters of host development and physiology[J]. Nat Rev Microbiol, 2013, 11(4): 227-238.
[46] Qin N, Zheng B, Yao J, et al. Influence of H7N9 virus infection and associated treatment on human gut microbiota[J]. Sci Rep, 2015, 5(2): 14771.
[47] D′Angelo C, Reale M, Costantini E. Microbiota and probiotics in health and HIV infection[J]. Nutrients, 2017, 9(6). pii: E615.
[48] Ling Z, Jin C, Xie T, et al. Alterations in the fecal microbiota of patients with HIV-1 infection: An observational study in a Chinese population[J]. Sci Rep, 2016, 6: 30673.
[49] 董沛晶. 微生态制剂的应用研究进展[J]. 现代临床医学, 2017, 43(2): 91-93.
[50] Wang J, Tang H, Zhang C, et al. Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice[J]. ISME J, 2015, 9(1): 1-15.
[51] Allen AP, Hutch W, Borre YE, et al.Bifidobacteriumlongum1714 as a translational psychobiotic: Modulation of stress, electrophysiology and neurocognition in healthy volunteers[J]. Transl Psychiatry, 2016, 6(11): e939.
[52] Hacini-Rachinel F, Gheit H, Le Luduec JB, et al. Oral probiotic control skin inflammation by acting on both effector and regulatory T cells[J]. PLoS One, 2009, 4(3): e4903.
[53] Costanza AC, Moscavitch SD, Faria Neto HC, et al. Probiotic therapy withSaccharomycesboulardiifor heart failure patients: A randomized, double-blind, placebo-controlled pilot trial[J]. Int J Cardiol, 2015, 179: 348-350.
[54] Al KS, Reichert B, Shatat IF. The microbiome and blood pressure: Can microbes regulate our blood pressure?[J]. Front Pediatr, 2017, 5: 138.
[55] Yang J, Tan Q, Fu Q, et al. Gastrointestinal microbiome and breast cancer: correlations, mechanisms and potential clinical implications[J]. Breast Cancer, 2017, 24(2): 220-228.
[56] Zhang F, Luo W, Shi Y, et al. Should we standardize the 1,700-year-old fecal microbiota transplantation?[J]. Am J Gastroenterol, 2012, 107(11): 1755-1756.
[57] Zhang F. Fecal microbiota transplantation for severe enterocolonic fistulizing Crohn′s disease[J]. World J Gastroenterol, 2013, 19(41): 7213.
[58] Vrieze A, Van Nood E, Holleman F, et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome[J]. Gastroenterology, 2012, 143(4): 913-916.
[59] Aroniadis OC, Brandt LJ. Fecal microbiota transplantation: Past, present and future[J]. Curr Opin Gastroenterol, 2013, 29(1): 79-84.
