双歧杆菌三联活菌散对儿童轮状病毒性肠炎患者肠道菌群及肠黏膜通透性的影响
2018-04-24蔡海芳
蔡海芳
丽水市中心医院 儿科,浙江 丽水 323000
轮状病毒(rotavirus,RV)是引起儿童急性腹泻的主要病原体之一,其病情相对较重,易发生电解质酸碱平衡紊乱等各种并发症,严重时可危及生命[1]。轮状病毒性肠炎(rotavirus enteritis,RVE)的发病机制至今尚未阐明,肠道菌群紊乱及其引起的肠黏膜通透性改变在RVE发病中的作用越来越受到重视[2-3]。近年来研究发现微生态制剂辅助治疗儿童RVE效果较好,但其对肠道菌群及肠黏膜通透性的影响鲜有报道[4]。本研究分析了双歧杆菌三联活菌散对儿童RVE患者肠道菌群及肠黏膜通透性的影响,并分析其疗效。
1 对象与方法
1.1一般资料 选取94例RVE患儿,均为2016年1月至2017年8月于丽水市中心医院儿科门诊治疗的病例。纳入标准:(1)与《儿科学》第6版中的诊断标准相符[5];(2)大便ELISA法快速检测RV抗原阳性;(3)年龄12个月~36个月。排除标准:(1)伴有重度脱水或合并严重并发症患儿;(2)治疗前2个月使用过抗生素和益生菌的患儿。全部入选病例采用随机数字表分为两组。两组患儿性别、年龄、病程、大便频率和脱水程度等基本情况差异无统计学意义(P>0.05)。见表1。
1.2治疗方法 两组患儿均予以调整饮食、补液、调节电解质紊乱和酸碱失衡等治疗。观察组患儿加用双歧杆菌三联活菌散(上海信谊药业有限公司,批号:20150927)1.0 g/次,3次/d,温水冲服,两组患儿疗程均为72 h。观察两组患儿治疗前后肠道菌群(双歧杆菌、乳杆菌和大肠埃希菌)数量及肠黏膜通透性指标[内毒素(ETX)和D-乳酸]的变化,并比较其临床疗效。
1.3指标检测
1.3.1肠道菌群检测 取3 g湿粪便样品常规离心后洗涤,采用细菌DNA试剂盒(Sigma公司)提取湿粪便样品中的细菌总DNA进行PCR扩增,扩增引物见表2。将粪便细菌DNA标本和相应标准品进行PCR反应,系统软件自动计算出Ct值,并绘出标准曲线,使用Ct值与标准曲线定量测定乳杆菌、双歧杆菌和大肠埃希菌数量。结果用每克粪便湿重中菌落数对数值表示(lgCFU/g)。
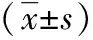
表1 两组患儿一般资料比较
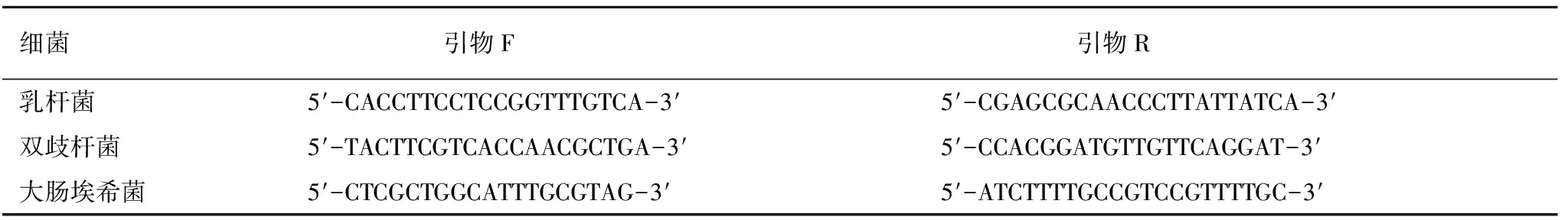
表2 肠道菌群扩增引物
1.3.2ETX和D-乳酸检测 取患儿空腹静脉血3~5 mL,3 000 r/min低温离心10 min分离出上层血清,置于-70℃冰箱保存待检。采用鲎试剂偶氮显色基质法(鲎试剂购自厦门市鲎试剂公司)测定血清 ETX水平,采用联免疫吸附法(试剂盒购自南京建成科技公司)测定血清D-乳酸水平。
1.3.2疗效评估标准[6]显效:治疗后患儿粪便性状及大便次数基本恢复正常,全身症状完全消失。有效:治疗后患儿大便次数减至<3次/d,粪便外观性状明显好转,全身症状基本消失。无效:未符合上述评估标准。除无效外其余均为总有效。
1.4统计学方法 应用SPSS 19.0软件进行数据分析,计量资料比较采用t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1肠道菌群数量对比 治疗72 h后,观察组患儿双歧杆菌、乳杆菌数量明显增加,大肠埃希菌数量明显下降(P<0.05),而对照组患儿治疗前后差异无统计学意义(P>0.05)。治疗后,观察组患儿双歧杆菌、乳杆菌数量高于对照组,大肠埃希菌数量低于对照组(P<0.05)。见表2。

表2 两组患儿肠道菌群数量对比
注:a:与同组治疗前比较,t=2.43、2.38、2.31,P<0.05;b:与对照组治疗后比较,t=2.37、2.34、2.27,P<0.05。
2.2血清ETX和D-乳酸水平对比 治疗72 h后,两组患儿血清ETX和D-乳酸水平明显下降(P<0.05),且观察组下降幅度更大(P<0.05)。见表3。
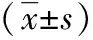
表3 两组患儿血清ETX和D-乳酸水平对比
注:a:与同组治疗前比较,t=2.41、2.37、3.38、3.42,P<0.05;b:与对照组治疗后对比,t=2.34、2.41,P<0.05。
2.3疗效分析 治疗72 h后,观察组患儿总有效率高于对照组(χ2=4.37,P<0.05)。见表3。

表3 两组患儿疗效比较[n(%)]
3 讨 论
3.1儿童轮状病毒肠炎患者肠道菌群和肠黏膜通透性情况[7-9]近年来研究已证实肠道菌群紊乱参与了RVE的发病过程。RV主要侵袭机体肠微绒毛柱状上皮细胞使其发生空泡变性和坏死,出现吸收障碍和腹泻;加上肠微绒毛上皮细胞受RV病毒入侵后,双糖酶的分泌量明显下降且其活性亦发生障碍,不能正常分解乳糖,使得肠腔渗透压明显增高而发生渗透性腹泻,从而破坏了患儿肠道的厌氧环境,有利于需氧菌的繁殖。同时,益生菌生存的肠道微环境被破坏,使得患儿肠道内双歧杆菌、乳杆菌等益生菌数量减少,而大肠埃希菌、肠球菌等致病菌数量增加。肠道菌群的破坏,使得肠黏膜表面形成的“菌群屏障”受损,增加了肠黏膜通透性,进一步引起肠液的大量分泌,形成恶性循环。因此,纠正肠道菌群紊乱和降低肠黏膜的通透性是目前治疗儿童RVE的新途径。
3.2双歧杆菌三联活菌散对RVE患儿的作用 双歧杆菌三联活菌散口服后进入肠道,能直接粘附于肠壁并逐渐生长繁殖,不仅可直接补充肠道益生菌,还可竞争拮抗致病菌的生长,使得肠道微生态平衡逐渐恢复,并能保护与修复受损的肠黏膜,降低其通透性,促进水钠重吸收,减轻腹泻[10-11]。同时,能激活肠道的局部淋巴组织,增加腹腔内单核巨噬细胞活性,稳定肠黏膜免疫屏障,减轻肠黏膜炎症反应[12-14]。本研究显示观察组患儿治疗72 h后肠道双歧杆菌和乳杆菌数量上升,而大肠埃希菌数量明显下降,且治疗后双歧杆菌、乳杆菌数量较对照组更高,大肠埃希菌数量较对照组更低;同时观察组患儿血清ETX和D-乳酸水平下降幅度较对照组更大,临床总有效率高于对照组。表明双歧杆菌三联活菌散治疗儿童RVE的疗效较佳,能增加双歧杆菌、乳杆菌等有益菌的数量,减少大肠埃希菌等致病菌的数量,纠正并恢复被破坏的肠道菌群结构,改善患儿肠道微生态,降低肠黏膜通透性,减少肠液的分泌渗出。双歧杆菌三联活菌散治疗儿童RVE可能通过改善患儿肠道微生态,恢复肠道正常菌群,抑制RV病毒在肠道定植,保护其微绒毛上皮细胞免遭RV病毒入侵,降低肠黏膜通透性,保护与修复肠黏膜屏障功能,减少肠液的大量分泌,从而控制患儿的腹泻达到治疗的目的[15-17]。由于肠黏膜通透性直接测定较困难,本研究选择血清ETX和D-乳酸水平间接评估肠黏膜通透性,可能存在一定的实验误差。
[1] Turner A, Ngwira B, Witte D, et al. Surveillance of rotavirus gastro-enteritis in children in Blantyre, Malawi[J]. Paediatr Int Child Health, 2013, 33(1): 42-45.
[2]WU Shuiying. Discussion on condition of rotavirus diarrhea combined with disorder of intestinal flora of children[J]. Chin J Nosocomiol, 2012, 22(23): 5299-5301. (in Chinese)
吴水英. 婴幼儿轮状病毒腹泻并发肠道菌群失调状态的探讨[J]. 中华医院感染学杂志, 2012, 22(23): 5299-5301.
[3]YE Ping, HE Rui. Research on changes of intestinal flora of children with rotavirus diarrhea for children with different months[J]. Int J Lab Med, 2014, 35(1): 44-46. (in Chinese)
叶萍, 贺锐. 不同月龄轮状病毒性腹泻患儿肠道菌群变化的研究[J]. 国际检验医学杂志, 2014, 35(1): 44-46.
[4]NI Ronghua, TANG Huilin, ZHAI Suodi, et a1. Multiple treatments for infantile rotavirus enteritis: A network meta-analysis[J]. World Chin J Digestol, 2012, 20(5): 438-443. (in Chinese)
倪容华, 唐惠林, 翟所迪, 等. 婴幼儿轮状病毒性肠炎多干预措施的荟萃分析[J]. 世界华人消化杂志, 2012, 20(5): 438-443.
[5]YANG Xiqiang, YI Zhuwen. Pediatrics[M]. 6thed. Beijing: People′s Medical Publishing House, 2004: 295-296. (in Chinese)
杨锡强, 易著文. 儿科学[M]. 6版. 北京: 人民卫生出版社, 2004: 295-296.
[6]Group of Gastroenterology. Society of Pediatric, Chinese Medical Association. Experts′ consensus on principles of diagnosis and treatment of diarrhea on children[J]. Chin J Pediatr, 2009, 47(8): 634-636. (in Chinese)
中华医学会儿科消化学组. 儿童腹泻病诊断治疗原则的专家共识[J]. 中华儿科杂志, 2009, 47(8): 634-636.
[7]ZHANG Meiling, DU Huiming, GUO Mehong. Comparison of microbial community structure in healthy and rotavirus infected children[J]. Chin J Microecol, 2006, 18(3): 164-166. (in Chinese)
张美玲, 杜惠敏, 郭美蕻, 等. 健康儿童与轮状病毒感染儿童肠道菌群结构的比较研究[J]. 中国微生态学杂志, 2006, 18(3): 164-166.
[8]Laine L, Takeuchi K, Tarnawski A. Gastric mucosal defense and cytoprotection: Bench to bedside[J]. Gastroenterology, 2008, 135(1): 41-60.
[9]Moghaddam HS, Moghaddam HN, Kermanshahi H. The effect of vitamin A on Mucin 2 gene expression histological and performance of broiler chicken[J]. Global Veterinaria, 2010, 5(3): 168-174.
[10] WANG Liyuan, XIE Yongmei, WANG Zhiling, et al. Dynamic changes of intestinal flora of children with rotavirus enteritis adjusted by probiotics[J]. J Appl Clin Pediatr, 2011, 26(7): 489-491. (in Chinese)
王丽媛, 谢咏梅, 汪志凌, 等. 益生菌调节轮状病毒肠炎患儿肠道菌群的动态变[J]. 实用儿科临床杂志, 2011, 26(7): 489-491.
[11] ZHANG Xusong, ZHANG Xiuping. Influence and curative effect observation of live combinedBifidobacterium,LactobacillusandEnterococcusPowder on serum inflammatory factors in infants and young children with rotavirus enteriti[J]. Chin J Pharmacoepidemiol, 2015, 24(11): 651-653. (in Chinese)
张旭松, 张秀萍. 双歧杆菌三联活菌散对轮状病毒性肠炎婴幼儿血清炎症因子的影响及疗效观察[J]. 药物流行病学杂志, 2015, 24(11): 651-653.
[12] LI Biying. Influence of probiotics on intestinal barrier function and intestinal flora of infants and children with rotavirus diarrhea[J]. Chin J Integr Tradit & West Med Dig, 2015, 23(12): 871-873. (in Chinese)
李碧莹. 益生菌对婴幼儿轮状病毒性腹泻肠道屏障功能及肠道菌群的影响[J]. 中国中西医结合消化杂志, 2015, 23(12): 871-873.
[13] Michos A, Terzidis A, Kanariou M, et al. Association of allergic sensitization with infections disease burden in Roma and non-Roma children[J]. Pediatr Allergy Immunol, 2011, 22(2): 243-248.
[14] SHEN Qian, YANG Rongwei. Curative effect and security of Bifid Triple Viable Powder in treatment of antibiotic associated diarrhea in children[J]. Chin J Microecol, 2014, 26(11): 1305-1307. (in Chinese)
沈潜, 杨戎威. 双歧杆菌三联活菌散治疗儿童抗生素相关性腹泻的疗效及安全性观察[J]. 中国微生态学杂志, 2014, 26(11): 1305-1307.
[15] CAO Ping, YU Chenggong. Effect of Triple Viable Bacterium of bacillus on intestinal microflora and inflammation factors in patients with infectious diarrhea[J]. Chin J Biochem Pharms, 2015, 35(6): 62-64, 67. (in Chinese)
曹萍, 于成功. 双歧杆菌三联活菌散对感染性腹泻患者肠道菌群和炎症因子的影响[J]. 中国生化药物杂志, 2015, 35(6): 62-64, 67.
[16] ZHANG Lili, ZHENG Pengyuan, LUO Yu, et al. Influence ofBifidobacteriumon gut barrier function and Th1/Th2 cytokine in food allergic mice[J]. World Chin J Digestol, 2009, 17(11): 1091-1097. (in Chinese)
张利利, 郑鹏远, 罗予, 等. 双歧杆菌对食物过敏小鼠肠道屏障功能及Th1/Th2细胞因子的影响[J]. 世界华人消化杂志, 2009, 17(11): 1091-1097.
[17] Rosenfeldt V, Michaelsen K, Jakobsen M, et al. Effect of probioticLactobacillusstrains on acute diarrhea in a cohort of nonhospitalized children attending day-care centers[J]. Pediatr Infect Dis J, 2002, 21(5): 417-419.
