SRSF1和BIRC5在胃癌组织中的表达及临床意义
2018-04-24李晓春郝银恒柳长明
李晓春,郝银恒,柳长明
1.佳木斯大学,黑龙江 佳木斯 154007; 2.河南科技大学第二附属医院,河南 洛阳 471000; 3.深圳市第七人民医院,广东 深圳 518000
胃癌(gastric cancer)是世界范围内常见的恶性肿瘤之一,在发展中国家胃癌发生率比较高,占世界胃癌总发生率的67%左右[1]。如今人们认识到胃癌同其他恶性肿瘤一样是一种分子疾病,因此,从凋亡途径来探究胃癌的发生与发展具有一定的研究价值。具有肿瘤特异性的凋亡抑制基因家族成员BIRC5一般情况下只表达于肿瘤组织和胚胎组织[2-3],资料显示,胃癌肿细胞中BIRC5呈现上调表达,而在正常分化组织中几乎不表达,与胃癌的发生、发展有着密不可分的关系[4]。人丝氨酸/精氨酸富有剪接因子1(serine/arginine rich splicing factor 1,SRSF1)是SR蛋白家族的原型成员,它亦是一种原癌蛋白,在乳腺癌、白血病及肺癌等恶性肿瘤的患者体内中呈现过表达现象[5]。学者认为,SRSF1之所以参与多种复杂的生物学通路取决于其对前体mRNA的选择性剪接与加工、胞内定位与运输等生理过程,从某种程度上控制着下游相关蛋白的表达程度及功能的发挥。研究表明,SRSF1与BIRC5在前列腺癌肿组织中均有高表达,BIRC5蛋白表达量的升高与SRSF1蛋白表达量的升高呈正相关[6];然而关于SRSF1和BIRC5在胃癌中表达的相关研究很少,本研究旨在通过RT-PCR和Western blot技术检测两基因在胃癌肿组织及其癌旁组织中的表达情况,进而探究两者与胃癌发生、发展之间可能存在的关系。
1 材料与方法
1.1一般材料 留取60例2016年5月至2017年5月于我院(佳木斯大学第一附属医院)普通外科进行胃癌切除患者的癌肿标本及其相应的癌旁组织,留取的癌旁组织距离其癌肿边缘均大于50 mm。标本均存储于液氮中备用。本研究始终遵循中华医学伦理委员会制定的伦理标准,患者术前通过影像学检查、血液学检查均未发现其他系统恶性肿瘤,术前未行放疗、化疗、射频治疗及免疫治疗,术中所选标本病理回报确认为胃癌。60例胃癌患者的胃癌标本中,男性32例,女性28例;年龄在40~86岁,平均59.7岁;TNM分期:Ⅰ~Ⅱ期37例,Ⅲ~Ⅳ期23例;术中证实有淋巴转移者15例,否认淋巴转移者45例。
1.2检测方法
1.2.1实验试剂 鼠抗人单克隆SRSF1抗体及β-actin抗体(购自福建迈新),BIRC5、SRSF1及内参引物(Bioengineering公司合成)。提取RNA Kit、逆转录试剂盒(QIAGENE公司,Germany),Taq DNA聚合酶及dNTPs购自TaKaRa。BIRC5(sc-101432)、SRSF1(sc-33652)抗体、Actin(sc-10731)及HRP标记的羊抗鼠二抗(sc-2005)购自Santa Cruz。ECL Plus western blotting detection reagents(RPN2132,GE,Piscotoway,NJ,USA),X光胶片(Eastman Kodak Co.)。
1.2.2总RNA提取 参照miRNeasy Mini Kit提供的说明书进行mRNA和microRNA的总RNA提取。
1.2.3逆转录反应 SRSF1 mRNA、BIRC5 mRNA cDNA,均采用Invitrogen的SuperScriptTMFirst-strand Synthesis System进行合成,引物为oligo-dt。采用Invitrogen的SuperScriptTMII试剂盒,严格按照说明书步骤操作mRNA的逆转录反应生成cDNA。将所有产物存储于-20℃备用。
1.2.4半定量PCR法 参照文献[7]BIRC5及SRSF1的PCR扩增,应用miScript SYBR Green PCR试剂盒三步法。SRSF1扩增时无需加入miScript通用引物。BIRC5及SRSF1的PCR扩增引物:SRSF1 sense:5′-CGTTGAGTTCGAGGACC-CG-3′,SRSF1 Anti-sense:5′-TAACCCGGATGT-AGGCAG-3′,BIRC5 sense:5′-ATGGGTGCCCC-GACGT-3′,BIRC5 Antisense:5′-ACAGCAGTG-AGTCTGTC-3′,内参为β-actin:Sense:5-CTGA-CAGACTACCTCATGAAG-3,Antisense:5-TCA-ATCCATGGCAGC-3,反应条件:预变性94℃、5 min;变性94℃、30 s,退火60℃、30 s,72℃、30 s,延伸72℃、7 min,30个循环。待反应结束后通过琼脂糖凝胶电泳技术检测最终产物。
1.2.5应用蛋白质印迹法(Western blot)检测SRSF1及BIRC5蛋白表达强度 参照说明书的提示提取组织总蛋白,完成蛋白浓度测定:取50 μg蛋白,与6×loading buffer混合后,65℃水浴10 min。12% SDS-PAGE电泳分离后转PVDF膜上,PVDF膜在5%脱脂奶粉35℃封闭60 min。经TBST充分洗膜后,与anti-SRSF1抗体(1∶500),anti-BIRC5 antibody(1∶400)室温孵育60 min,TBST buffer洗膜3次,共15 min,与HRP标记的二抗室温孵育60 min,TBST buffer充分漂洗3次,每次5 min。采用ECL plus western blotting detection reagents使胶片进行曝光。以β-actin作为内参照,SRSF1/β-actin比值、BIRC5/β-actin即为蛋白表达强度。

2 结 果
2.1SRSF1和BIRC5在胃癌肿组织中的表达情况及临床病理特征之间的关系 在胃癌肿组织中SRSF1的表达情况:SRSF1阳性表达率为75.0%(45/60),明显高于其癌旁组织的8.3%(5/60),差异有统计学意义(χ2=46.5103,P=0.000);BIRC5 mRNA的表达情况:BIRC5阳性表达率为81.7%(49/60),高于癌旁组织中的11.7%(7/60),差异有统计学意义(χ2=39.1152,P=0.000);胃癌肿组织中SRSF1 mRNA与BIRC5 mRNA的阳性表达尽管与其患者所处的年龄阶段、性别差异以及肿瘤大小等因素无关,但是癌肿组织的分化程度、淋巴结是否发生转移以及TNM分期都与之有着密不可分的关联(见图1、图2,表1)。

N1、N2、N3:癌旁组织,C1、C2、C3:癌组织;胃癌组织和癌旁组织中SRSF1统计学分析:胃癌组织/癌旁组织=3.3倍
图1胃癌患者SRSF1 mRNA表达分析

N1、N2、N3:癌旁组织,C1、C2、C3:癌组织;胃癌组织和癌旁组织中BIRC5统计学分析:胃癌组织/癌旁组织=2.48倍

图2 胃癌患者BIRC5 mRNA表达分析
2.2SRSF1和BIRC5在胃癌组织中的关系 在存留的60例胃癌标本中,SRSF1表达阳性的有45例,阴性15例;BIRC5表达阳性者49例,阴性11例;同一标本中两者均呈阳性者有41例,阴性的有6例。SRSF1与BIRC5在胃癌肿组织中的阳性表达正相关(r=0.3496,P=0.006<0.01),见表2。
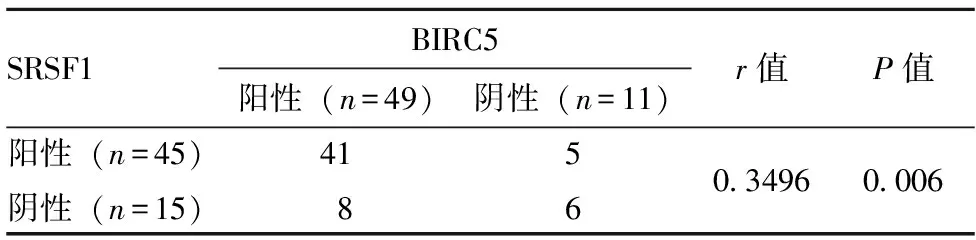
表2 胃癌中SRSF1和BIRC5之间的关系
2.3SRSF1和BIRC5蛋白相对表达水平 在胃癌肿组织及对应癌旁组织内均可见SRSF1和BIRC5的蛋白条带;检测分析其蛋白条带灰度值后可见:胃癌肿组织中SRSF1的蛋白表达量相较于癌旁组织中蛋白的表达量明显增高(t=44.87,P<0.01);BIRC5蛋白在胃癌肿组织中表达量同样比其在癌旁组织中的蛋白表达量高(t=69.34,P<0.01);(图3、图4,表3)。

SRSF1蛋白表达分析(内参β-actin), N1、N2、N3:癌旁组织;C1、C2、C3:胃癌组织;胃癌组织和癌旁组织中SRSF1统计学分析:;胃癌组织/癌旁组织=3.08倍
图3胃癌患者SRSF1蛋白表达分析

BIRC5蛋白表达分析(内参β-actin), N1、N2、N3:癌旁组织;C1、C2、C3:胃癌组织;胃癌组织和癌旁组织中SRSF1统计学分析;胃癌组织/癌旁组织=1.73倍
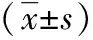
图4 胃癌患者BIRC5蛋白表达分析
3 讨 论
3.1研究结果 实验结果显示,在胃癌肿组织中SRSF1、BIRC5两基因的表达相较于其癌旁组织均表现出异常增高,两者存在正相关。临床病理特征统计表明,胃癌肿组织中SRSF1 mRNA与BIRC5 mRNA的阳性表达虽然与其患者所处的年龄阶段、性别差异以及肿瘤大小等因素无关,但是与其癌肿组织的分化程度、淋巴结是否发生转移以及TNM分期有关,进一步证明了SRSF1与BIRC5的高表达有着促进胃癌发生、发展的功能。
资料显示,SRSF1过表达是导致肿瘤发生的重要因素[8-11],其调节可变剪接事件已被证实有助于肿瘤发生[11]。过表达的SRSF1在Wnt-β-catnin信号通路中,是通过促进基因剪接形成抗凋亡亚型,抑制细胞凋亡。SRSF1可以增强蛋白翻译激活因子的磷酸化或者抑制蛋白翻译的抑制因子这两种方式同时促进细胞增殖[2,12]。学者发现,SRSF1是通过调节细胞的凋亡程序,参与肿瘤的发生、发展,然而细胞的凋亡抑制则是促进肿瘤迅速发生、发展的主要因素之一[6]。因此,不难断定在正常组织细胞突变成异常增生细胞的过程中与细胞的凋亡抑制有着密不可分的联系。BIRC5是凋亡抑制基因家族中新近发现的成员,在抑制细胞凋亡方面效果显著,查阅基因库可知BIRC5参与了人类多种恶性肿瘤的发生与发展。从组织分布上来看BIRC5通常表达于胚胎和发育的胎儿组织,对于成人而言除胸腺、生殖腺外其他组织器官未见表达[13]。在肿瘤组织中 BIRC5呈现阳性表达,这与BIRC5是目前已知的作用较强的凋亡抑制蛋白有关[2-3]。有研究显示SRSF1与BIRC5在前列腺癌肿组织中同时呈现高表达,并且BIRC5蛋白表达量的升高与SRSF1蛋白表达量的升高呈正相关[6],可能与细胞凋亡的信号通路中断有关。目前,死亡受体途径和线粒体途径是细胞凋亡的两条主要途径,两者均需要通过激活下游的效应因子caspase-3及caspase-7来联通信号通路,BIRC5蛋白则是直接粘附于活化的caspase-3、caspase-7上,使其不能发挥效能,信号通路由此中断[3,14]。推测胃癌的发生、发展可能与过表达的SRSF1通过上调BIRC5的表达来阻断细胞凋亡信号通路有关。
3.2研究意义 实验证实了SRSF1和BIRC5基因的高表达与胃癌的发生、发展密切相关。在胃癌肿组织中SRSF1的高表达是促进凋亡抑制基因BIRC5高表达的一个因素,这为我们通过干预SRSF1的表达进而影响凋亡抑制因子BIRC5的表达来治疗及预防胃癌复发提供了理论基础以及实验依据。
3.3创新性 近年来从细胞凋亡途径来探讨肿瘤发病机制的研究屡见不鲜,然而将选择性剪接因子SRSF1与凋亡抑制因子BIRC5联系在一起应用于胃癌的研究则是屈指可数,该实验填充了这方面的空缺。
3.4不足与展望 由于实验条件的限制我们选取的标本数量少,这意味着实验结论不一定适合于所有胃癌患者,因此在后续的研究中还需通过对临床上大量胃癌标本的研究来验证实验结论。通过SRSF1和BIRC5的深入研究有望使其成为胃癌早期诊断的新标准,并且为临床上治疗及预防胃癌的复发提供新靶点。
[1] Zheng S. Review and current status of gastric cancer research in the past 30 years[J]. J Pract Oncol, 2016, 1(1): 2-4.
[2]Zhang J, Li F, Liu X, et al. The repression of human differentiation related gene BIRC5 expression by Myc via Miz-1-dependent interaction with the BIRC5 core promoter[J]. J Biol Chem, 2006, 281(51): 39159-39168.
[3]Shaw RJ, Cantley LC. Ras, P(3)K and mTOR signalling controls tumour cell growth[J]. Nature, 2006, 441(7092): 424-430.
[4]Moulton VR, Gillooly AR, Tsokos GC. Biquitination regulates expression of the serine/arginine-rich splicing factor 1(SRSF1)in normal and systemic lupus erythematosus(SLE)T cells[J]. J Biolog Chem, 2014, 289(7): 4126-4137.
[5]Mavrou A, Brakspear K, Hamdollah-Zadeh M, et al. Serine-arginine protein kinase 1(SRPK1)inhibition as a potential novel targeted therapeutic strategy in prostate cancer[J]. Oncogene 2015, 34(33): 4311-4319.
[6]Parsons DW, Wang TL, Samuels Y, et al. Colorectal cancer: Mutations in a signalling pathway[J]. Nature, 2005, 436(7052): 792.
[7]LAN Hongbo, PAN Jie, LU Xingrong, et al. Expression and clinical significance of miR-196b, mRNA and HoxB8 mRNA in gastric cancer tissues[J]. J Clin & Basic China Surg, 2013, 20(4): 400-405. (in Chinese)
兰鸿波, 潘杰, 卢星榕, 等, miR-196b, mRNA 和HoxB8 mRNA在胃癌中的表达及临床意义[J]. 中国普外基础与临床杂志, 2013, 20(4): 400-405.
[8]Tong JH, Sun Z, Wang ZN, et al. Early gastric cancer with sig-net-ring cell histologic type: Risk factors of lymph node metasta-sis and indications of endoscopic surgery[J]. J Surg, 2011, 96(33): 753.
[9]R?del F, Reichert S, Sprenger T, et al. The role of survivin for radiation oncology: Moving beyond apoptosis inhibition[J]. Curr Med Chem, 2011, 18(2): 191-199.
[10] Hu XL, Plescia J, Clevers H, et al. Expression analysis of the BIRC5 gene in mouse embryonic and adult tissues[J]. Cell Tissue Res, 2006, 325(1): 67-76.
[11] Deng Y, Yao L, Chau L, et al. N-Myc downstream-regulated gene 2(BIRC5) inhibits glioblastoma cell proliferation[J]. Int J Cancer, 2003, 106(3): 342-347.
[12] Migheli F, Migliore L. Epigenetics of colorectal cancer[J]. Clin Genet, 2012, 81(4): 312-318.
[13] Okuda T, Kondoh H. Identification of new genes ndr2 and ndr3 which are related to Ndr1/RTP/Drg1 but show distinct tissue specificity and response to N-myc[J]. Biochem Biophys Res Commun, 1999. 266(1): 208-215.
[14] Jin Q, Menter DG, Mao L, et al. Survivin expression in normal human bronchial epithelial cells an early and critical step in tumori genesis induced by tobacco exposure[J]. Carcinogenesis, 2008, 29(8): 1614-1622.
