肠杆菌科细菌的Rcs信号转导系统
——毒力、应激
2018-04-24叶立娜瞿涤
叶立娜,瞿涤
复旦大学基础医学院病原生物学系,医学分子病毒学教育部/卫生部重点实验室,上海 200032
双组分系统(two-component system,TCS)是细菌主要信号转导系统之一,通过磷酸转移而激活,从而调控细菌生长、生存、毒力等生物学功能。Rcs可调节荚膜异多糖酸合成,是一种复杂的TCS,1985年于大肠埃希菌中首次发现[1]。目前,仅在肠杆菌科细菌中发现该系统,其在调控细菌毒力和应激中发挥重要功能。典型的TCS由组氨酸激酶(histidine kinase,HK)和应答调控蛋白(response regulator,RR)组成,而Rcs系统则包含RcsC、RcsD、RcsB三个组分,其信号转导过程还依赖辅助蛋白如RcsF、IgaA、RcsA等。Rcs系统在磷酸转移、感应信号及功能发挥方面体现出多样性、复杂性,本文就此进行综述。
1 细菌TCS
细菌的TCS通常由两个蛋白构成:HK和RR。HK含感受域(sensor domain)和HK域(histidine kinase domain),RR含接收域(receiver domain)和效应域(effector domain)。HK域可自磷酸化,并将磷酸转移到接收域(图1A)。复杂的TCS(如Rcs)由3个蛋白构成:HK、RR和含组氨酸的磷酸转移结构域(histidine-containing phosphotransfer domain,HPt),HPt可接收HK的磷酸基团传递给RR,磷酸转移过程分3步(图1B)。除TCS外,细菌信号转导系统还有单组分系统(one-component system,OCS)。OCS由单个蛋白构成,仅含感受域和调节域(regulator domain)。肠杆菌科致病菌多为肠道致病菌,致病力涉及毒力、环境压力下存活能力等,均受TCS的调控(表1)。Rcs是肠杆菌科细菌特有的TCS,结构复杂,不同于典型的TCS,以下重点介绍。
表1调控肠杆菌科细菌毒力表达的双组分系统
Tab.1TheTCSsregulatingexpressionsofbacterialvirulenceinEnterobacteriaceae
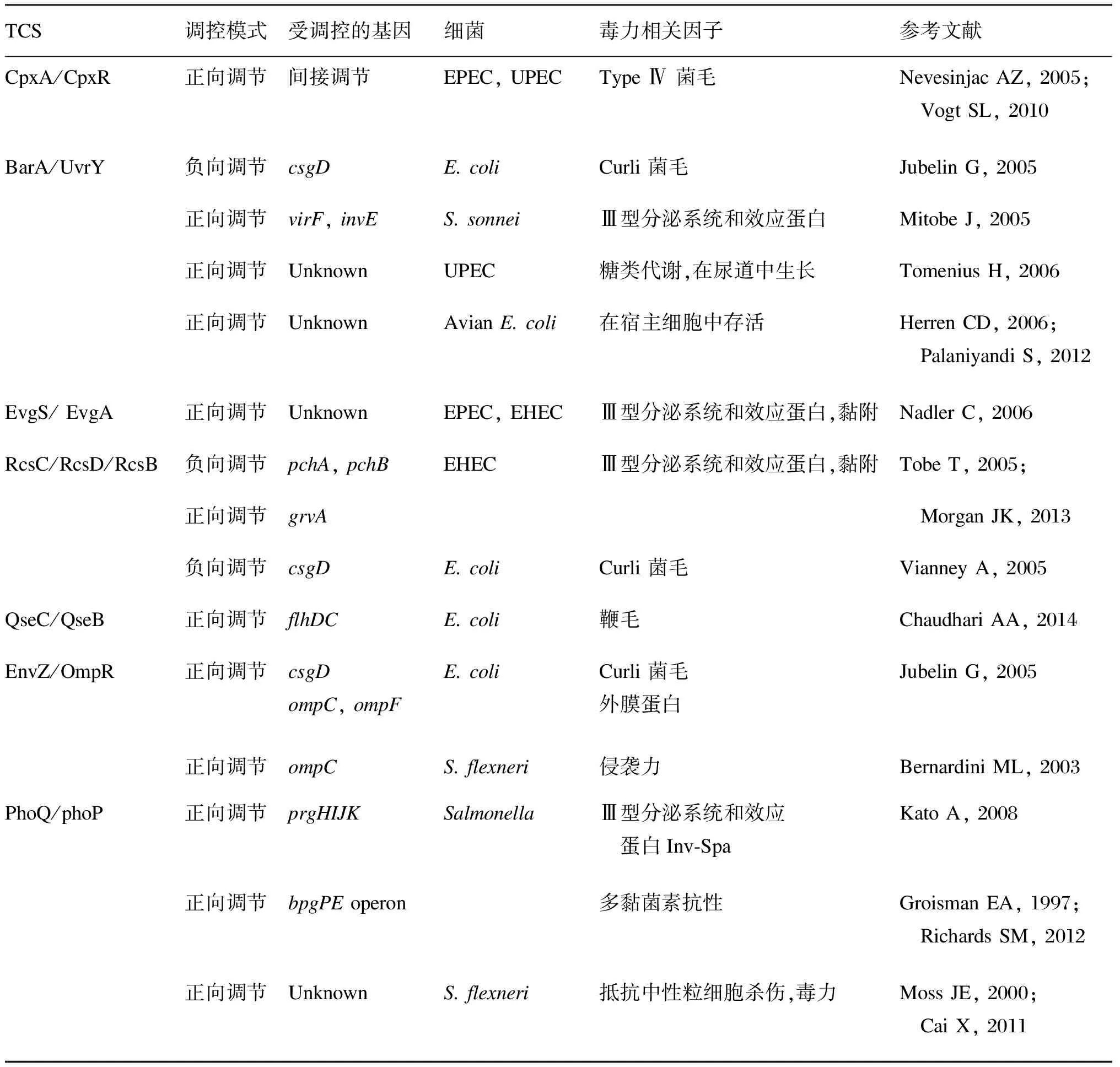
TCS调控模式受调控的基因细菌毒力相关因子参考文献CpxA/CpxR正向调节间接调节EPEC,UPECTypeⅣ菌毛NevesinjacAZ,2005; VogtSL,2010BarA/UvrY负向调节csgDE.coliCurli菌毛JubelinG,2005正向调节virF,invES.sonneiⅢ型分泌系统和效应蛋白MitobeJ,2005正向调节UnknownUPEC糖类代谢,在尿道中生长TomeniusH,2006正向调节UnknownAvianE.coli在宿主细胞中存活HerrenCD,2006; PalaniyandiS,2012EvgS/EvgA正向调节UnknownEPEC,EHECⅢ型分泌系统和效应蛋白,黏附NadlerC,2006RcsC/RcsD/RcsB负向调节pchA,pchBEHECⅢ型分泌系统和效应蛋白,黏附TobeT,2005;正向调节grvA MorganJK,2013负向调节csgDE.coliCurli菌毛VianneyA,2005QseC/QseB正向调节flhDCE.coli鞭毛ChaudhariAA,2014EnvZ/OmpR正向调节csgDompC,ompFE.coliCurli菌毛外膜蛋白JubelinG,2005正向调节ompCS.flexneri侵袭力BernardiniML,2003PhoQ/phoP正向调节prgHIJKSalmonellaⅢ型分泌系统和效应 蛋白Inv⁃SpaKatoA,2008正向调节bpgPEoperon多黏菌素抗性GroismanEA,1997; RichardsSM,2012正向调节UnknownS.flexneri抵抗中性粒细胞杀伤,毒力MossJE,2000; CaiX,2011
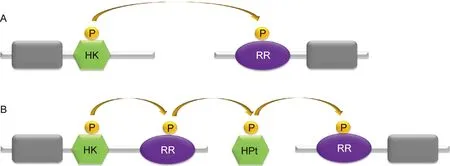
A: The one-step phosphoryl transfer of orthodox two-component systems.A single phosphoryl transfer occurs between a phospho-His of the HK and a phospho-Asp of the downstream RR.B: The three-step phosphorelay.The hybrid kinase contains a HK and a RR.The HPt domain exists in a protein separately.The phosphoryl is transferred via three steps as described in the picture.
图1双组分系统的磷酸转移步骤
Fig.1Thephosphoryltransferstepsoftwo-componentsystems
2 Rcs系统组成及磷酸转移机制
除大肠埃希菌,在其他肠杆菌科细菌(如志贺菌、伤寒沙门菌、鼠伤寒沙门菌、肺炎克雷伯菌、发光杆菌、奇异变形杆菌、耶尔森菌、欧文菌等)基因组中也发现了rcs同源基因。rcs基因主要包括rcsD(又称yojN)、rcsB、rcsC,在基因组中位置相邻,排序保守(图2A)。rcsD位于rcsB上游,与rcsB共转录;而rcsC位于rcsB下游,转录方向与rcsB相反[2]。
Rcs不同于典型的TCS,主要由3个蛋白构成:RcsC(HK)、RcsD(HPt)和RcsB(RR)。RcsC位于细菌细胞膜,含H1和D1两个功能域,分别带有His和Asp残基,参与磷酸转移过程。RcsB位于细胞质,含磷酸接收域D2,调节下游基因的表达[3]。RcsD位于细胞膜,含HPt,发挥磷酸的中间转移作用(图2B,图3)。
Rcs系统的激活与磷酸转移过程有关:RcsC感受上游信号后,H1功能域的His发生自磷酸化,并将磷酸基团转移至D1功能域的Asp,继而磷酸转移至RcsD-HPt的His,最终到达RcsB的D2功能域。磷酸化的RcsB可与下游基因启动子区域的DNA结合,调控靶基因的转录(图3)。近期研究发现,RcsB的激活还有其他两种磷酸转移通路:①RcsC感受到某种特殊的刺激时发生自磷酸化,与未磷酸化的RcsC单体结合,将磷酸基团转移至RcsB,调节特定的靶基因转录。②在不同环境中,另一种刺激信号可被RcsD识别,RcsD发生自磷酸化,与未磷酸化的RcsD单体结合,将磷酸基团转移至RcsB,调节相应的靶基因转录。不同的刺激可激活一种不同的通路,调节不同的基因表达,使细菌适应不同环境。然而,感受刺激信号的机制尚未见报道[4]。

A: The array of the mainrcsgenes in the genome ofShigellaflexneri2a str.301.The array of the genesrcsD/rcsB/rcsCwas drawn according to NCBI (https://www.ncbi.nlm.nih.gov/genome/).B: The domains of the main Rcs proteins inShigellaflexneri2a str.301.The information about the proteins RcsD/RcsB/RcsC was searched in the MiST2 database (http://mistdb.com/).
图2志贺菌中Rcs系统的主要组分
Fig.2ThemaincomponentsofRcssysteminShigella
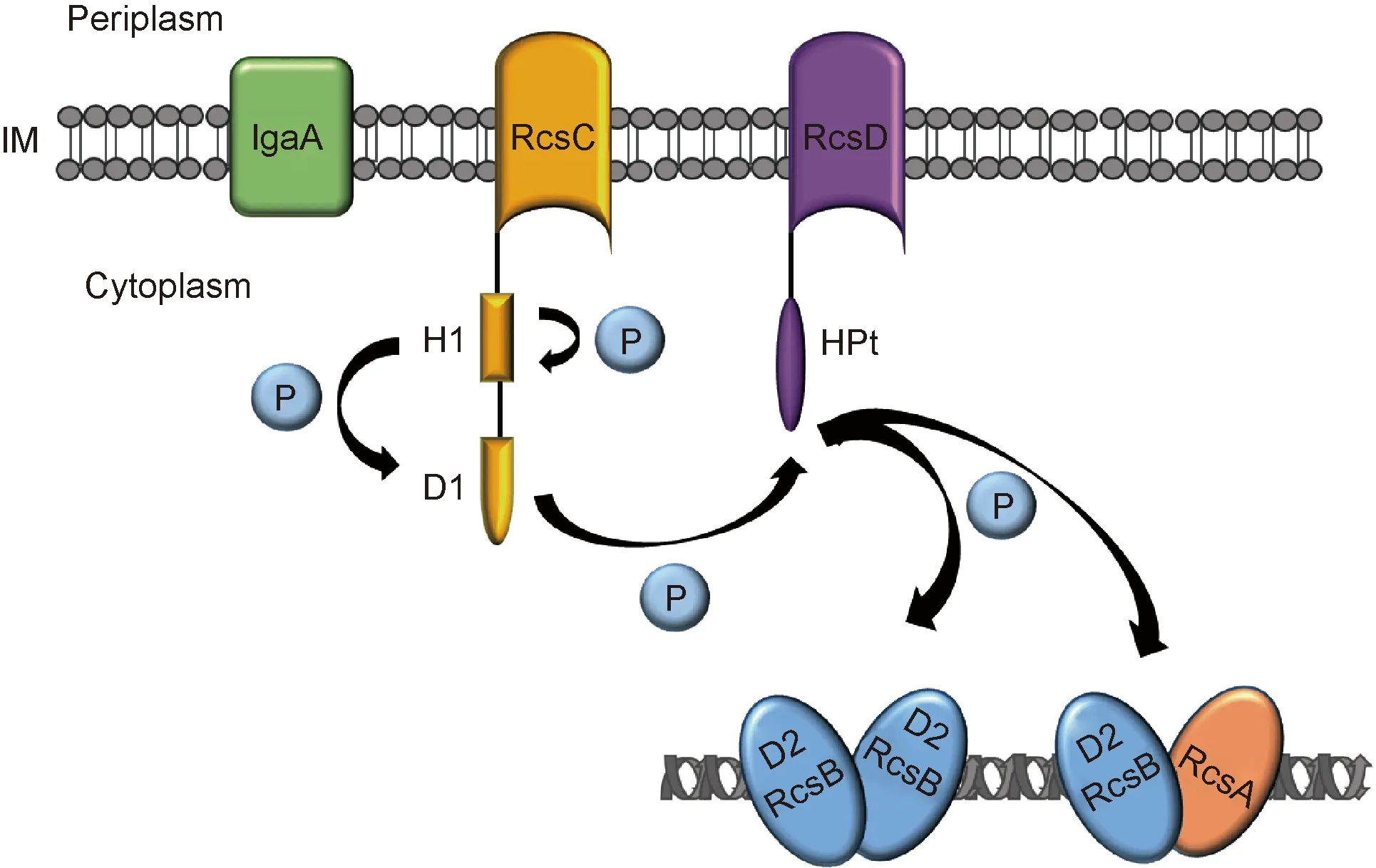
The histidine kinase RcsC and the histidine-containing phosphotransfer RcsD are both located in the inner membrane (IM),while the response regulator RcsB is located in cytoplasm.Upon activation,RcsC autophosphorylates on a histidine residue in the H1 domain and produces a phosphoryl group,which is transfered through several protein domains (D1,HPt) to a terminal D2 domain in RcsB.Phosphorylated RcsB regulates downstream gene expression by binding to the gene promoter region.In this regulation,RcsB can work independently or interact with RcsA.
图3Rcs系统的磷酸转移机制
Fig.3ThephosphoryltransfermechanismofRcssystem
除受磷酸化激活外,RcsB还受赖氨酸的乙酰化修饰。乙酰化可抑制RcsB与DNA结合,从而促进细菌的鞭毛合成与运动性,抑制细菌的抗酸性[5]。由于Rcs系统的持续激活会损伤细菌的毒力、运动性等,乙酰化对RcsB的负向调节在细菌生理功能的平衡中起至关重要的作用[6]。
在鼠伤寒沙门菌研究中发现,rcsB基因的表达受PrcsDB和PrcsB两个启动子的调控。正常情况下,两个启动子共同调控RcsB的表达,RcsB经各种磷酸转移途径激活,充分发挥其对下游基因的调控功能(如抑制鞭毛基因flhDC的表达、激活荚膜多糖合成基因cps的表达等)。RcsB表达过量时,RcsB与PrcsDB启动子结合,导致rcsD转录受抑制,而rcsB转录只受 PrcsB的调控。缺少RcsD时,低浓度RcsB只接受RcsC转移的磷酸基团而激活,仅能维持对细菌运动性(flhDC)的抑制[7]。
在Rcs系统激活过程中,除RcsC、RcsD和RcsB外,还有其他辅助蛋白(如RcsA、RcsF等)参与。位于胞质中的辅助调控蛋白RcsA可与磷酸化的RcsB构成异二聚体,结合至靶基因的上游启动子RcsAB box区域[8],激活cps的表达(图3)。RcsA不稳定,易被蛋白酶Lon和ClpYQ降解,细菌在30 ℃以上生长时其cps基因表达量降低[9]。细菌中新发现的第二信使c-di-GMP可大量诱导RcsA的表达(30.7倍),诱导的其他基因中35%以上编码细胞膜、生物膜相关蛋白,可能与RcsA的辅助调控有关[10]。
在特定条件下,RcsB可与其他TCS蛋白共同调控靶基因的表达。在鼠伤寒沙门菌tolB敲除株中,ugd(编码UDP-葡萄糖脱氢酶)的表达需RcsB与RcsA相互作用;在低镁和低铁条件下生长的pmrA敲除株中,ugd的表达则依赖RcsB 和PhoP的共同调控[11]。在伤寒沙门菌中,RcsB与TviA共同作用于roiA的启动子区域,促进Vi抗原合成[12]。在鼠伤寒沙门菌中,RcsB与PmrAB TCS相互作用,通过对wzz基因表达的正向调控促进O抗原合成,从而影响细菌对宿主免疫反应的耐受性[13]。
外膜脂蛋白RcsF是感受信号的重要辅助蛋白,所有外膜上的刺激信号均需通过RcsF感受。RcsF与LolA(chaperone)结合,可由细菌的细胞周质(periplasm)运输至外膜内侧,进而与BamA(β-barrel assembly machinery的主要组分)、OmpA(β-barrel蛋白)结合而移至外膜外侧。此时,RcsF远离内膜蛋白IgaA(又称YrfF),IgaA抑制RcsC的激酶活性,使Rcs系统处于抑制状态(图4A)。当RcsF接收到外膜或肽聚糖层的刺激信号时,RcsF无法与BamA、OmpA结合, 暴露于周质中的RcsF与位于内膜的IgaA结合,使IgaA释放RcsC,从而激活Rcs系统。此外,当LolA蛋白受损时,RcsF无法运输至外膜内侧,而在细胞周质中聚集,可与IgaA结合,从而激活Rcs系统(图4B)[14]。
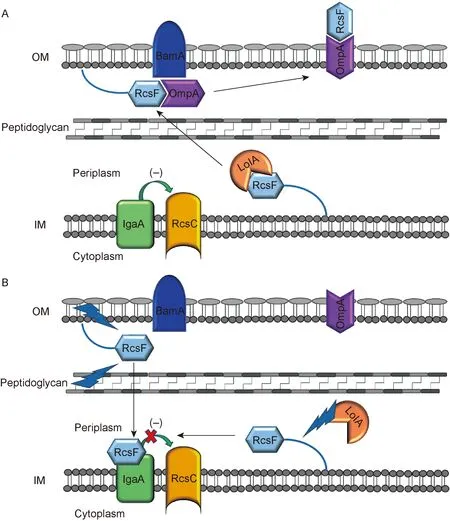
RcsF,as an outer membrane (OM) lipoprotein,is transported to the inner leaflet of the OM by the chaperone LolA.Under an unstressed condition (A),RcsF binds to BamA,which assembles RcsF and OmpA together as a complex.The complex displays RcsF on the cell surface,occluding RcsF from IgaA,an IM protein inhibiting the activation of RcsC.Upon a stress hitting the OM or peptidoglycan (B),the transported RcsF can not interact with BamA.Then the RcsF exposed to periplasm binds to IgaA and inhibits its function,resulting in an activation of Rcs system.In addition,when the LolA is destroyed,newly synthesized RcsF can also interact with IgaA due to a failure transportation to the OM.
图4Rcs系统的激活机制
Fig.4TheactivationmechanismofRcssystem
3 Rcs系统对细菌毒力及应激的调控
3.1 Rcs系统对细菌毒力的调控
Rcs系统对细菌毒力具有重要的调控功能,主要通过细菌表面结构(如鞭毛、菌毛、胞外多糖)的表达,影响其运动性、侵袭力、胞内存活能力、生物膜形成等[15]。不同细菌的Rcs系统通过不同机制发挥对毒力的调控功能,从而影响细菌的致病力。
肠出血性大肠埃希菌(enterohemorrhagicEscherichiacoli,EHEC)O157∶H7的最低感染剂量极低,1~10个细菌即可造成感染,引起出血性结肠炎。该细菌中,非激活状态下的Rcs系统通过抑制pch调控基因而负向调控LEE致病岛(LEE pathogenicity island)基因的表达;而激活状态的Rcs可通过调控正向调控基因grvA的表达而促进LEE基因的转录,导致EHEC毒力增强,如对上皮细胞的黏附性增强及Ⅲ型分泌系统的效应蛋白表达上调[16],导致细菌对宿主细胞的黏附力和侵袭力增强,促进其感染能力。
沙门菌是引起人类食物中毒的重要致病菌。伤寒沙门菌中,Rcs系统调控侵袭蛋白(Sip)、鞭毛蛋白和Vi抗原的表达,与细菌侵袭力、胞内存活和复制能力有关;鼠伤寒沙门菌中,Rcs系统正向调控荚膜异多糖酸合成基因的表达,负向调控鞭毛运动相关基因的表达,双向调控致病岛SPI-2上编码Ⅲ型分泌系统的基因表达[17],从而降低细菌对宿主细胞的侵袭力,增强细菌在宿主细胞内的复制能力。
耶尔森菌是烈性传染病鼠疫的病原菌,临床上常见的型别是小肠结肠炎耶尔森菌。耶尔森菌中,Rcs系统通过调控virG-lcrF操纵子的转录(编码LcrF)而正向调控Ysc-Yop Ⅲ型分泌系统,使细菌在宿主免疫细胞中分泌的Yop效应蛋白增加,从而增强细菌的存活能力[18],临床上可造成败血症等严重感染。
肺炎克雷伯菌是医院内感染的常见致病菌。此细菌中,Rcs系统调控荚膜多糖的合成,从而促进细菌的超黏性和生物膜形成[19],产生高毒性,引起败血症。梨火疫病菌可引起梨、苹果等植物疾病,Rcs系统可调控此菌中amylovoran(胞外多聚糖)的合成。Amylovoran不仅是梨火疫病菌的重要毒力因子,还促进其存活和生物膜形成,造成从北美向欧洲大陆的传播。
不同细菌的Rcs系统对同一生理过程的调控作用可能不同。例如,rcsD或其同源性基因的过表达可使大肠埃希菌和奇异变形杆菌的群体运动性表型过早表达[8],造成鼠伤寒沙门菌的群体运动性丢失[20]。
即使在同种细菌中,Rcs系统对同一生理过程的不同阶段也可能具有不同的调控作用。例如,在大肠埃希菌、鼠伤寒沙门菌、奇异变形杆菌中,Rcs均参与生物膜形成。在生物膜形成的起始黏附阶段,运动和黏附相关结构(如鞭毛、菌毛、Antigen 43)的基因表达受Rcs系统负调控;在生物膜成熟阶段,荚膜多糖酸合成基因的表达受Rcs系统正调控[21]。
沙门菌中,Rcs系统对细菌感染宿主的不同阶段也具有不同的调控作用。在侵袭阶段,Rcs系统负向调控侵袭蛋白Sip和鞭毛的合成,抑制细菌侵袭力;在胞内复制阶段,Rcs系统正向调控荚膜多糖Vi抗原的合成,促进细菌在宿主细胞内的存活和复制能力[22]。
虽然Rcs系统对细菌的部分生物学功能呈负向调控,但细菌可通过一定的机制抑制Rcs系统,从而适应环境。例如,在沙门菌侵袭阶段,细菌利用IgaA蛋白抑制Rcs系统。细菌进入宿主细胞后,Rcs系统接收胞内环境信号而激活,与其他TCS(如PhoPQ )相互作用而激活SPI-2毒力通路,有利于细菌的胞内复制和系统感染。
3.2 Rcs系统对细菌应激的调控
近年来,由于广谱抗生素的广泛使用,某些肠杆菌科细菌(如肺炎克雷伯菌等)临床株的耐药性不断增加,对常用药物呈现出严重的多重耐药趋势,成为临床抗菌治疗的难题。肠杆菌科细菌中,亦有某些细菌的感染能力极强,如EHEC、志贺菌等,约10个细菌即可造成感染,是我国肠道传染病传播的常见病原体。肠道致病菌引发的感染需经历胃肠道的复杂环境,细菌在这些环境中的存活能力对成功感染至关重要。
Rcs是肠杆菌科细菌的重要应激因子之一,主要与维持胞膜的完整性有关。Rcs系统感应的信号包括环境压力改变(如酸、渗透压、多黏菌素B、锌离子等)以及某些基因(如tolB、pmrA)敲除突变[23]。当感受到上述信号造成外膜和细胞壁损伤时,Rcs系统激活,调控与细菌抗性、荚膜多糖合成、二价阳离子转运及细胞周质质量控制相关的基因表达[24]。
大肠埃希菌中,DNA芯片技术结合转录组学分析显示,RcsC调控150多个基因的表达,其中50%编码的蛋白位于细菌胞膜上,或具有影响细胞表面结构、性质的活性[25]。Rcs系统激活细胞分化、细胞壁合成相关基因的表达,双向调控抗酸性基因gadA/BC的表达[26],以帮助细菌适应高渗透压、胃酸等环境。
伤寒沙门菌中,Rcs系统调控ugd、ydel(编码调控蛋白)的表达,增强细菌对多黏菌素、抗菌肽的抗性而促进其持续性感染。肺炎克雷伯菌中,Rcs系统与PhoPQ、PmrAB相互作用,共同介导细菌对抗菌肽的交叉耐药[27]。
奇异变形杆菌中,Rcs系统调控游动细胞分化,激活minCDE(编码细胞分化相关因子)[28],抑制与鞭毛合成相关的flhDC操纵子[29]。细菌通过细胞分化、变形和游动,适应固体表面和液体间的环境变化(表2)。
表2肠杆菌科细菌中受Rcs调控的基因
Tab.2ThegenesregulatedbyRcsinEnterobacteriaceae
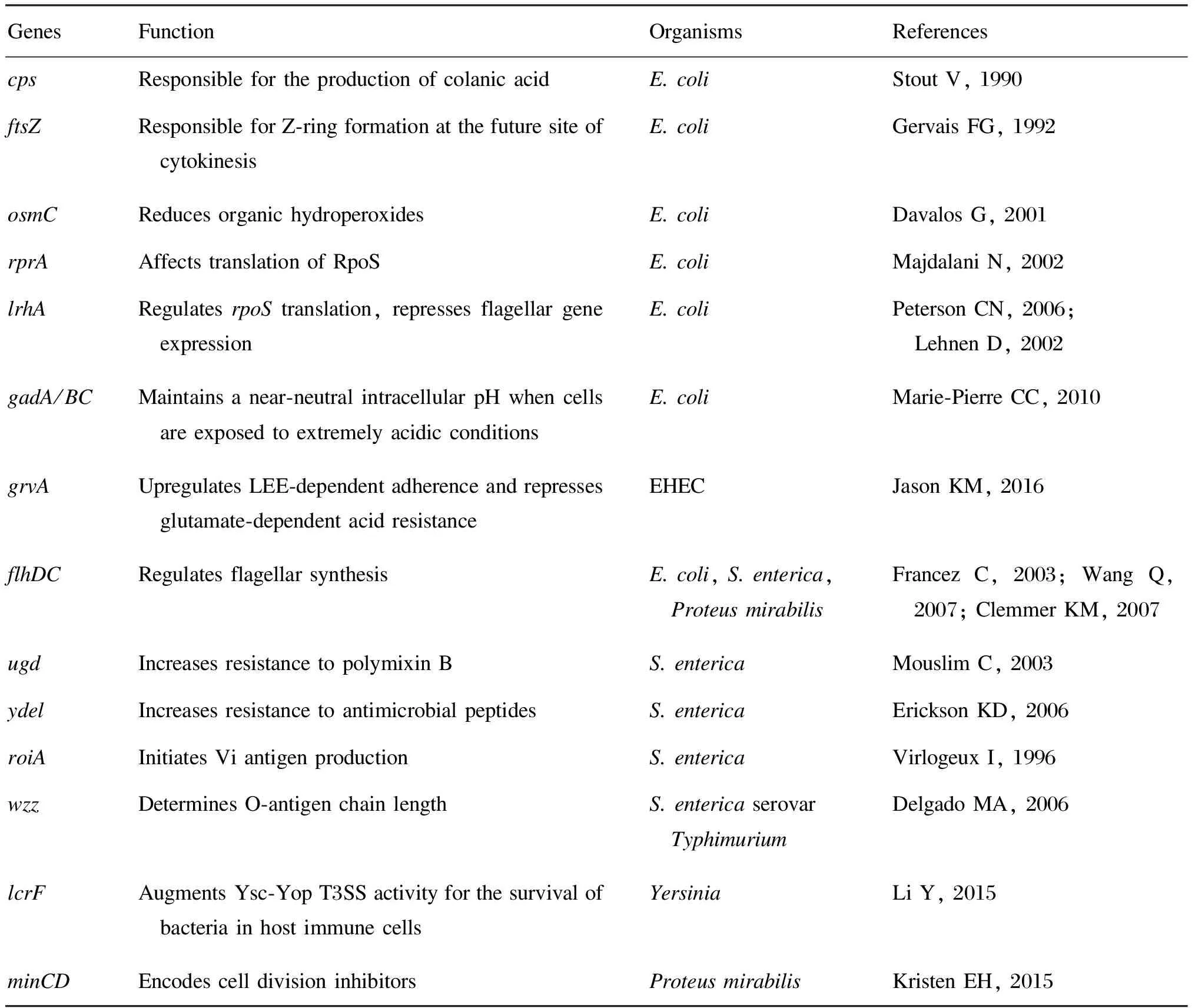
GenesFunctionOrganismsReferencescpsResponsiblefortheproductionofcolanicacidE.coliStoutV,1990ftsZResponsibleforZ⁃ringformationatthefuturesiteofcytokinesisE.coliGervaisFG,1992osmCReducesorganichydroperoxidesE.coliDavalosG,2001rprAAffectstranslationofRpoSE.coliMajdalaniN,2002lrhARegulatesrpoStranslation,repressesflagellargeneexpressionE.coliPetersonCN,2006; LehnenD,2002gadA/BCMaintainsanear⁃neutralintracellularpHwhencellsareexposedtoextremelyacidicconditionsE.coliMarie⁃PierreCC,2010grvAUpregulatesLEE⁃dependentadherenceandrepressesglutamate⁃dependentacidresistanceEHECJasonKM,2016flhDCRegulatesflagellarsynthesisE.coli,S.enterica, ProteusmirabilisFrancezC,2003;WangQ,2007;ClemmerKM,2007ugdIncreasesresistancetopolymixinBS.entericaMouslimC,2003ydelIncreasesresistancetoantimicrobialpeptidesS.entericaEricksonKD,2006roiAInitiatesViantigenproductionS.entericaVirlogeuxI,1996wzzDeterminesO⁃antigenchainlengthS.entericaserovar TyphimuriumDelgadoMA,2006lcrFAugmentsYsc⁃YopT3SSactivityforthesurvivalofbacteriainhostimmunecellsYersiniaLiY,2015minCDEncodescelldivisioninhibitorsProteusmirabilisKristenEH,2015
4 结语
肠道致病菌必须适应胃肠道微环境才能在肠黏膜上定植,致病力与其毒力、运动力、黏附力、定植力及在环境压力下(如酸、渗透压、抗菌肽)的存活能力等密切相关。肠杆菌科特有的Rcs系统可调控细菌荚膜多糖合成、生物膜形成、抗性基因表达等而抵抗宿主胃肠道的环境压力,也可调控细菌毒力。其结构高度保守,有望成为抗菌治疗的药物靶标。
通过转录组学技术和生物信息学分析可以了解到,Rcs调控的基因及相应功能多涉及对抗环境刺激所致的细胞表面结构修饰,但很多受调控的基因并不稳定(因细菌生长时间不同而不一致)或经由其他系统间接调控,因此还需通过体内外实验来验证。鉴于Rcs系统的复杂性,未来有望结合结构学、遗传学、生物化学等多学科的研究方法,将细琐、片面的研究成果综合起来,从而更有力地阐明Rcs系统发挥调控功能的作用机制。
[1] Ancona V,Chatnaparat T,Zhao Y.Conserved aspartate and lysine residues of RcsB are required for amylovoran biosynthesis,virulence,and DNA binding in Erwinia amylovora [J].Mol Genet Genomics,2015,290(4): 1265-1276.
[2] Arricau N,Hermant D,Waxin H,Ecobichon C,Duffey PS,Popoff MY.The RcsB-RcsC regulatory system of Salmonella typhi differentially modulates the expression of invasion proteins,flagellin and Vi antigen in response to osmolarity [J].Mol Microbiol,1998,29(3): 835-850.
[3] Castanie-Cornet MP,Cam K,Bastiat B,Cros A,Bordes P,Gutierrez C.Acid stress response in Escherichia coli: mechanism of regulation of gadA transcription by RcsB and GadE [J].Nucleic Acids Res,2010,38(11): 3546-3554.
[5] Cho SH,Szewczyk J,Pesavento C,Zietek M,Banzhaf M,Roszczenko P,Asmar A,Laloux G,Hov AK,Leverrier P,van der Henst C,Vertommen D,Typas A,Collet JF.Detecting envelope stress by monitoring beta-barrel assembly [J].Cell,2014,159(7): 1652-1664.
[6] Clarke DJ.The Rcs phosphorelay: more than just a two-component pathway [J].Future Microbiol,2010,5(8): 1173-1184.
[7] Clemmer KM,Rather PN.Regulation of flhDC expression in Proteus mirabilis [J].Res Microbiol,2007,158(3): 295-302.
[8] Delgado MA,Mouslim C,Groisman EA.The PmrA/PmrB and RcsC/YojN/RcsB systems control expression of the Salmonella O-antigen chain length determinant [J].Mol Microbiol,2006,60(1): 39-50.
[9] Ferrières L,Clarke DJ.The RcsC sensor kinase is required for normal biofilm formation in Escherichia coli K-12 and controls the expression of a regulon in response to growth on a solid surface [J].Mol Microbiol,2003,50(5): 1665-1682.
[10] Francez-Charlot A,Laugel B,van Gemert A,Dubarry N,Wiorowski F,Castanié-Cornet MP,Gutierrez C,Cam K.RcsCDB His-Asp phosphorelay system negatively regulates the flhDC operon in Escherichia coli [J].Mol Microbiol,2003,49(3): 823-832.
[11] Gottesman S,Trisler P,Torres-Cabassa A.Regulation of capsular polysaccharide synthesis in Escherichia coli K-12: characterization of three regulatory genes [J].J Bacteriol,1985,162(3): 1111-1119.
[12] Howery KE,Clemmer KM,Simsek E,Kim M,Rather PN.Regulation of the Min cell division inhibition complex by the Rcs phosphorelay in Proteus mirabilis [J].J Bacteriol,2015,197(15): 2499-2507.
[13] Huang YH,Ferrières L,Clarke DJ.The role of the Rcs phosphorelay in Enterobacteriaceae [J].Res Microbiol,2006,157(3): 206-212.
[14] Llobet E,Campos MA,Giménez P,Moranta D,Bengoechea JA.Analysis of the networks controlling the antimicrobial-peptide-dependent induction of Klebsiella pneumoniae virulence factors [J].Infect Immun,2011,79(9): 3718-3732.
[15] Majdalani N,Gottesman S.The Rcs phosphorelay: a complex signal transduction system [J].Annu Rev Microbiol,2005,59: 379-405.
[16] Majdalani N,Heck M,Stout V,Gottesman S.Role of RcsF in signaling to the Rcs phosphorelay pathway in Escherichia coli [J].J Bacteriol,2005,187(19): 6770-6778.
[17] Méndez-Ortiz MM,Hyodo M,Hayakawa Y,Membrillo-Hernández J.Genome-wide transcriptional profile of Escherichia coli in response to high levels of the second messenger 3′,5′-cyclic diguanylic acid [J].J Biol Chem,2006,281(12): 8090-8099.
[18] Mouslim C,Groisman EA.Control of the Salmonella ugd gene by three two-component regulatory systems [J].Mol Microbiol,2003,47(2): 335-344.
[19] Pescaretti Mde L,Farizano JV,Morero R,Delgado MA.A novel insight on signal transduction mechanism of RcsCDB system in Salmonella enterica serovar typhimurium [J].PLoS One,2013,8(9): e72527.
[20] Pescaretti Mde L,López FE,Morero RD,Delgado MA.Transcriptional autoregulation of the RcsCDB phosphorelay system in Salmonella enterica serovar typhimurium [J].Microbiology,2010,156(Pt 12): 3513-3521.
[21] Stout V,Gottesman S.RcsB and RcsC: a two-component regulator of capsule synthesis in Escherichia coli [J].J Bacteriol,1990,172(2): 659-669.
[22] Stout V,Torres-Cabassa A,Maurizi MR,Gutnick D,Gottesman S.RcsA,an unstable positive regulator of capsular polysaccharide synthesis [J].J Bacteriol,1991,173(5): 1738-1747.
[23] Tobe T,Ando H,Ishikawa H,Abe H,Tashiro K,Hayashi T,Kuhara S,Sugimoto N.Dual regulatory pathways integrating the RcsC-RcsD-RcsB signalling system control enterohaemorrhagic Escherichia coli pathogenicity [J].Mol Microbiol,2005,58(1): 320-333.
[24] Toguchi A,Siano M,Burkart M,Harshey RM.Genetics of swarming motility in Salmonella enterica serovar typhimurium: critical role for lipopolysaccharide [J].J Bacteriol,2000,182(22): 6308-6321.
[25] Venecia K,Young GM.Environmental regulation and virulence attributes of the Ysa type III secretion system of Yersinia enterocolitica biovar 1B [J].Infect Immun,2005,73(9): 5961-5977.
[26] Vianney A,Jubelin G,Renault S,Dorel C,Lejeune P,Lazzaroni JC.Escherichia coli tol and rcs genes participate in the complex network affecting curli synthesis [J].Microbiology,2005,151(Pt 7): 2487-2497.
[27] Virlogeux I,Waxin H,Ecobichon C,Lee JO,Popoff MY.Characterization of the rcsA and rcsB genes from Salmonella typhi:rcsB through tviA is involved in regulation of Vi antigen synthesis [J].J Bacteriol,1996,178(6): 1691-1698.
[28] Wang Q,Zhao Y,Mcclelland M,Harshey RM.The RcsCDB signaling system and swarming motility in Salmonella enterica serovar typhimurium: dual regulation of flagellar and SPI-2 virulence genes [J].J Bacteriol,2007,189(23): 8447-8457.
[29] 周锡鹏,薛健,杨弦弦,罗美,徐萱,卿颖,李迎丽,邱景富.肺炎克雷伯菌突变株ΔrcsB的构建及其菌株超粘性与生物膜表型 [J].第三军医大学学报,2016,38(6): 595-599.
