结核分枝杆菌espK基因G-四链体核酸序列多态性与表达调控功能研究
2018-04-24韩昂轩牛辰吕亮东
韩昂轩,牛辰,吕亮东
复旦大学基础医学院医学分子病毒学教育部/卫生部重点实验室,上海 200032
G-四链体(G-quadruplex,G4)是由富含鸟嘌呤(guanine,G)的核酸序列经折叠堆积所形成的四链体螺旋结构。如图1所示,G-四分体(G-tetrad)作为G-四链体的结构单元,是由Hoogsteen氢键连接其中的4个G形成的环状平面,两层或以上的G-四分体通过π-π碱基堆积作用力形成G-四链体[1]。能够形成G4的DNA序列一般具有以下特征:G3-5NxG3-5NxG3-5NxG3-5,其中G3-5代表3~5个G的串联重复序列(形成G-tract),Nx代表由1~7个任一碱基组成的间隔序列(形成loop区域)。G4结构可通过圆二色谱等技术进行体外检测[2]。Lam等利用G4 DNA抗体hf2在癌细胞中分离并检测到G4[3],证明G4在人基因组中稳定存在。近期研究发现,G4广泛分布于端粒、启动子区域等具有重要功能的基因组区域,在外显子、内含子、3’非编码区也有G4存在。研究提示,G4结构具有重要的生物学功能,如调控基因表达、影响基因组稳定性、维持端粒长度等[4]。
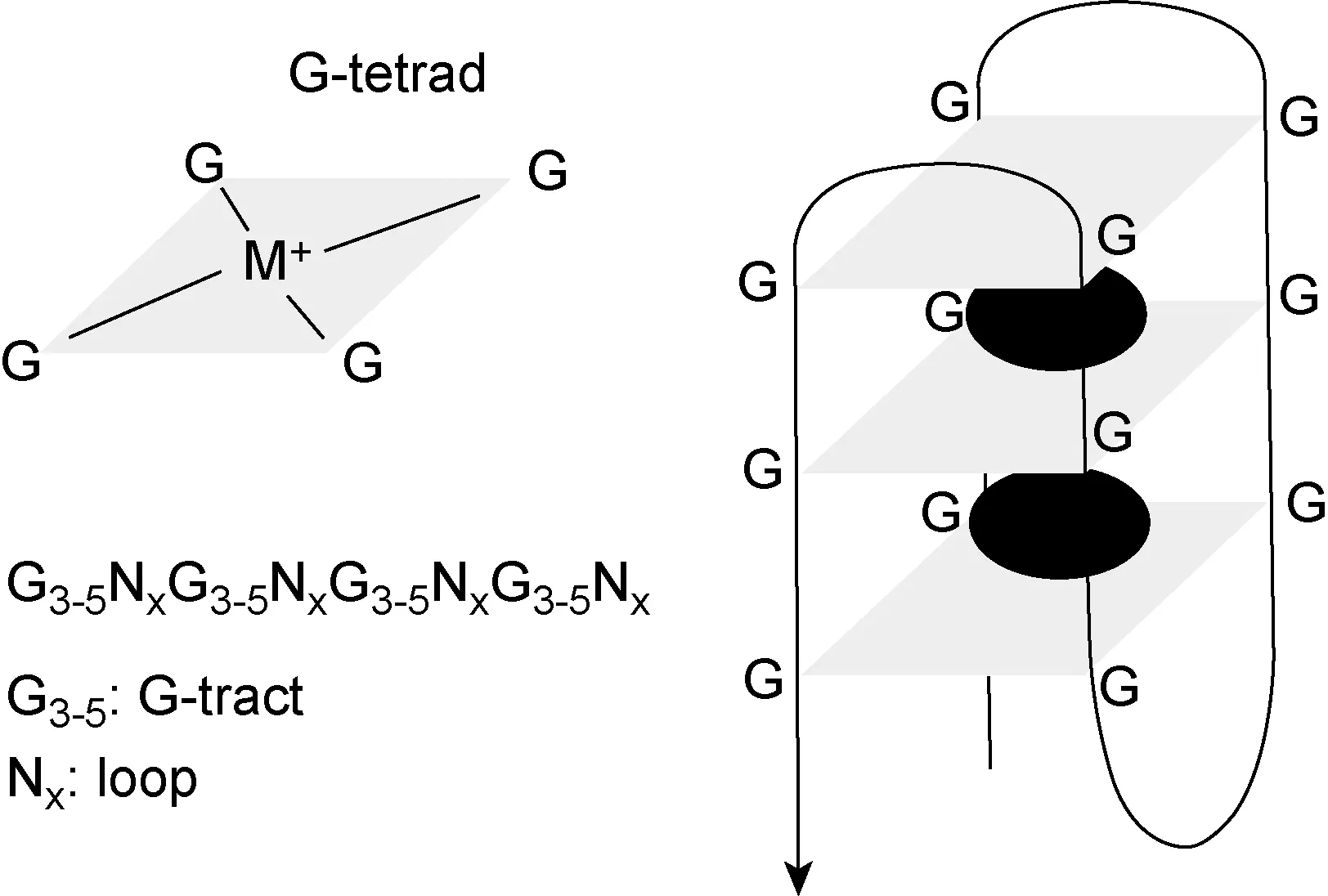
G-quadruplex structures are based on the stacking of several G-tetrads,which consist each of four guanine bases held together by Hoogsteen-hydrogen bonding,stabilized in the presence of cations (M+) in the central channel of the G4.The sequence motif is G3-5NxG3-5NxG3-5NxG3-5.A G4 motif consists of four runs of at least three guanines (G-tract) per run and separated by other 1-7 bases (Nx).
图1G-四链体示意图
Fig.1SchematicofaG-quadruplex
牛分枝杆菌(Mycobacteriumbovis,M.bovis)与卡介苗(bacillus Calmette-Guérin,BCG)菌株基因组序列的最大不同是后者出现大的基因组片段丢失,其中RD1区域(包含ESX-1分泌系统的编码基因Rv3871~Rv3879c)缺失是导致BCG毒力丢失的主要原因之一[5]。espK基因是RD1区域的9个基因之一,编码的EspK蛋白全长729个氨基酸,富含丙氨酸和脯氨酸,是ESX-1分泌系统组分之一。研究表明,EspK与EspB的分泌有关,是构成结核分枝杆菌Ⅶ型分泌系统的重要蛋白元件。Inwald等比较牛分枝杆菌与结核分枝杆菌H37Rv的EspK同源蛋白序列时,发现GTPITP氨基酸序列的串联重复多态性[6]。本研究结果显示,EspK中GTPITP氨基酸重复序列由CCCC串联重复的间隔核酸序列编码,其模板链上存在G4特征的核酸序列;该G4序列仅存在于结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex,MTBC);结核分枝杆菌临床分离株中espK的G4序列存在高频率的点突变;圆二色谱检测证明该片段核酸能在体外形成G4结构;进一步研究发现,该G4多态性与结核分枝杆菌espK基因表达调控有关。
1 材料与方法
1.1 菌株和质粒
结核分枝杆菌、耻垢分枝杆菌、质粒pMV306和质粒pMV361为本实验室储存。
1.2 主要试剂和仪器
Middlebrook 7H9、7H11培养基购自美国BD公司,FLAG-tag Mouse mAb、Hsp65 Mouse mAb、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG购自Sigma公司,胶回收试剂盒、聚合酶链反应(polymerase chain reaction,PCR)产物回收试剂盒、质粒抽提试剂盒、RNA纯化试剂盒购自Thermo Scientific公司,Maxima H Minus First Strand cDNA合成试剂盒购自Invitrogen公司,TRIzol、SYBR®Premix Ex Taq GC购自TaKaRa公司。
1.3 细菌培养
大肠埃希菌采用LB培养基,37 ℃培养。耻垢分枝杆菌采用Middlebrook 7H9液体培养基和Middlebrook 7H11固体培养基,37 ℃培养。卡那霉素含量为20 μg/mL。
1.4 G4核酸序列
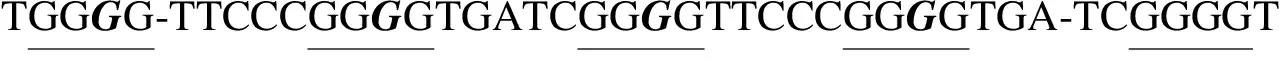
1.5 圆二色谱法检测G4
将espKWTG4、espKMutG4和espKG1573C mutG4核酸片段用Buffer K+(1 mmol/L K3PO4,0.3 mmol/L EDTA,100 mmol/L KCl,pH 7.0)溶解至终浓度为50 μmol/L。然后在PCR仪上进行循环降温(90 ℃ 10 min预热后,每分钟下降0.5 ℃直至4 ℃),置于冰上。利用Jasco-810分光偏振器测定寡核苷酸样品的圆二色谱。使用1 cm宽的石英微量比色皿,扫描范围200~320 nm,扫描速率为100 nm/min。其他参数为:1 nm倾斜度(pitch),1 nm 谱带宽度(band width)。先用Buffer K+调零后,然后检测待测核酸样品,同时测量样品熔解温度(melting temperature,Tm)。
1.6 含有G4突变体的espK表达菌株构建
1.7 RNA提取
取对数生长期(OD600≈0.8)的耻垢分枝杆菌菌液5 mL,3 220g室温离心5 min,收集菌体。用1 mL TRIzol悬浮菌体,吹打混匀,加入 0.5 mL 0.1 mm 陶瓷珠。于均质破菌仪,剧烈振荡30 s,冰上静置1 min,重复4次。加入 0.3 mL氯仿,剧烈混匀20 s,室温放置10 min。16 000g、4 ℃离心5 min。小心吸取上层水相,向水相加入 0.7 倍体积的异丙醇,颠倒混匀,-20 ℃静置30 min,16 000g、4 ℃离心20 min。将沉淀用70%乙醇洗1次,RNA沉淀在室温下自然干燥。加入85 μL DEPC-H2O,使总体积为100 μL,37 ℃用DNase Ⅰ消化处理DNA 30 min。通过RNA纯化试剂盒(Thermo Scientific公司)纯化后,用50 μL DEPC-H2O溶解RNA,紫外吸光法测定RNA浓度。分装后-80 ℃保存。
1.8 荧光定量PCR
反转录及PCR条件分别按Maxima H Minus First Strand cDNA合成试剂盒和SYBR®Premix Ex Taq GC说明书进行。以sigA为内参,按2-ΔΔCt方法计算RNA相对表达量[7]。引物序列如下。espK-G4-F:5′-ATATTGCCGGGTTGATTGAG-3′;espK-G4-R: 5′-TCGGAGGTTTCCAATTCTTG-3′;sigA-F:5′-GACGACGACATCGACGAG-3′;sigA-R:5′-CAGCTCCACCTCTTCTTCG-3′。
1.9 蛋白免疫印迹检测
在含有强启动子的整合型质粒pMV361基础上,构建结核分枝杆菌临床分离株G1573C突变的espK高表达质粒。质粒构建同方法 1.6,构建表达质粒pMV361_espKG1573C和pMV361_espK。转化后成功构建重组菌株mc2155∷pMV361_espKG1573C和野生型espK整合重组菌株mc2155∷pMV361_espK。取对数生长期(OD600≈1.0)的重组耻垢分枝杆菌菌液50 mL,3 220g室温离心5 min,收集菌体。用10 mL磷酸盐缓冲液(phosphate buffered saline,PBS)重悬,3 220g离心5 min,加入500 μL PBS悬浮菌体,吹打混匀,加入 0.25 mL 0.1 mm 陶瓷珠。于均质破菌仪,剧烈振荡30 s,冰上静置1 min,连续破菌3次。4 ℃、16 000g离心10 min,上清液即为可溶性蛋白组分。经Bradford法测定蛋白浓度,取20 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE;5%浓缩胶,10%分离胶)。20 V电转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜1 h。用含5%脱脂牛奶的含吐温20的Tris-HCl缓冲液(Tris-buffered saline with Tween 20,TBST)封闭过夜,加入FLAG-tag(1∶1 000)和Hsp65(1∶5 000)鼠源一抗,室温孵育2 h。TBST洗5次,每次5 min。加入HRP标记的山羊抗小鼠IgG(1∶10 000)二抗,室温孵育1 h。再用TBST洗2次,每次5 min。避光显色,暗室曝光5 min。Hsp65是分枝杆菌蛋白免疫印迹法广泛采用的内参蛋白[8]。利用Image J软件对蛋白免疫印迹检测结果进行定量分析。
1.10 统计学分析
实验至少重复3次,进行t检验,P<0.05 为差异有统计学意义。采用Graphpad Prism 6.0 软件进行统计并作图。
2 结果
2.1 espK中的G4核酸序列多态性

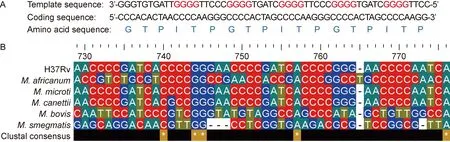
A: The sequence diagram shows the template sequence,coding sequence and amino acid sequence (GTPITP tandem repeats in H37Rv EspK).The red GGGGs represent G-tracts of G4 sequence in template sequence ofespK.B: Nucleotide sequence alignment of theespKfromM.tuberculosisH37Rv,M.africanum,M.microti,M.canettii,M.bovisandM.smegmatis.
图2espK中G4核酸序列及分枝杆菌属G4核酸序列比对分析
Fig.2ComparisonanalysesofnucleicacidsequenceofG4motifinespK
2.2 espK的G4核酸片段可在体外形成G4结构
圆二色谱是经典的蛋白质二级结构检测方法,而DNA分子形成二级结构后由于其骨架结构中糖分子和螺旋结构产生的不对称性,可依据不同波长的平面偏振光吸收系数之差所得图谱来推测其构象。典型的呈顺式平行分子构象的G4核酸,其圆二色谱图可在波长240 nm处形成波谷,波长260 nm处形成波峰[3]。espK的G4核酸片段espKWTG4在Buffer K+中循环降温后,测定其在 200~320 nm波长下(扫描速率为100 nm/min,分辨率0.1 nm,温度25 ℃)的圆二色谱峰图和Tm。如图3所示,espKWTG4在波长240 nm处形成波谷,波长260 nm处形成波峰,具有典型的顺式平行G4结构的特征谱,该G4结构的Tm值为 90.3 ℃。espKMutG4核酸片段在Buffer K+中循环降温,测得其在波长260 nm处的峰值对比野生型有所下降,其Tm下降为79.9 ℃。以上结果证明,espK的G4核酸序列可在体外形成G4结构;且从Tm来看,野生型G4的结构更加稳定。研究表明,G4结构的稳定性是其参与基因表达调控的关键因素[9]。
2.3 G4结构对espK转录的影响
为研究espKG4序列的转录调控功能,通过重叠PCR在espK基因的G4序列区域引入同义突变(见方法1.6),获得携带espKMutG4的espK基因片段。分别构建携带原始启动子的野生型espK(pMV306_espK)和G4同义突变的espK表达质粒(pMV306_espKG4 mut)(图4A)。电击转化耻垢分枝杆菌mc2155感受态细胞。PCR验证结果显示,成功获得espK重组表达菌株mc2155∷pMV306_espK和mc2155∷pMV306_espKG4 mut(图4B)。提取对数生长期(OD600≈0.8)的重组耻垢分枝杆菌RNA,通过实时定量PCR测定野生型和同义点突变G4的espK基因片段转录水平。如图5A所示,突变espKG4后,其基因转录水平相比野生型升高 1.5 倍(P<0.05)。
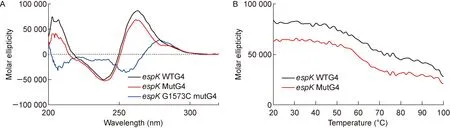
A: The CD spectra of wild-type G4 (espKWTG4),synonymous point mutant G4 (espKMutG4) and G1573C mutant (espKG1573C mutG4) inespK.B: The melting temperature (Tm) ofespKWTG4 andespKMutG4 oligonucleotides (50 μmol/L) in Buffer K+.
图3espKG4核酸片段的圆二色谱和熔解曲线
Fig.3TheCDspectraandmeltingcurvesofespKG4
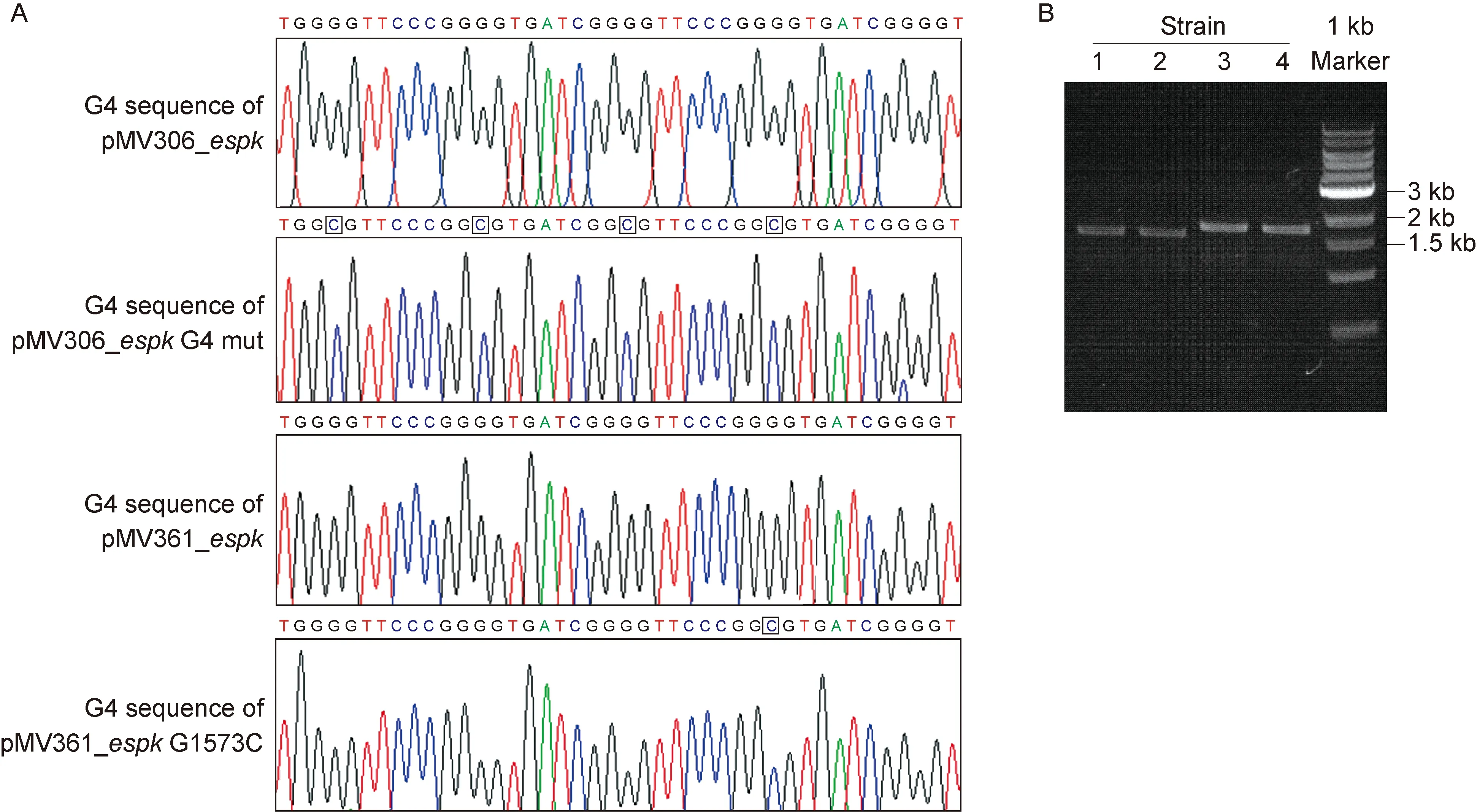
A: Sequencing results of theespKG4 region in recombinant plasmids,C bases in black boxes representing mutant bases.B: The recombinant mc2155∷pMV306_espK(strain 1),mc2155∷pMV306_espKG4 mut (strain 2),mc2155∷pMV361_espK(strain 3),mc2155∷pMV361_espKG1573C (strain 4) were successfully verified by genotyping PCR (the molecular weight of PCR products of strains 1 and 2 is 1.7 kb,and of strains 3 and 4 is 1.9 kb).
图4espK重组质粒测序结果和重组菌株的PCR鉴定结果
Fig.4GenesequencingofespKrecombinantplasmidsandPCRidentificationofrecombinantstrains
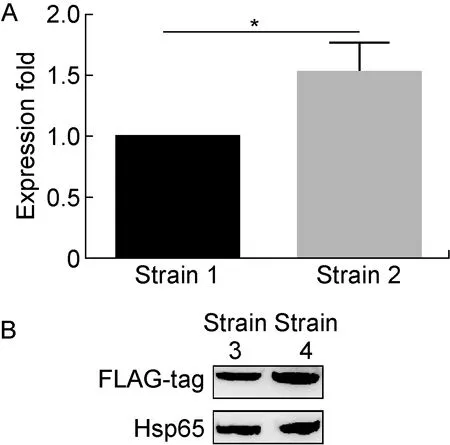
A: qRT-PCR analyses of theespKtranscription in recombinant mc2155∷pMV306_espK(strain 1) and mc2155∷pMV306_espKG4 mut (strain 2).*P<0.05.B: The Western blotting results of EspK from the recombinant mc2155∷pMV361_espK(strain 3) and mc2155∷pMV361_espKG1573C (strain 4).
图5espK重组菌株的转录水平和蛋白免疫印迹检测结果
Fig.5AnalysesofespKexpressionbyqRT-PCRandWesternblotting
2.4 结核分枝杆菌临床分离株espK G4突变对EspK蛋白表达的影响
合成含有结核分枝杆菌临床分离株中发生G1573C突变的G4核酸片段。如图3A所示,圆二色谱分析发现该片段(espKG1573C mutG4)不能形成G4结构特征谱[9],表明G1573C突变破坏了该G4结构。为进一步分析该突变是否对EspK蛋白表达产生影响,构建表达质粒pMV361_espKG1573C和pMV361_espK(图4A),并获得重组菌株mc2155∷pMV361_espKG1573C和野生型espK整合重组菌株mc2155∷pMV361_espK(图4B)。提取对数生长期(OD600≈1.0)的重组菌株可溶性蛋白组分,蛋白免疫印迹法分析EspK融合蛋白的表达水平。以Hsp65为内参蛋白,利用Image J进行图像分析。结果显示,该G>C突变导致EspK蛋白的表达水平较野生型升高 1.3 倍(图5B)。
3 讨论
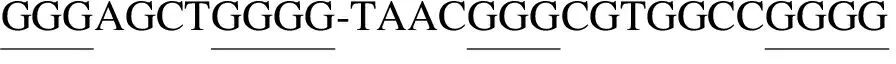
近年来,在酵母[11]、淋病奈瑟球菌[12-13]、Epstein-Barr病毒(Epstein-Barr virus,EBV)[14]、人类免疫缺陷病毒(human immunodeficiency virus,HIV)[15]等病原微生物中发现G4可参与致病[16]。如在淋病奈瑟球菌中,16 bp长的G4核酸序列(GGGTGGGTTGGGTGGG)与菌毛抗原变异有关。其分子机制是该G4核酸序列通过形成G4结构来募集RecA等解旋酶,从而导致该区域发生高频率的同源重组,引起菌毛抗原基因pilS和pilE的转换,使细菌得以逃脱宿主的免疫识别。Siddiqui-Jain等[17]研究发现,G4在启动子等功能区域大量富集,提示其在转录调控中可能发挥重要功能。本研究通过点突变破坏espK基因G4的稳定性后,其转录水平显著提高,表明G4可参与espK的转录调控。结核分枝杆菌临床分离株中espK基因存在的G1573C突变破坏了G4结构,导致其蛋白表达水平较野生型有一定升高。
结核分枝杆菌内表达的蛋白必须在分泌系统的协助下才能分泌至细胞外,ESX-1分泌系统是其中最重要的外排分泌系统。RD1区(Rv3871~Rv3879c)的9个基因编码的蛋白均与外排分泌系统相关。McLaughlin等[18]发现,EspB(Rv3881c)的分泌需RD1区的基因espK(Rv3879c)和eccCb(Rv3871)同时存在方可实现。结核分枝杆菌临床分离株中espK基因的G4因G1573C突变导致其蛋白表达水平明显升高,提示该突变可能影响ESX-1系统的分泌活性,从而影响结核分枝杆菌的毒力。
综上所述,本研究结果提示espK基因G4结构会抑制基因表达,结核分枝杆菌临床分离株中espK基因G4序列常见的单核苷酸多态性(single nucleotide polymorphism,SNP)会破坏该G4结构形成,从而改变EspK蛋白表达。推测该G4参与转录调控的机制可能与转录模板链的G4结构延缓RNA聚合酶前进速度有关,具体机制有待进一步研究。
[1] Lipps HJ,Rhodes D.G-quadruplex structures: in vivo evidence and function [J].Trends Cell Biol,2009,19(8): 414-422.
[2] Kypr J,Kejnovská I,Renciuk D,Vorlícková M.Circular dichroism and conformational polymorphism of DNA [J].Nucleic Acids Res,2009,37(6): 1713-1725.
[3] Lam EY,Beraldi D,Tannahill D,Balasubramanian S.G-quadruplex structures are stable and detectable in human genomic DNA [J].Nat Commun,2013,4: 1796.doi: 10.1038/ncomms2792.
[4] Maizels N,Gray LT.The G4 genome [J].PLoS Genet,2013,9(4): e1003468.
[5] Behr MA,Wilson MA,Gill WP,Salamon H,Schoolnik GK,Rane S,Small PM.Comparative genomics of BCG vaccines by whole-genome DNA microarray [J].Science,1999,284(5419): 1520-1523.
[6] Inwald J,Jahans K,Hewinson RG,Gordon SV.Inactivation of the Mycobacterium bovis homologue of the polymorphic RD1 gene Rv3879c (Mb3909c) does not affect virulence [J].Tuberculosis (Edinb),2003,83(6): 387-393.
[7] Schmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative CTmethod [J].Nat Protoc,2008,3(6): 1101-1108.
[8] Rock JM,Lang UF,Chase MR,Ford CB,Gerrick ER,Gawande R,Coscolla M,Gagneux S,Fortune SM,Lamers MH.DNA replication fidelity in Mycobacterium tuberculosis is mediated by an ancestral prokaryotic proofreader [J].Nat Genet,2015,47(6): 677-681.
[9] Biswas B,Kandpal M,Vivekanandan P.A G-quadruplex motif in an envelope gene promoter regulates transcription and virion secretion in HBV genotype B [J].Nucleic Acids Res,2017,45(19): 11268-11280.
[10] Rawal P,Kummarasetti VB,Ravindran J,Kumar N,Halder K,Sharma R,Mukerji M,Das SK,Chowdhury S.Genome-wide prediction of G4 DNA as regulatory motifs: role in Escherichia coli global regulation [J].Genome Res,2006,16(5): 644-655.
[11] Smith JS,Chen Q,Yatsunyk LA,Nicoludis JM,Garcia MS,Kranaster R,Balasubramanian S,Monchaud D,Teulade-Fichou MP,Abramowitz L,Schultz DC,Johnson FB.Rudimentary G-quadruplex-based telomere capping in Saccharomyces cerevisiae [J].Nat Struct Mol Biol,2011,18(4): 478-485.
[12] Cahoon LA,Seifert HS.An alternative DNA structure is necessary for pilin antigenic variation in Neisseria gonorrhoeae [J].Science,2009,325(5941): 764-767.
[13] Cahoon LA,Manthei KA,Rotman E,Keck JL,Seifert HS.Neisseria gonorrhoeae RecQ helicase HRDC domains are essential for efficient binding and unwinding of the pilE guanine quartet structure required for pilin antigenic variation [J].J Bacteriol,2013,195(10): 2255-2261.
[14] Norseen J,Johnson FB,Lieberman PM.Role for G-quadruplex RNA binding by Epstein-Barr virus nuclear antigen 1 in DNA replication and metaphase chromosome attachment [J].J Virol,2009,83(20): 10336-10346.
[15] Amrane S,Kerkour A,Bedrat A,Vialet B,Andreola ML,Mergny JL.Topology of a DNA G-quadruplex structure formed in the HIV-1 promoter: a potential target for anti-HIV drug development [J].J Am Chem Soc,2014,136(14): 5249-5252.
[16] Harris LM,Merrick CJ.G-quadruplexes in pathogens: a common route to virulence control? [J].PLoS Pathog,2015,11(2): e1004562.
[17] Siddiqui-Jain A,Grand CL,Bearss DJ,Hurley LH.Direct evidence for a G-quadruplex in a promoter region and its targeting with a small molecule to repress c-MYC transcription [J].Proc Natl Acad Sci USA,2002,99(18): 11593-11598.
[18] McLaughlin B,Chon JS,MacGurn JA,Carlsson F,Cheng TL,Cox JS,Brown EJ.A mycobacterium ESX-1-secreted virulence factor with unique requirements for export [J].PLoS Pathog,2007,3(8): e105.
