粗糙脉孢菌产纤维素酶培养条件的优化
2018-04-24郭清华熊本涛陈少林
郭清华,熊本涛,陈少林*
(1.西北农林科技大学 生命科学学院,陕西 杨陵 712100;2.西北农林科技大学 旱区生物质能研究中心,陕西 杨陵 712100)
丝状真菌再经长期的自然进化之后,成为降解植物生物质最有效的来源,也是目前商业化生产纤维素酶生产的主要菌种,如Trichodermareesei(Hypocreajecorina)[1]。粗糙脉孢菌(Neurosporacrassa)作为一种模式生物已被研究几十年之久[2],近些年来在纤维素降解以及糖转运蛋白方面取得了极其显著的成就[3-5],并且含有里氏木霉(Trichodermareesei)2倍多的纤维素基因,可参与生物质降解[6],而且国内外科学家亦从工业生产角度对粗糙脉孢菌进行研究,其中包括粗糙脉孢菌产乙醇发酵[7]与蛋白表达[8],其中山东大学曲音波教授对粗糙脉孢菌黑色素分泌以及木糖发酵等做出了系统研究[9-10],为使其更好地生产纤维素酶,本试验对其发酵条件进行进一步优化以提高其产量。
响应面分析法(response surface methodology,RSM)是一种寻找多因素系统中培养条件中最佳条件的数学统计方法,可以将多个变量影响的问题进行建模与分析,并根据其响应进行优化,与传统的单因素试验法(one variable at a time)、正交设计法(orithogonal design)等相比,具有缩短优化时间以及提高其可信度等优点,一般可以运用placett-burman(PB)设计法或者central composite design(CCD)设计法[11-12]。顾芮萌[13]等利用响应面分析法对粗糙脉孢菌产纤维素酶培养基进行优化,并将酶活提高2.08倍;同时,响应面分析也被用作哈茨木霉培养基优化[14]以及光叶蛋白提取工艺研究[15]。本试验采用粗糙脉孢菌野生型菌FGSC2498作为研究对象,通过中心组合试验设计(CCD)优化试验中各因素影响提高纤维素酶活力。
1 材料与方法
1.1 材料
1.1.1 菌种 粗糙脉孢菌(Neurosporacrassa)野生型菌株FGSC2489购自FGSC。
1.1.2 培养基 活化培养基(L):2% Vogel's salts,20 g蔗糖,12 g琼脂粉,自然pH。
产酶培养基(L):2% Vogel's salts,20 g微晶纤维素(Avicel),自然pH。
Vogel's salts(L):3.76 g CaCl2,126.72 g C6H5Na3O7,250 g KH2PO3,100 g NH4NO3,10 g MgSO4·7H2O,5 mL trace elements,2.5 mL 0.1 g/L生物素溶液。
Trace elements(L):50 g C6H8O7·H2O,0.5 g Na2MoO4·2H2O,50 g ZnSO4·7H2O,10 g Fe(NH4)(SO)2·6H,2.5 g CuSO4·5H2O,0.5 g MnSO4·H2O,0.5 g H3BO3。
1.1.3 仪器与设备 TECAN infinite M200 PRO酶标仪,上海南荣NRY-2112摇床,MAPADA UV-1800紫外分光光度计,BIO-RAD T100 Thermal Cycler。
1.2 方法
1.2.1 粗糙脉孢菌培养方法 把整个发酵过程分成:菌丝生长阶段(利用蔗糖-Vogel's培养基培养粗糙脉孢菌菌丝)和纤维素酶诱导阶段(利用Avicel- Vogel's培养基诱导纤维素酶),有利于提高纤维素酶的得率。具体方法如下:
在250 mL锥形瓶装入50 mL蔗糖-Vogel's液体培养基,接入适当体积的孢子悬液,使孢子悬液终浓度OD600=0.04,于30℃、200 r/min,暗光培养24 h,将菌丝过滤后,接入50 mL/250 mL Avicel-Vogel's培养基发酵产酶。
1.2.2 纤维素酶活性及蛋白浓度测定 总蛋白的浓度测定(Bradford试剂盒法):取10 μL上清液加入96酶标板微孔中,再加入100 μL Coomassie Brilliant Blue dye,置于Tecan酶标仪,混匀后,静止反应5 min,在595 nm波长处测量其OD值,以BSA标准曲线换算成蛋白质浓度。
FP酶活的检测:在96孔板微孔中加入90 μL 0.1 μmol·L-1乙酸钠缓冲液(pH 5.0),后加入90 μL上清液,最后再加入1张直径为5 mm的滤纸片,于水浴锅中50℃反应16 h。取50 μL上述反应液加入另一96微孔板孔的微孔中,再加入100 μLDNS反应液,在PCR仪100℃反应5 min。取36 μL上述反应液于酶标版,加入160 μL 0.1 μmol·L-1乙酸钠缓冲液(pH 5.0),用酶标仪在540 nm波长测量其OD值,通过还原糖标准曲线计算其还原糖浓度和酶活。
CMC酶活的检测:在96孔板微孔中加入50 μL 2% CMC溶液,然后再加入50 μL上清液接,于水浴锅中50℃反应30 min。再向上述反应液加入100 μL DNS溶液,在PCR仪100℃反应5 min。取36 μL上述反应液加入到酶标版的微孔中,最后加入160 μL 0.1 μmol·L-1乙酸钠缓冲液(pH 5.0),用酶标仪在540 nm波长测量其OD值,通过还原糖标准曲线计算其还原糖浓度和酶活。
2 结果与分析
2.1 响应面分析法试验设计与结果
利用Design Expert 8.0软件的CCD试验设计,对温度、pH、转速等各因素进行设计,试验设计各因素水平如表1所示。
利用Design Expert 8.0软件进行响应面试验设计,对试验因素进行优化设计,分别以滤纸酶活(FPase)活性、羧甲基纤维素酶活(CMCase)活性以及蛋白浓度(protein concentration)为响应值,以温度、pH值、转速为因变量,设计了20次试验以优化试验条件,得到的试验结果如表2所示,并对响应面曲面函数进行拟合。
通过 Design Expert 8.0软件对表 2数据进行分析,表 3为方差分析结果。以蛋白浓度为响应值,对表2数据进行多元二次回归拟合,建立回归模型。回归方程为:
Y=145.55+9.05A+2.60B-3.03C+1.54AB-5.01AC+0.65BC+1.55AA-2.25BB-0.39CC
(1)
以滤纸酶活性为响应值的回归方程为:
Y=0.80+0.19A+0.111 43B-0.175 87C+0.026 288AB-0.104AC+0.024 20BC-0.054 612AA-0.117BB-0.024 39CC
(2)
以羧甲基纤维素作为底物的酶活性相应值方程为:
Y=1.46+0.12A-6.520E-003B-0.070C-9.986E-003AB-0.14AC+0.048BC-0.16AA-0.11BB+7.635E-003CC
(3)

表2 不同独立变量对响应值的影响

表3 回归方程方差分析
由表3可以看出,回归模型的F值为16.19,P<0.001,表明此模型达到极显著水平;失拟项(Lack of Fit)的P=0.955 1>0.05,由此说明失拟项差异并不显著,本试验无失拟因素的存在,能准确反应实际情况,回归模型没有问题。而试验模型的决定系数R2=1.42/1.51=0.940 39,说明酶活及蛋白浓度与模型预测有很好的一致性,因此试验结果可靠,此模型及回归方程可以对酶活及蛋白浓度进行分析及预测。回归方程中各项方差分析F检验值可以判断出本试验设计中各个自变量及其交互相对因变量的影响。由表2、表3可得,温度与转速对响应值的影响最为显著,虽然pH对响应值的影响较弱,但仍是极其显著;而交叉项中,温度与转速有显著影响,而其余的2种交互相对结果的影响不显著;二次项中pH对响应值的影响达到显著水平,而温度与转速对其影响不甚明显。
2.2 响应面分析
通过Design-Expert 8.0软件分析得到的响应面图,响应面图示根据试验因素因素温度及转速与响应值CMC酶活、FP酶活、蛋白浓度构成三维曲面图。
由图1~图3可知,温度与pH对响应值的影响不甚明显,并且可以得出温度为22.5℃、pH为6.25、转速为200 r/min时,CMCase达1.23 mg/L,FPase达1.55 mg/L,蛋白浓度达162.349 mg/L,可以较高地提高粗糙脉孢菌产纤维素酶的能力。
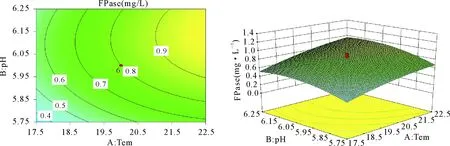
图1 温度与pH对粗糙脉孢菌滤纸酶活的影响的等温线与响应面分析

图2 温度与pH对粗糙脉孢菌CMC酶活的影响的等温线与响应面分析
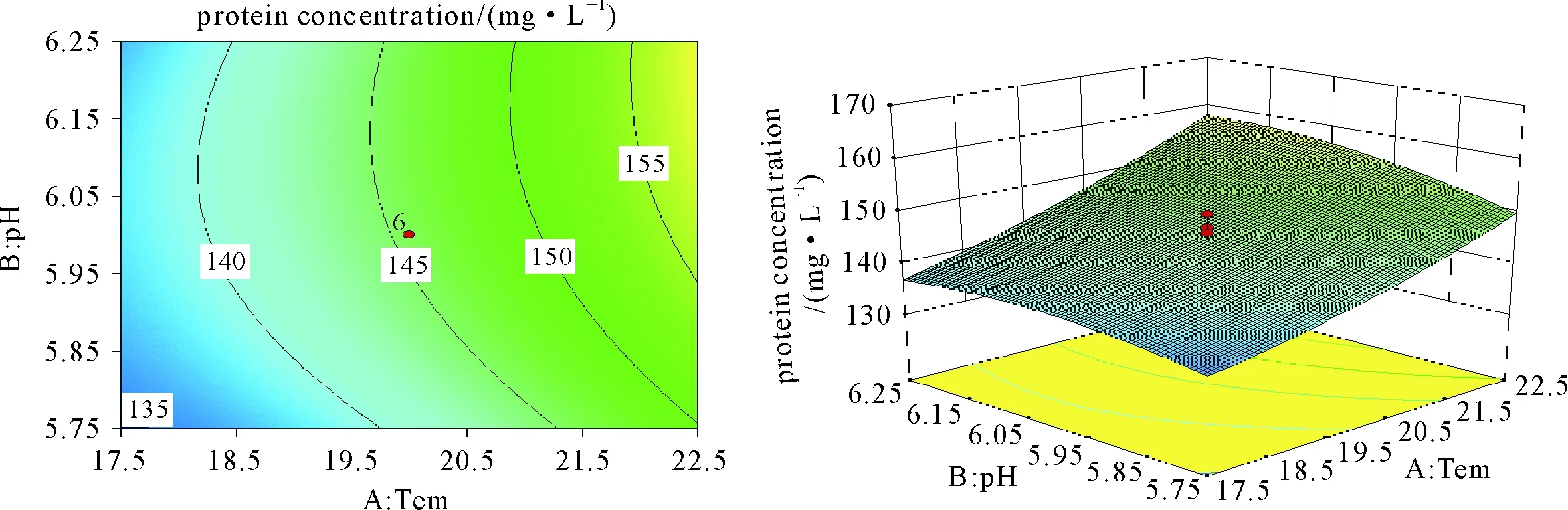
图3 温度与pH对粗糙脉孢菌蛋白浓度的影响的等温线与响应面分析
2.3 模型验证试验
表4为原始培养条件与优化后培养条件产酶结果对比,每个条件分别设置3个重复,初始产酶条件为温度25℃、转速为200 r/min、pH 6.0。从表4可以看出,优化后培养条件将CMCase提高34.4%,FPase提高60%,蛋白浓度提高11.22%,极大地提高了FP酶活。

表4 模型试验结果
3 结论与讨论
试验采用响应面分析法对粗糙脉孢菌这一模式菌株进行产纤维素酶发酵条件的优化,使其提高产纤维素酶的能力。根据响应面法设计的3因素20次试验的结果得出,温度为20℃、pH为6.25、转速为200 r/min时,可以较高地提高粗糙脉孢菌产纤维素酶的能力,此时CMCase达1.230 mg/L,FPase达1.550 mg/L,蛋白浓度达162.349 mg/L。
在发酵条件试验的3个控制因素中,温度、转速对响应值的影响最为显著,其次是pH,转速对响应值的影响比pH显著。转速可以影响发酵过程中的通气量,溶氧水平随着转速的提高而增加,溶氧水平可以极大促进粗糙脉孢菌发酵产酶。同时,随着转速升高,产生的作用力极易打断粗糙脉孢菌菌丝体,不利于发酵产酶[16]。
本试验所使用的是摇瓶培养法,锥形瓶中条件控制较为欠佳,所以优化后的粗糙脉孢菌产纤维素酶能力的提高并不明显。而后期试验中计划将其接入发酵罐中,发酵罐中更为精密的控制条件及搅拌过程中更为充分的溶氧率,必能更好地提高粗糙脉孢菌产纤维素酶的能力。
参考文献:
[1] KUBICEK C P,MIKUS M,SCHUSTER A,etal.Metabolic engineering strategies for the improvement of cellulase production byHypocreajecorina[J].Biotechnology for Biofuels,2009,2(1):19.
[2] DAVIS R H,PERKINS D D.Neurospora:a model of model microbes[J].Nature Reviews Genetics,2002,3(3):397-403.
[3] TIAN C,BEESON W T,IAVARONE A T,etal.Systems Analysis of Plant Cell Wall Degradation by the Model Filamentous FungusNeurosporacrassa[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(52):22157-62.
[4] ALLGAIER S,TAYLOR R D,BRUDNAYA Y,etal.Vaccine production inNeurosporacrassa[J].Biologicals,2009,37(3):128.
[5] GALAZKA J M,TIAN C,BEESON W T,etal.Cellodextrin transport in yeast for improved biofuel production.Science[J].Science,2010,330(6000):84.
[6] DUNLAP J C,BORKOVICH K A,HENN M R,etal.Enabling a community to dissect an organism:overview of theNeurosporafunctional genomics project[J].Advances in Genetics,2007,57(12):49.
[7] ALLGAIER S,TAYLOR R D,BRUDNAYA Y,etal.Vaccine production inNeurosporacrassa[J].Biologicals,2009,37(3):128.
[8] ZHANG Z,QU Y,ZHANG X,etal.Effects of oxygen limitation on xylose fermentation,intracellular metabolites,and key enzymes ofNeurosporacrassa,AS3.1602[M]// Biotechnology for Fuels and Chemicals.Humana Press,2007:39-51.
[9] 李建波,宋欣,田敏,等.粗糙脉孢菌产黑色素条件优化及黑色素物理特性研究[J].山东大学学报理学版,2004,39(4):120-124.
LI J B,SONG X,TIAN M,etal.Optimizing conditions of melanin production byNeurosporacrassaand study of melanin physical character[J].Journal of Shandong University,2004,39(4):120-124.(in Chinese)
[10] 张潇,朱冬青,王丹,等.粗糙脉孢菌(Neurosporacrassa)木糖发酵的研究[J].微生物学报,2003,43(4):466-472.
ZHANG X,ZHU D Q,WANG D,etal.Study on xylose fermentation byNeurosporacrassa[J].China Biotechnology,2003,43(4):466-472.(in Chinese)
[11] WU Q L,CHEN T,GAN Y,etal.Optimization of riboflavin production by recombinant bacillus subtilis RH44 using statistical designs[J].Applied Microbiology and Biotechnology,2007,76(4):783-794.
[12] 赵丽坤,郭会灿.微生物培养基优化方法概述[J].石家庄职业技术学院学报,2008,20(4):50-52.
ZHAO L K,GUO H C.A methodological survey of the optimization of the microbial culture medium media[J].Journal of Shijiazhuang Vocational Technology Institute,2008,20(4):50-52.(in Chinese)
[13] 顾芮萌,李勇昊,田朝光.粗糙脉孢菌(Neurosporacrassa)纤维素酶液体发酵培养基的优化[J].中国生物工程杂志,2012,32(3):76-82.
GU R M,LI Y H,TIAN C G.The medium optimization of cellulase fermentation of by response surface methodology[J].China Biotechnology,2012,32(3):76-82.(in Chinese)
[14] 姚琳,杨谦.哈茨木霉发酵生产MonocillinⅠ的培养基优化研究[J].西北林学院学报,2014,29(2):144-148.
YAO L,YANG Q.Optimization of the media for the culture of monocillinⅠ byTrichodermaharzianum[J].Journal of Northwest Forestry University,2014,29(2):144-148.(in Chinese)
[15] 王丽,苏印泉,张强,等.光叶楮叶蛋白提取工艺优化和氨基酸分析研究[J].西北林学院学报,2012,27(2):137-142.
WANG L,SU Y Q,ZHANG Q,etal.Optimization of extraction technology and amino acid analysis of protein extracted fromBroussonetialeaf[J].Journal of Northwest Forestry University,2012,27(2):137-142.(in Chinese)
[16] 史祥才,李江华,刘龙,等.搅拌转速和通气量对黑曲霉生产β-甘露聚糖酶深层发酵培养的影响[J].工业微生物,2013,43(3):32-37.
SHI X C,LI J H,LIU L,etal.Effects of agitation and aeration on production ofβ-mannanase byAspergriuusnigerWB6002[J].Industrial Microbiology,2013,43(3):32-37.(in Chinese)
