胰腺肉瘤样癌一例并文献复习
2018-04-24杨玉姣梁盼高剑波
杨玉姣 梁盼 高剑波
肉瘤样癌(sarcomatoid carcinoma,SC)是一种兼具上皮和肉瘤样两种成分的恶性肿瘤,多数学者认为SC的本质是一种来源于上皮细胞的未分化癌,而非肉瘤[1-4]。SC可以发生在人体的不同器官和解剖学位置,如上消化道、上呼吸道、膀胱、前列腺、小肠[5],甚至皮肤[6],但均较少见,原发于胰腺组织者更为罕见。胰腺肉瘤样癌(sarcomatoid carcinoma of the pancreas,SCP)是原发于胰腺上皮细胞的恶性肿瘤,发病率约占胰腺肿瘤的1.56%,占胰腺非内分泌恶性肿瘤的2%~7%[7-9]。SCP具有恶性度高、侵袭力强、手术切除率低、易复发及预后差等特征,发现时多已发生转移。郑州大学第一附属医院收治1例SCP肝转移合并肾错构瘤患者,现结合国内外相关文献进行回顾性分析。
一、病历资料
患者男性,66岁。以“腹痛1月余”入院。1个月前出现左下腹痛,餐后加重,伴纳差、恶心、呕吐,呕吐少量黏液。近1个月体重下降约5 kg。体检:皮肤巩膜无黄染,全身浅表淋巴结未触及;腹部柔软,左下腹压痛、反跳痛。肿瘤标志物检测: CA125 93.673 U/ml(正常值<35 U/ml),CA50>180 U/ml(正常值<25 U/ml),CA19-9>1 000 U/ml(正常值<35 U/ml)。CT示胰体尾部一囊实性肿块影,约48 mm×74 mm,呈侵袭性生长,未见明显包膜,胰周脂肪间隙尚清,增强后边缘实性成分呈渐进性轻中度强化,主胰管及分支胰管轻度扩张;肝脏形态不规整,可见多发类圆形稍低密度影,中央密度更低,边界不清,增强后呈浅淡环形强化;左肾局部皮质变薄,内见脂肪密度肿块影,增强后呈轻度强化。初步诊断:胰体尾部占位并肝转移,左肾错构瘤(图1)。在CT引导下行胰腺肿块穿刺,穿刺物病理检查见大量异型细胞,呈梭形、星形或多边形,可见单核或多核瘤巨细胞,胞质丰富,胞核异型,分裂象明显,瘤细胞排列成巢状或索状。免疫组织化学染色:CK(灶+),CAM5.2(+),CD68(+),CK8/18(+),Ki-67(约50%+),Vimentin(+)(图2),病理诊断为SCP。确诊后未给予患者特殊治疗,因家属要求而出院, 1个月后死亡。
二、文献复习
以“胰腺肉瘤样癌”、“sarcomatoid carcinoma of the pancreas”作为检索词在“Pubmed”、“万方数据库”、“中国知网数据库”中进行检索,剔除重复及临床资料不详病例,最后检索到有关SCP的文献19篇51例[7-25],加上本组1例共52例。
三、结果
1.临床表现:52例患者中男性36例,女性16例,年龄39~85岁。主要症状:腹痛38例次(其中伴消瘦8例次、厌食6例次、黄疸3例次、发热2例次),黑便5例次,无明显症状2例次,腹部包块3例次,疑似胰腺炎1例次,厌食、乏力1例次,发热、腹膜炎1例次,1例未见具体报道。
2.影像学检查:52例中31例见肿块位于胰腺体尾部,16例位于胰腺头颈部,3例侵犯全胰腺,2例未见具体报道。肿块呈囊实性不规则形,多数体积较大。32例次发生局部侵犯,10例次发生远处转移。
3.治疗及随访:36例行手术切除,术式根据肿块的位置及与周围组织脏器的关系进行选择,其中21例行脾+胰尾部切除术,9例行胰十二指肠切除术,2例行胰颈切除术,2例行胰腺全切术,2例术式不详,其中3例次术后行化疗;6例行开腹探查术,1例行手术活检,1例行TOMO螺旋断层放疗[18],6例未给予特殊处理,2例未提及治疗方案。
有随访记录25例,随访2 d~15年。21例死亡,生存时间1~9个月,3例无病生存,已生存时间13个月~3年,1例痊愈出院,1例报道时还在随访中。27例无随访记录。
讨论SCP是一种非常罕见的胰腺恶性肿瘤,多见于中年男性。早期一般无临床症状,多在体检时偶然发现腹部包块或胰腺占位,部分有腹部轻压痛。晚期临床表现与肿瘤生长部位有关,可表现为上腹痛、厌食、消瘦、黄疸、腹部肿块等。因早期多无特异性临床症状,多数患者确诊时已广泛转移,预后较差。本例患者自出现症状至死亡仅2个半月时间,也说明该肿瘤病程进展快、恶性度高、预后差的特征。
SCP起源于胰腺导管和腺泡,其本质是癌而非肉瘤或癌肉瘤。Alguacil-Garcia等[9]根据病理组织学特征将其分为梭形细胞型、恶性巨细胞瘤型、多形性巨细胞瘤型、圆形细胞未分化型4种类型。根据相关文献,SCP的诊断标准一般需满足以下3个条件:(1)肿瘤原发于胰腺,而非转移或邻近脏器肿瘤侵袭而来[10];(2)肿瘤具有明确的癌与肉瘤双相成分,其中肉瘤样成分占50%以上[26];(3)免疫组织化学显示肿瘤上皮样标志物(CK、EMA)和间叶标志物(vimentin)表达阳性[10]。本例结果与上述报道一致。
SCP可见于胰腺的任何部位,约59.6%见于胰腺体部、尾部及体尾部。CT是早期发现病灶的主要检查手段,表现为:(1)因肿瘤恶性度高,生长迅速,病灶以巨块型多见;发生于胰头的肿块,肝内胆管及胰管扩张不明显,胰尾部不萎缩。(2)CT平扫缺乏特异性,表现为低密度、等密度或稍高密度,这可能与瘤体内出血罕见、含铁血黄素沉积及纤维组织增生少有关[27]。(3)瘤体呈囊实性,易发生坏死,这可能与肿块体积较大、生长过快有关,也可能与瘤体内血管网丰富,同时含有实性和囊性结构有关[28]。(4)瘤体内可见钙化灶,以结节样小钙化为主,未见团块状钙化或微小钙化(砂砾体)灶[7]。(5)CT增强扫描显示瘤周不规则片状或环状中等强化,中央区强化不明显,门脉期及延迟期强化高于正常胰腺组织,以动脉期最低,门脉期强化最明显[7]。(6)SCP侵袭性强,多伴有邻近组织器官的侵犯,胃肠、脾、脾动脉、胰周淋巴结和肝脏常受其侵犯。(7)胰头部位的SCP易压迫胰管及胆管,进而导致胰管、肝内胆管扩张[29]。本例患者CT示肝内多发类圆形稍低密度影,边界不清,CT增强呈浅淡环形强化,提示肝内多发转移。CA50是一个非特异性广谱肿瘤标志物,对肿瘤细胞转移的阳性率可高表达(82.8%)[30-31],结合本例患者CA50明显升高,另根据血液循环途径,肝脏肿瘤转移至胰腺的较罕见,故综合考虑肝内多发占位为转移灶。同时,CT示左肾见不规则形的混杂密度影,边界不清,其内见不规则条状软组织密度分隔影及不规则片状、结节状等稍高密度病灶,CT值39~64 HU;肿瘤组织内见大量不规则片状脂肪组织,CT值-32~-81 HU。增强动脉期扫描见低密度脂肪成分未见强化,肿瘤实质明显强化,CT值71~134 HU,肿块边界不清,残留肾脏强化明显,拟诊左肾错构瘤。SCP合并肾错构瘤在以往文献中未见报道,与SCP的发生是否相关尚不明确,需进一步研究。
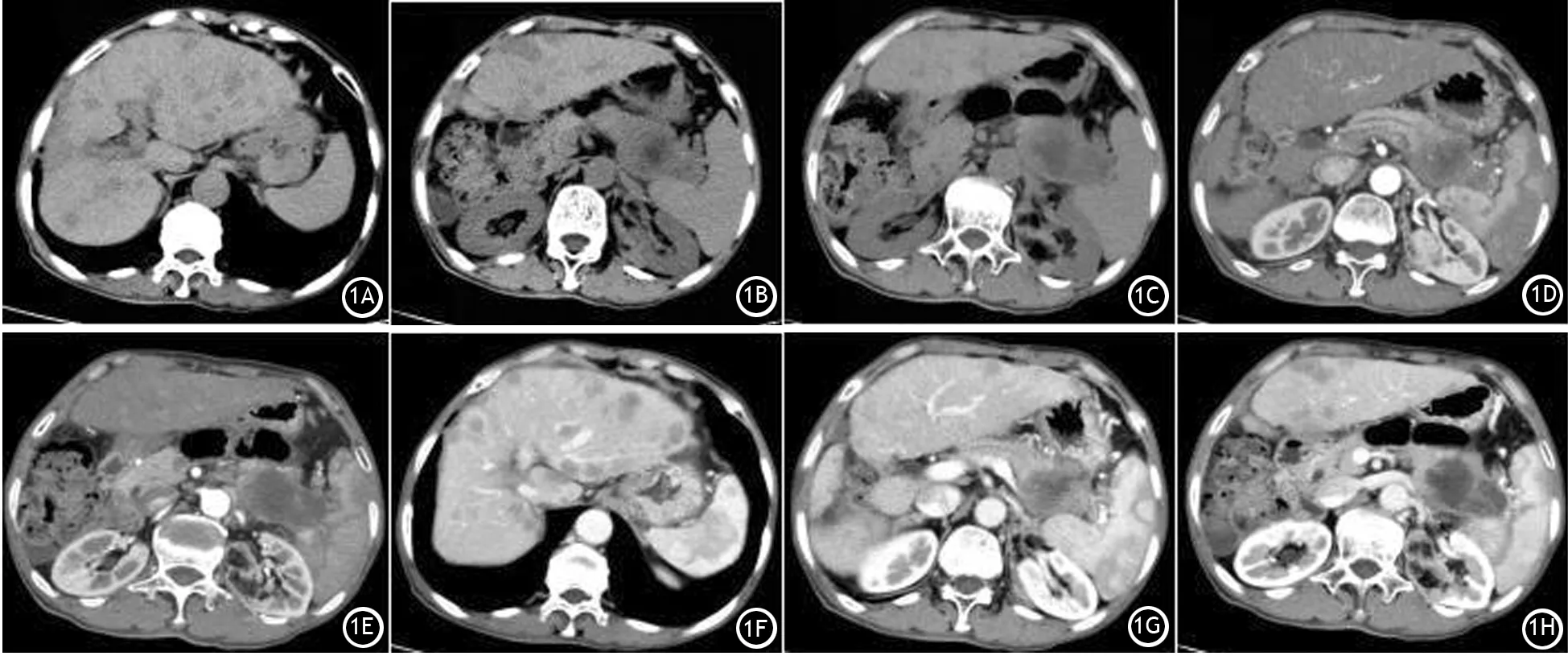
图1 患者腹部CT平扫(1A~1C)示胰腺体尾部一囊实性肿块,中心可见片状坏死区,边界欠清,无明显包膜,肝内可见多发类圆形低密度影,边界不清;左肾局部皮质变薄,内见脂肪密度影。增强动脉期(1D~1E)示肿块边缘实性成分呈轻中度强化,中央液化坏死区无明显强化,胰管扩张;左肾病灶区呈轻度强化,脂肪成分未见强化。静脉期(1F~1H)示肿块实性病灶强化较动脉期明显,液化坏死区无明显强化,肝内可见多发低密度影,边缘呈环形强化;左肾病灶区强化减弱
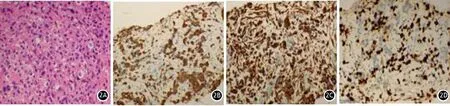
图2 胰腺肉瘤样癌细胞排列成巢状或索状(2A, HE ×200);免疫组织化学染色示 CK(2B ×200)、Vimentin(2C ×200)、Ki-67(2D ×200)阳性表达
SCP对放化疗均不敏感,手术切除仍是首选的治疗方法。手术方式可根据肿瘤大小、部位及受侵邻近脏器等灵活选择。但由于SCP临床及影像学诊断困难,且异型性明显,侵袭性强,多数患者就诊时已失去手术机会。近年随着放疗技术的迅速发展,体部立体定向放疗、调强放疗以及螺旋断层放疗等技术提高了靶区照射剂量,减少了靶区外正常组织受照射剂量,从而提高了胰腺癌的局部控制率。对早期SCP采用TOMO螺旋断层放射治疗可获得有效控制,并将不良反应控制在可接受范围内[18],该方案可为以后的治疗提供新的思路。
SCP预后极差,多在确诊后半年内死亡。有文献报道,SCP确诊后平均生存期为2~3个月[32],3年生存率小于3%[33]。
[1] Wick MR, Swanson PE. Carcinosarcomas:current perspectives and an historical review of nosological concepts[J].Semin Diagn Pathol,1993,10(2):118-127.
[2] Takubo K, Tsuchiya S, Nakagawa H, et al. Pseudosarcoma of the esophagus[J]. Hum Pathol,1982,13(5):503-505.
[3] Watanabe H, Jass JR, Sobin LH. Histological Typing of Esophageal and Gastric Tumors[M]// Histological typing of oesophageal and gastric tumours. Spring-Verlag,1990:287-295.
[4] Travis WD, Colby TV, Corrin B, et al. Histological Typing of Lung and Pleural Tumours[M]// WHO international histological classification of tumours.3rd ed.Berlin:Springer,1999.
[5] Nese E, Aydin-Ergun S, Haldun K. Sarcomatoid carcinoma of the colon[J].Turk J cancer,2005,35:138-140.
[6] Inaloz HS, Ayyalaraju RS, Holt PJ, et al. A case of sarcomatoid carcinoma ofthe skin[J].J Eur Acad Dermatol Venereol,2003,17(1):59-61.
[7] 朱庆强,朱文荣,吴晶涛,等.胰腺肉瘤样癌的多层螺旋CT检查特征[J].中华消化外科杂志,2013,12(8):612-615.DOI:10.3760/cma.j.issn.1673-9752.2013.08.013.
[8] 陈咏莲,孙景洲.胰腺肉瘤样癌二例报告[J].第二军医大学学报,1995,6(1):97.
[9] Alguacil-Garcia A, Weiland LH. The histologie spectrum,pmgnosis,and histogenesis of the sarcomatoid carcinoma of the pancreas[J].Cancer,1977,39(3):1181-1189.
[10] 赵龙,姚捷,朱长仁,等.胰腺肉瘤样癌二例报告并文献复习[J].中华肝胆外科杂志,2014,20(10):747-750.DOI:10.3760/cma.j.issn.1007-8118.2014.10.015.
[12] 谭黄业,耿协强.胰腺肉瘤样癌1例[J].临床军医杂志,2005,33(4):528.DOI:10.3969/j.issn.1671-3826.2005.04.107.
[13] 陈明祥,朱长仁.胰腺肉瘤样癌2例报道并文献复习[J].中国当代医药,2014,21(25):149-150.
[14] 陈莉丽,陈娟,卜平,等.胰腺肉瘤样癌2例报道[J].胃肠病学和肝病学杂志,2014,23(7):837-838.DOI:10.3969/j.issn.1006-5709.2014.07.034.
[16] 石欣,张齐,郭庆明,等.胰腺间变癌的诊断和治疗(附2例临床病理分析)[J].临床肝胆病杂志,2007,23(4):301-303.DOI:10.3969/j.issn.1001-5256.2007.04.030.
[17] 何敏,陈涛,王坚,等.胰体尾部肉瘤样癌一例报道[C].全国第十九届肝胆胰外科学术交流会资料汇编.2006:252-253.
[18] Hu QL, Li HQ, Xia TY. A case of sarcomatoid carcinoma of the pancreas[J].Word J Digestol, 2015,23(4):707-710.DOI:10.11569/wcjd.v23.i4.707.
[19] 韩冰,王警建,赵清,等.胰腺肉瘤样癌的CT影像学特征研究[J].实用癌症杂志,2014,(6):687-689.DOI:10.3969/j.issn.1001-5930.2014.06.025.
[20] Del RS, Muoznavas MA, Betés M, et al. Sarcomatoid carcinoma of the pancreas and congenital choledochal cyst[J].Gastrointes Endosc,2006,64(6):1005-1006.DOI:10.1016/j.gie.2006.06.004.
[21] Fabre J, Plangues J, Bouissou H, et al. Sarcomatoid carcinoma of the pancreas[J].Toulouse Med,1961,62:85-98.DOI:10.1016/j.tcmj.2014.09.003.
[22] Higashi M, Takao S, Sato E. Sarcomatoid carcinoma of the pancreas:a case report with immunohistochemical study[J].Pathol Int,1999,49(5):453-456.
[23] Yao J, Qian JJ, Zhu CR, et al. Laparoscopic left pancreatectomy for pancreatic sarcomatoid carcinoma:A case report and review of the literature[J].Oncol Lett,2013,6(2):568-570.DOI:10.3892/ol.2013.1411.
[24] Kane JR, Laskin WB, Matkowskyj KA, et al. Sarcomatoid (spindle cell) carcinoma of the pancreas:A case report and review of the literature[J].Oncol Lett,2014,7(1):245-249.DOI:10.3892/ol.2013.1683.
[25] Ren CL, Jin P, Han CX, et al. Unusual early-stage pancreatic sarcomatoid carcinoma[J].World J Gastroenterol,2013,19(43):7820-7824.DOI:10.3748/wjg.v19.i43.7820.
[26] 方铣华,林雪平.肉瘤样癌及癌肉瘤的新认识[J].肿瘤研究与临床,2005,17(2):138-139.DOI:10.3760/cma.j.issn.1006-9801.2005.02.036.
[27] Schima W, Schima W. MRI of the pancreas:tumours and Tumour-simulating rocesses[J].Cancer Imaging,2006,6:199-203.DOI:10.1102/1470-7330.2006.0035.
[28] Husain AN, Colby TV, Ordóez NG, et al. Guidelines for pathologic diagnosis of malignant mesothelioma:a consensus statement from the International Mesothelioma Interest Group[J].Arch Pathol Lab Med,2009,133(8):1317-1331.DOI:10.1043/1543-2165-133.8.1317.
[29] 周杰,崔忠林,朱碧丽,等.胰岛素瘤的影像学特征[J].中华消化外科杂志,2012,11(1):66-68.DOI:10.3760/cma.j.issn.1673-9752.2012.01.019.
[30] Huang CW, Bai L. Clinical value of carbohydrate antigen 50 and carbohydrate antigen 242 in the diagnosis of colorectal carcinoma[J].Di Yi Jun Yi Da Xue Xue Bao,2002,22(12):1116-1118.
[31] 何浩明,冯文,吉亚君.肿瘤的现代检验诊断与临床[M]//上海:同济大学出版社,2007:126-127.
[32] Cubilla AL, Fitzgerald PJ. Pleomorphic carcinoma of the pancreas with massive lymphocytic stromal infiltration and tong-term survival after resection[J].Int-J Pancreatol,2000,27(3):241-248.DOI:10.1385/IJGC:27:3:241.
[33] Kamisawa T, Tabata I, Isawa T, et al. A case ofpleomorphic carcinoma of the pancreas showing sequential histological change by immunohistochemieal study[J].Int J Pancreatol,1995,18(1):67-70.
