外源蛋白酶对腐乳后发酵理化和感官特性的影响
2018-04-20喻世哲刘晶晶吴佳伦韩北忠陈晶瑜
喻世哲,刘晶晶,吴佳伦,韩北忠,陈晶瑜*
腐乳习惯上分为“红方”、“青方”、“白方”3 种,是我国传统的发酵豆制品[1-3],因其味道鲜美、具有抗氧化和降血压等保健功能[4-7]深受消费者喜爱。腐乳的发酵过程主要发生了生物化学和物理化学两种变化[8]。腐乳白坯的制作为物理化学变化[9],腐乳的后发酵阶段主要是生物化学变化。 腐乳发酵分为前发酵和后发酵[10-12],前发酵是培养菌系和积累酶系的过程,一般为36~48 h。后发酵是酶系作用于腐乳毛坯的过程,时间较长,一般为3~6 个月,发酵周期长,生产成本高,制约了其在我国的工业化生产[13-14]。近年来,针对缩短腐乳生产周期的研究较多,主要集中在对后发酵进行处理。比如,加酶控温后发酵[15-20],添加增香酵母、乳酸菌[21],高压电场和高频磁场处理[22]等。其中,在后发酵阶段直接加入酶制剂是一种比较便捷的方式。本研究在腐乳后发酵阶段直接添加外源蛋白酶(木瓜蛋白酶和皱胃酶),对腐乳后发酵过程中理化和感官特性的变化进行研究,了解外源蛋白酶的添加对腐乳品质的影响,结果将对酶促腐乳的工业化生产具有一定的指导意义。
1 材料与方法
1.1 材料与试剂
毛霉型红腐乳 中国北方某腐乳生产企业;皱胃酶、木瓜蛋白酶(食品级) 帝斯曼中国有限公司;甲醛、硝酸银(均为分析纯) 广东汕头市西陇化工厂;氢氧化钠(分析纯) 北京化工厂;铬酸钾(分析纯) 天津市大茂化学试剂厂。
1.2 仪器与设备
DHG-9053A电热恒温干燥箱、DHP-9052电热恒温培养箱 上海一恒科学仪器有限公司;BSA2202S分析天平、PB-21型pH计 德国赛多利斯公司;FTC质构仪北京盈盛恒泰科技有限公司。
1.3 方法
1.3.1 酶促腐乳的制备
腐乳盐坯尺寸为3.2 cm×3.2 cm×1.6 cm,装于已灭菌的玻璃瓶中,每瓶12 块,总质量约160 g。按照腐乳-汤料1∶1(g/mL)的比例,每瓶中加入160 mL汤料,然后分别加入木瓜蛋白酶和皱胃酶[23],添加量分别为腐乳总蛋白的1%、2%、4% (质量分数),密封,于28 ℃后发酵培养。每个添加量的酶促腐乳制作3 个平行样。
1.3.2 样品采集
每个酶促腐乳样品于后发酵5、10、15、20、25、30、35、40 d时,取3 块用于理化分析和感官评价。
1.3.3 理化指标的测定
pH值:精确称取样品3.000 g,加入蒸馏水27 mL,高速匀浆后,用pH计测定悬浮液的pH值;水分含量:采用常压恒重法,参照SB/T 10170—2007《腐乳》[24];总酸含量:采用滴定法,参照SB/T 10170—2007;氨基态氮含量:采用甲醛滴定法,参照SB/T 10170—2007。
硬度:利用质构仪测定,具体参数:探头型号P/0.5,测前下压和测试速率60 mm/min,压缩比例30%,触发力2.5 N。
1.3.4 感官评价
采用定量描述分析进行感官评价[25]。选定11 名感官评价人员,采用5 分制,结合SB/T 10170—2007中的感官评定要求制定评分标准,如表1所示。

表1 腐乳感官评分标准Table 1 Criteria for sensory evaluation of sufu
2 结果与分析
2.1 发酵过程中样品pH值的变化
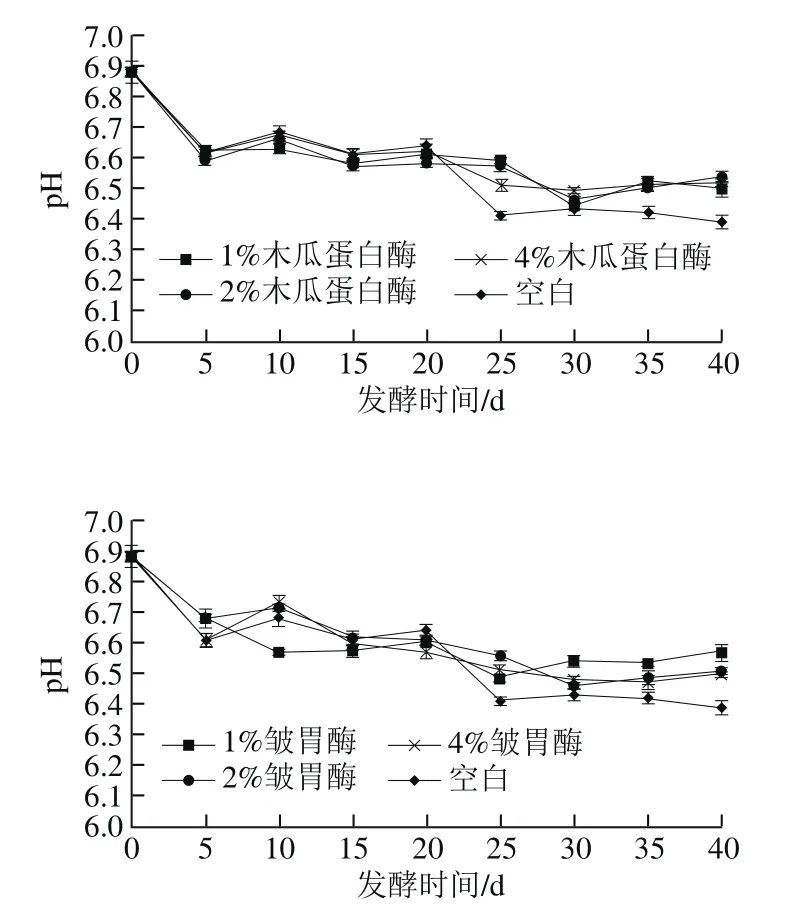
图1 不同添加量蛋白酶处理腐乳pH值在后发酵过程中的变化Fig. 1 Changes in pH during ripening of sufu with different concentrations of proteases
由图1可看出,腐乳后发酵过程中pH值总体呈下降趋势。空白组中,pH值在第5天明显下降,之后保持稳定,在第25天再次下降后保持平稳,最低达到6.39。木瓜蛋白酶处理组中,pH值在0~20 d的变化趋势与空白组基本保持一致;25 d时4%木瓜蛋白酶处理组pH值下降至6.51后保持稳定,但是高于空白组;1%和2%木瓜蛋白酶处理组pH值均在第30天明显下降之后略有升高,第40天时分别达到6.50、6.54。1%皱胃酶处理组的pH值在第5天下降明显,至第25天保持下降趋势,之后略有升高。2%和4%皱胃酶处理组的pH值在第25天之前与空白组变化趋势基本保持一致,之后保持稳定,但pH值始终高于空白组。Naes等[26]从乳酸菌NCDO151中提取出蛋白酶,对其加速干发酵香肠成熟作了初步研究,发现蛋白酶的添加使可溶性蛋白质快速降解,pH值迅速下降。而Diaz等[27]在发酵香肠中添加木瓜蛋白酶,结果表明外源蛋白酶的添加对发酵过程中香肠pH没有明显的影响。
引起腐乳在发酵过程中pH值降低的主要原因是乳酸菌等微生物发酵产生乳酸、醋酸、琥珀酸等有机酸、蛋白质分解后酸性氨基酸的释放、碳水化合物和脂肪酸的分解。pH值升高则是由于蛋白质分解产生氨基酸,氨基酸的进一步脱氨基作用产生氨[18]。实验组中加入木瓜蛋白酶和皱胃酶,加速腐乳中蛋白质的分解,产生了比空白组更多的游离氨基酸和氨,因此在25 d后木瓜蛋白酶组和皱胃酶组的pH值高于空白组。
2.2 发酵过程中样品水分的变化
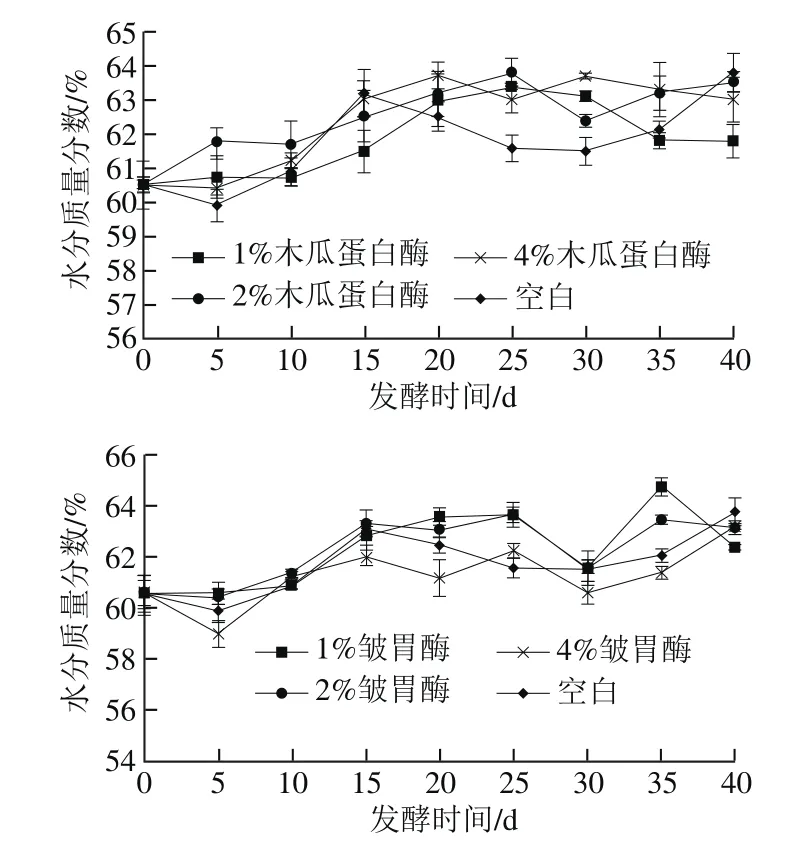
图2 不同添加量蛋白酶处理腐乳水分含量在后发酵过程中的变化Fig. 2 Changes in moisture during ripening of sufu with different concentrations of proteases
由图2可看出,腐乳后发酵过程中水分含量整体呈缓慢上升趋势,空白组水分质量分数在第5天时下降后呈上升趋势,达到63.2%,15~30 d呈下降趋势后上升。木瓜蛋白酶处理组中,相比于空白组不同的是:第15天时腐乳中水分含量仍呈缓慢上升趋势,除1%木瓜蛋白酶处理组的水分含量在第25天后逐渐降低,其余实验组水分含量均趋于稳定。皱胃酶处理组中,腐乳水分含量变化趋势总体与空白组一致,其中1%皱胃酶处理组水分含量在第25天后有较大的波动。根据SB/T 10170—2007,在后期发酵结束后,成品腐乳的水分质量分数不大于72%即符合标准,木瓜蛋白酶和皱胃酶组的腐乳均符合标准。
腐乳前期发酵结束后水分质量分数为45%左右,在腐乳后发酵阶段,随着汤料中水分的迁移,其水分含量迅速上升。蛋白酶组与空白组存在差异,其主要原因是木瓜蛋白酶和皱胃酶使腐乳表面覆膜蛋白质水解为肽、氨基酸等小分子物质,增加了腐乳的渗透性,促进了水分的迁移。
2.3 发酵过程中样品总酸的变化
由图3可看出,腐乳后发酵中总酸含量呈上升趋势,然后趋于稳定。参照SB/T 10170—2007,成品红腐乳总酸含量规定不大于1.3 g/100 g,空白组、木瓜蛋白酶处理组和皱胃酶处理组均符合标准。其中空白组中,总酸含量在后发酵阶段的0~20 d迅速上升,在20~30 d时存在明显的下降,之后呈先上升后下降的趋势。木瓜蛋白酶处理组中,10~25 d总酸上升速率低于空白组,其中4%木瓜蛋白酶处理组总酸含量在20~25 d之间下降后缓慢上升,第40天时总酸含量到达0.59 mg/100 g左右,与空白组一致;1%和2%木瓜蛋白酶处理组均基本呈上升趋势,而1%木瓜蛋白酶处理组在第40天时呈下降趋势,至0.54 mg/100 g。除4%皱胃酶处理组在25~30 d时明显上升后迅速降低以外,1%和2%皱胃酶处理组腐乳总酸含量变化趋势基本与空白组一致,前20 d迅速上升,在20 d后缓慢下降,与董爽等[28]在研究酶促腐乳生产过程中各种理化性质变化的研究结果相符。
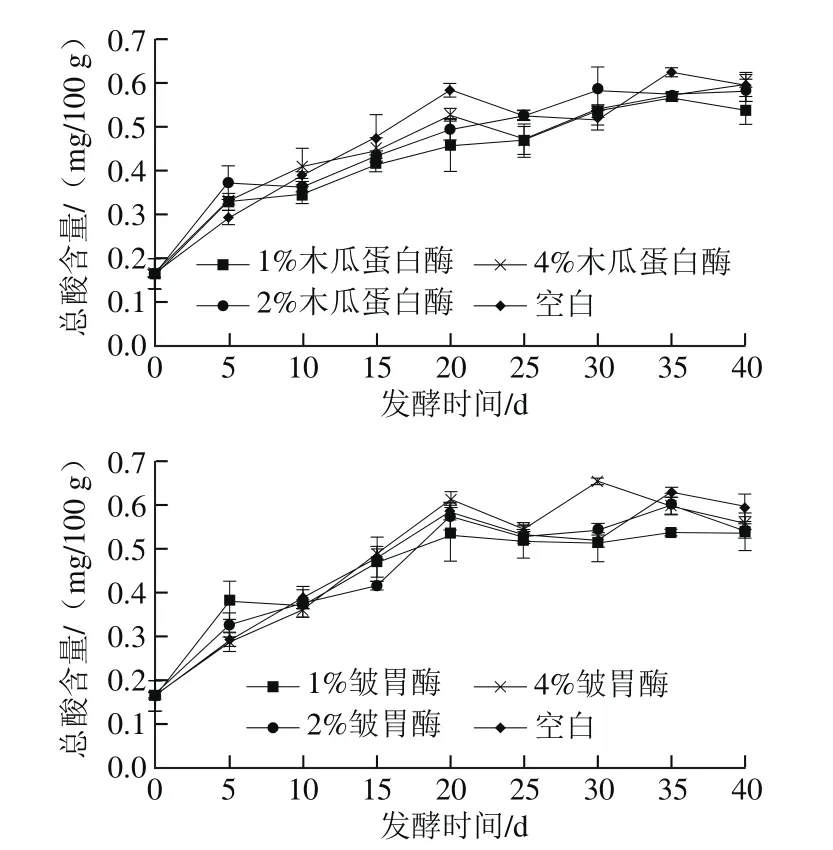
图3 不同添加量蛋白酶处理腐乳总酸含量在后发酵过程中的变化Fig. 3 Changes in total acid content during ripening of sufu with different concentrations of proteases
腐乳在后发酵过程中,总酸含量上升的主要原因为:汤料的灌入使得腐乳瓶中呈缺氧状态,产生乳酸,并且微生物大量分泌淀粉酶和脂肪酶,将腐乳中的碳水化合物和脂肪水解为有机酸和脂肪酸等物质,从而使得腐乳总酸含量上升。而后发酵过程中总酸含量的下降可能与酶促腐乳内部发生的酯化反应有关,能够消耗部分酸性化合物[15]。
2.4 发酵过程中样品氨基态氮的变化
由图4可看出,腐乳后发酵过程中氨基态氮的含量总体呈上升趋势,最后趋于平稳。根据SB/T 10170—2007[23],成品红腐乳的氨基态氮含量不小于0.42 mg/100 g即符合标准,空白组、木瓜蛋白酶和皱胃酶处理组均在第15天时达到标准要求。其中空白组中腐乳的氨基态氮的含量随着发酵的进行逐渐上升,前15 d氨基态氮含量迅速增长,15~20 d时增长缓慢后,又迅速上升,在第30天后逐渐趋于稳定达到0.55 mg/100 g。1%和2%木瓜蛋白酶处理组氨基态氮的含量变化与空白组无明显差异,4%木瓜蛋白酶处理组组的氨基态氮含量在整个后发酵过程中均明显高于空白组。2%和4%皱胃酶处理组氨基态氮的含量均高于空白组,其中1%皱胃酶处理组虽然在第10天前氨基态氮含量的上升速率明显高于空白组,但是之后基本与空白组保持一致。氨基态氮是指氨基酸形式的氮,其含量与氨基酸含量呈正比关系,因此氨基态氮的含量表明了氨基酸的含量和蛋白水解程度。结果表明,4%的木瓜蛋白酶和2%、4%的皱胃酶的添加促进了蛋白质的分解,能在一定程度上缩短腐乳生产周期。
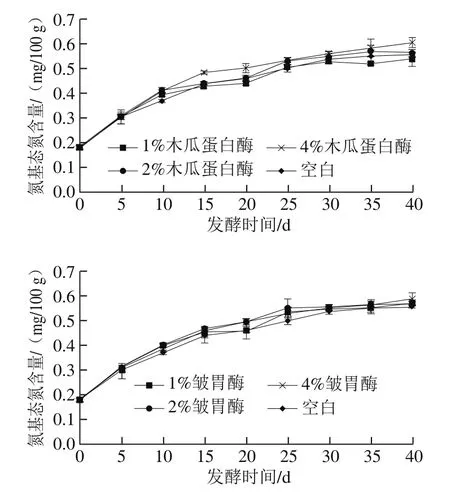
图4 不同添加量蛋白酶处理腐乳氨基态氮含量在后发酵过程中的变化Fig. 4 Changes in amino nitrogen content during ripening of sufu with different concentrations of proteases
2.5 发酵过程中样品硬度的变化
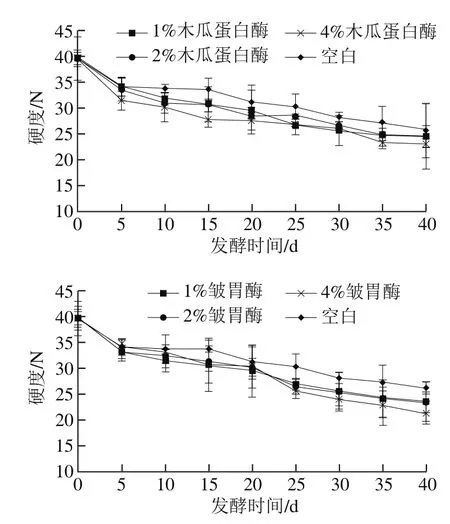
图5 不同添加量蛋白酶处理腐乳硬度在后发酵过程中的变化Fig. 5 Changes in hardness during ripening of sufu with different concentrations of proteases
由图5可看出,腐乳后发酵过程中硬度总体呈下降趋势,空白组0~5 d硬度迅速下降至34.11 N,之后5~15 d趋于稳定,最后随着后发酵的进行逐渐下降,最低达到26.04 N。1%、2%和4%木瓜蛋白酶处理组硬度下降速率均大于空白组,并且逐渐减小。其中1%和2%木瓜蛋白酶处理组硬度变化趋势基本一致,4%的硬度下降速率最快,在发酵结束第40天时硬度达到最小值(22.87 N),明显低于空白组。皱胃酶处理组中,各组的硬度下降速率也均大于空白组,其中4%皱胃酶处理组硬度下降速率在后发酵前20 d低于1%和2%,20 d至发酵结束期间,硬度快速下降,此时下降速率大于其他组。
腐乳的质构与腐乳的组成、结构和成熟度等密切相关,质构是评价腐乳品质的一项重要指标。利用质构指标评价腐乳质量可以避免因感官评价重现性不佳,主观判断带来的一些误差。其中硬度是指冲传样品时的压力最大值[29]。结果表明,随着各添加量木瓜蛋白酶和皱胃酶的加入,腐乳中的蛋白质在相关酶的作用下加速降解,导致硬度明显降低。其中4%木瓜蛋白酶和4%皱胃酶组对腐乳后发酵硬度的影响最为明显,因此,感官评价中分别选取4%的木瓜蛋白酶和皱胃酶作为实验组。
2.6 酶促腐乳感官评价
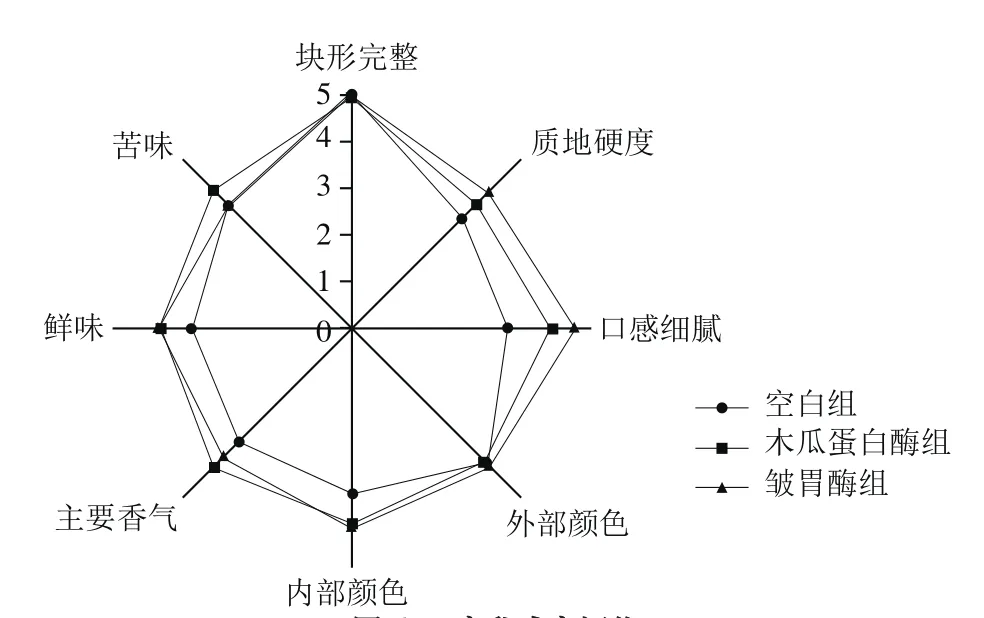
图6 腐乳感官评价Fig. 6 Sensory evaluation of sufu
由图6可知,添加蛋白酶组的块形完整度和外部颜色与空白组等均。空白组质地硬度得分为3.27 分,木瓜蛋白酶处理组和皱胃酶处理组的得分均高于空白组(分别为3.64 分和4.00 分)。并且木瓜蛋白酶组(4.18分)和皱胃酶(4.64 分)的口感得分均高于空白组(3.27 分)。以上说明添加外源蛋白酶降低了腐乳的质地硬度,这与质构分析的结果一致,并且改善了腐乳的口感细腻程度,其中皱胃酶处理组最为明显。郭艳等[30]研究结果表明,在腐乳灌装时加入风味蛋白酶,加酶组在后发酵14 d时已经具备了成熟腐乳的感官性状,而空白组腐乳则在40 d时达到要求。内部颜色、主要香气和鲜味方面,木瓜蛋白酶组与皱胃酶组得分等均,并且均高于空白组。说明添加外源蛋白酶都可以改善腐乳内部颜色,提高腐乳香气和鲜味。可能是外源蛋白酶分解腐乳中的蛋白质分解产生呈味氨基酸和挥发性香味物质的结果,并且腐乳表面毛坯层的分解也有利于汤料的渗入,可以改善腐乳内部颜色,促进腐乳成熟。木瓜蛋白酶处理组苦味得分高于空白组和皱胃酶组(均为3.64 分),可能与木瓜蛋白酶分解腐乳中蛋白质产生苦味氨基酸等有关[31]。
3 结 论
在腐乳后发酵过程中,外源蛋白酶添加组的pH值在第25天后均高于空白组,其中1%的皱胃酶组在第40天时pH值最高(6.57);外源蛋白酶的添加对腐乳的水分含量无明显影响;在腐乳后发酵过程中3 组腐乳的总酸含量均呈上升趋势,木瓜蛋白酶组在10~25 d总酸含量上升速率低于空白组,然后基本趋于一致;4%木瓜蛋白酶、2%和4%皱胃酶的添加使腐乳的氨基态氮含量增加;4%木瓜蛋白酶和4%皱胃酶的添加能够明显降低腐乳硬度;外源蛋白酶的添加能在一定程度上改善腐乳的口感和内部颜色,提供主要香气和鲜味;木瓜蛋白酶添加会产生一定的苦味。
参考文献:
[1] POYSA V, WOODRO L, YU K. Effect of soy protein subunit composition on tofu quality[J]. Food Research International, 2006,39(3): 309-317. DOI:10.1016/j.foodres.2005.08.003.
[2] FENG Z, HUANG S, AI Z W, et al. Evaluation of autochthonous micrococcus strains as starter cultures for the production of Kedong sufu[J]. Journal of Applied Microbiology, 2016, 120(3): 671-683.
[3] DENG J, WU H, ZHAO X, et al. Isolation and identification of Bacillus from spontaneous fermented sufu[J]. Advanced Materials Research, 2013, 634/635/636/637/638: 1179-1183. DOI:10.4028/www.scientific.net/AMR.634-638.1179.
[4] LIU Y, ZHOU Y, NIRASAWA S, et al. In vivo anti-fatigue activity of sufu with fortification of isoflavones[J]. Pharmacognosy Magazine,2014, 10(39): 367-373. DOI:10.4103/0973-1296.137380.
[5] 王越鹏, 胡峰, 汪建明, 等. 酶促腐乳生产过程中抗氧化的研究[J].食品与发酵科技, 2012, 48(5): 50-53. DOI:10.3969/j.issn.1674-506X.
[6] 凃婧, 李笑梅. 腐乳相关研究及开发进展[J]. 大豆科技, 2016(4): 39-44. DOI:10.3969/j.issn.1674-3547.
[7] 庄洋, 田盼盼, 单长海, 等. 腐乳的营养价值及其生理活性[J]. 湖北民族学院学报(自然科学版), 2016, 34(2): 179-183.
[8] 王越鹏, 胡峰, 汪建明, 等. 酶促腐乳工艺优化的研究[J]. 中国调味品, 2013, 38(5): 68-71. DOI:10.3969/j.issn.1000-9973.
[9] 朱立雄, 蔡欣. 腐乳毛霉培养条件及工艺探讨[J]. 中国酿造, 2014,33(10): 123-126. DOI:10.11882/j.issn.0254-5071.
[10] 李幼筠. 中国腐乳的现代研究[J]. 中国酿造, 2006, 25(1): 4-7.DOI:10.3969/j.issn.0254-5071.
[11] 余若黔, 涂煜, 李杰伟, 等. 腐乳培菌期的生化变化[J]. 华南理工大学学报(自然科学版), 2001, 29(4): 49-52. DOI:10.3321/j.issn:1000-565X.
[12] 龙菊, 吴拥军, 何映霞, 等. 高大毛霉腐乳发酵过程中主要成分的变化[J]. 食品研究与开发, 2012, 33(6): 170-173. DOI:10.3969/j.issn.1005-6521.
[13] HAN B Z, ROMBOUTS F M, NOUT M J A. Amino acid profiles of sufu, a Chinese fermented soybean food[J]. Journal of Food Composition & Analysis, 2004, 17(6): 689-698.
[14] FENG Z, CHEN H, LV X T, et al. Accelerated ripening of Kedong sufu with autochthonous starter cultures Kocuria rosea KDF3 and its protease KP3 as adjuncts[J]. Journal of Applied Microbiology, 2014,116(4): 877-889.
[15] 董爽, 陶杰, 汪建明, 等. 酶促腐乳不同发酵时期的微观品质变化研究[J]. 中国调味品, 2015, 5(1): 45-47. DOI:10.3969/j.issn.1000-9973.
[16] 张媛媛, 李立英, 汪建明. 酶促速熟过程中腐乳成分及微观结构的分析[J]. 天津科技大学学报, 2012, 27(1): 9-13. DOI:10.3969/j.issn.1672-6510.
[17] 曹瑞博. 酶促成熟腐乳及其品质的研究[D]. 天津: 天津科技大学,2010.
[18] 周鸿翔, 陈龙, 滕钰, 等. 酶促膏状腐乳酱中相关酶的作用研究[J].中国调味品, 2014, 26(7): 57-61. DOI:10.3969/j.issn.1000-9973.
[19] 任健, 杜国军, 栾广忠. 外源蛋白酶对白腐乳制备过程部分性质的影响[J]. 齐齐哈尔大学学报(自然科学版), 2010, 26(2): 64-67.DOI:10.3969/j.issn.1007-984X.
[20] 滕钰, 周鸿翔, 邱树毅, 等. 酶促红油腐乳后酵过程中化学组分动态变化的研究[J]. 食品科技, 2014, 39(5): 247-250.
[21] 刘会勇, 杨立苹, 刘瑞钦, 等. 缩短腐乳发酵周期的研究[J]. 中国调味品, 2003(1): 13-14. DOI:10.3969/j.issn.1000-9973.
[22] 何熙, 胡飞. 高压电场对毛霉蛋白酶活力的影响及应用于腐乳催熟[J]. 食品与生物技术学报, 2003, 22(4): 65-68. DOI:10.3321/j.issn:1673-1689.
[23] 孙君社, 鲁绯, 韩北忠, 等. 论腐乳的酶法生产[J]. 中国酿造, 2002,21(6): 7-9. DOI:10.3969/j.issn.0254-5071.
[24] 商务部. 腐乳: SB/T 10170—2007[S]. 北京: 中国标准出版社, 2007.
[25] 赵丽华, 靳烨, 马长伟, 等. 戊糖片球菌与复合发酵剂对羊肉干发酵香肠质地剖面分析(TPA)和色泽的影响[J]. 食品科技, 2009, 34(10):122-126.
[26] NAES H, HOLCK A L, AXELSSON L, et al. Accelerated ripening of dry fermented sausage by addition of a Lactobacillus, proteinase[J].International Journal of Food Science & Technology, 1994, 29(6): 651-659. DOI:10.1111/j.1365-2621.1994.tb02106.x.
[27] DIAZ O, FERNANDEZ M, GD G D F, et al. Proteolysis in dry fermented sausages: the effect of selected exogenous proteases[J].Meat Science, 1997, 46(1): 115-128.
[28] 董爽, 陶杰, 汪建明. 酶促腐乳生产过程中各种理化性质的变化研究[J]. 食品与发酵科技, 2014, 50(5): 23-26.
[29] 周荧, 潘思轶. 腐乳发酵过程中化学组分与质构的变化[J]. 食品科学, 2011, 32(1): 70-73.
[30] 郭艳, 周鸿翔, 邱树毅, 等. 酶促速熟腐乳发酵过程中成分变化的研究[J]. 食品科技, 2013, 38(5): 273-277.
[31] 梁洪波. 腐乳产蛋白酶菌株的筛选及多酶协同作用制备大豆多肽的研究[D]. 雅安: 四川农业大学, 2005.
