脓毒性休克患者早期容量复苏后血浆NT-proBNP水平变化及其意义
2018-04-20李峥谭小丽黄武军郭利洁韦武延符可胜陆湛李任文
李峥,谭小丽,黄武军,郭利洁,韦武延,符可胜,陆湛,李任文
(广西医科大学第十附属医院,广西钦州535000)
B型脑钠肽(BNP)、氨基末端B型脑钠肽前体(NT-proBNP)是主要由心室肌细胞合成和分泌的神经内分泌激素,被认为是诊断心功能不全及容量负荷的敏感指标[1]。近年来有研究发现BNP在评估脓毒症严重程度及预测病死率中具有独特的价值[2]。荟萃分析发现BNP可用于预测预后[3],但把其运用于脓毒性休克患者容量复苏中的研究极少。脉搏指示连续心排血量(PiCCO)监测技术被认为是血流动力学和容量评估的较为有效手段,但其为有创检查手段且费用贵,限制了其运用。本研究观察了脓毒性休克患者早期容量复苏后血浆NT-proBNP水平变化,并分析其与PiCCO监测的血流动力学指标和疾病严重程度的相关性,探讨NT-proBNP在感染性休克患者早期容量复苏中的评估价值。
1 资料与方法
1.1 临床资料 选择本院2015年1月~2016年10月收治的感染性休克[4]患者73例,男40例、女33例;平均年龄(55.7±17.2)岁;感染部位为软组织感染15例、重症肺炎25例、腹腔感染19例、泌尿系感染9例、胆管感染5例。入院时急性生理与慢性健康评分(APACHEⅡ评分)为(26.53±8.74)分。本研究经本院伦理委员会审批,获得患者及家属知情同意并签署同意书。
1.2 容量复苏方法 留置锁骨下中心静脉(双腔)和股动脉导管,应用德国Pulsion公司生产的第二代PiCCO监护仪(PiCCO2),对73例患者在PiCCO下给予早期目标指导性治疗(EGDT)。
1.3 血浆NT-proBNP、动脉血乳酸(Lac)检测 分别于复苏前和复苏后3、6、24、48 h在床边采用电化学发光法测定静脉血浆NT-proBNP和动脉血Lac。乳酸清除率(LCR)=(初始乳酸值-复测乳酸值)/初始乳酸值×100%。
1.4 血流动力学检测及疾病严重程度评价 记录复苏前和复苏后3、6、24、48 h的PiCCO2测得的平均动脉压(MAP)、心脏指数(CI)、全心舒张末期容积指数(GEDI)、胸腔内血容量指数(ITBI)、血管外肺水指数(EVLW)等血流动力学指标。分别于入院时、复苏后24、48、72 h进行APACHEⅡ评分评估疾病严重程度。

2 结果
2.1 容量复苏前后血浆NT-proBNP、动脉血Lac水平及血流动力学指标比较 与复苏前相比,复苏后3、6、24、48 h血浆NT-proBNP水平升高,动脉血Lac水平下降,MAP、CI、GEDI、ITBI、EVLW均升高(P均<0.01)。其中,复苏后48 h的MAP、CI高于复苏后24 h,复苏后48 h的血浆NT-proBNP水平高于复苏后3 h(P均<0.01)。详见表1。

表1 容量复苏前后血浆NT-proBNP、动脉血Lac水平及血流动力学指标
2.2 容量复苏前后血浆NT-proBNP水平与血流动力学指标及APACHEⅡ评分的相关性 复苏后3、6、24、48 h的血浆NT-proBNP水平与MAP、CI、GEDI、LCR呈正相关(P均<0.05),与Lac呈负相关(P<0.01);复苏后24 h的血浆NT-proBNP水平与ITBI呈正相关(P<0.01);复苏后48、72 h的血浆NT-proBNP水平与APACHEⅡ评分呈正相关(P<0.01)。详见表2。
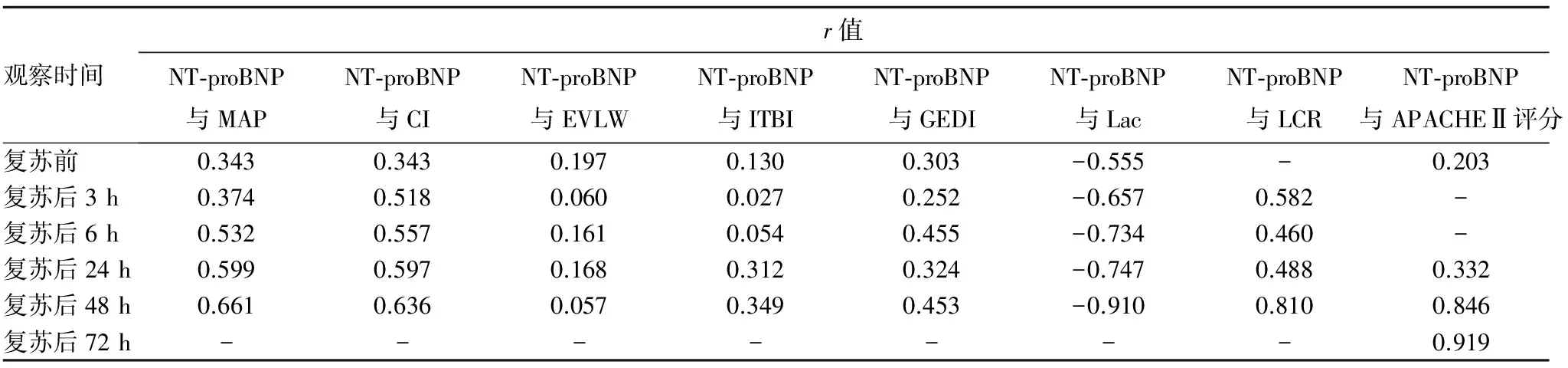
表2 复苏前后血浆NT-proBNP水平与血流动力学指标及APACHEⅡ评分的相关性系数
3 讨论
与其他类型休克的血流动力学变化不同,感染性休克患者由于毛细血管密度下降和未冲盈、毛细血管前括约肌舒张、动-静脉短路等出现体循环阻力下降、血流分布异常,导致急性有效循环血容量不足甚至循环衰竭,血Lac水平增高、氧代谢障碍。早期积极的容量复苏可减少器官功能衰竭,但过多液体复苏有可能影响血液成分,容易出现组织水肿(尤其是肺水肿)、氧合障碍、内环境紊乱、血液稀释、凝血功能异常等诸多不良反应[5],现已有学者提出限制性液体复苏[6,7]。
目前脓毒性休克治疗指南主要以中心静脉压(CVP)作为评价容量负荷及液体反应性的指标,但以压力负荷指标来指导容量负荷评估已越来越受到怀疑,因此,寻求精准的监测容量负荷的手段非常重要。曾被视作血流动力学监测金标准的Swan-Ganz导管因其操作难度大而难以在ICU推广。重症超声检查虽是一种快捷、无创的检查手段,但亦受操作者技术水平的影响。近年来一种新的血流动力学监测技术PiCCO运用于临床,PiCCO监测结合早期EGDT可有效指导容量复苏,缩短感染性休克患者呼吸机支持时间及住ICU时间,有利于减轻脓毒性休克患者的危重度[8]。
在心力衰竭患者中BNP或NT-proBNP与血流动力学指标的相关性已经证实[9],并写进心衰指南[10],但在感染性休克患者中BNP或NT-proBNP与血流动力学指标的相关性仍存在争议。与BNP相比,NT-proBNP性质更稳定,半衰期更长,血浆浓度高2~10倍[11,12],并且检测迅速,可在床边进行。有研究显示当心肌细胞受到刺激时,ProBNP分解为BNP和NT-proBNP,BNP具有扩张血管、排钠和利尿调节血压的生理作用,同时能够抑制交感-肾上腺素能系统以及肾素-血管紧张素-醛固酮系统神经内分泌调节活性,从而提高尿钠排泄并利尿,参与心血管稳态调节[12,13]。脓毒症患者存在高排低阻,心脏负荷增加,大量炎症因子(IL-1β、IL-6、IL-8、TNF-α和内皮素等)释放,心肌线粒体功能障碍、氧自由基的破坏损伤等,这些可能与血浆NT-proBNP水平增高有关[14~16]。研究[17]显示脓毒性心肌病与原发急性心功能不全发病导致BNP升高的机理有所不同。
本研究发现脓毒性休克患者血浆NT-proBNP水平普遍高于正常值,且随着容量复苏时间进程而升高,24 h后逐步下降,与MAP、CI、GEDI、LCR呈正相关,与Lac呈负相关,与复苏后24 h的ITBI呈正相关,与复苏后48 h的APACHEⅡ评分呈正相关,这与Yamanouchi等[18]的研究结果基本一致。因此,如果患者无心功能不全病史,那么早期NT-proBNP、Lac升高不像单纯急性心功能不全那样要限制补液,相反是容量复苏的指征。对此类患者补液的结果也不像原发性心功能不全会导致心输出量下降而加重病情,相反心输出量是增加的。随着容量复苏后时间延长,结合Lac下降、LCR升高,证实复苏有效,但也要注意复苏后48 h的NT-proBNP与疾病严重程度有关,如果NT-proBNP持续升高则提示预后不良,这与Papanikolaou等[2]的研究结果一致。
本组脓毒性休克患者经EGDT治疗后MAP、GEDV、ITBV、CI均明显升高,Lac下降,血浆NT-proBNP、LCR升高,而EVLW变化不明显。依据Frank -Starling曲线,容量复苏后循环血容量增加,受静脉回心血量和室壁顺应性增加影响,左心室舒张末期压增加,而心室容量和压力负荷增加会导致NT-proBNP过度释放[13],反映心脏容量状态和心功能的血流动力学指标GEDV、ITBV、CI均升高,且不受呼吸运动和心脏功能的影响。ITBV由肺血管容量、EVLW和GEDV组成,GEDV约占ITBV的4/5,因此ITBV、GEDV均可作为独立的心脏前负荷预测指标。PICCO检测可通过EVLW判断患者是否存在肺水肿。本研究中复苏前和复苏后3、6 h的EVLW无明显变化,提示在复苏早期EVLW不依赖于心脏容量负荷(ITBV和GEDV)增加而增加,也与NT-proBNP无关,可以从容补液,但EVLW在复苏后24、48 h有所上升,应警惕肺水肿的产生。
综上所述,脓毒性休克患者早期容量复苏后血浆NT-proBNP水平升高,且与血流动力学指标(MAP、CI、GEDI)、LCR及疾病严重程度有关,血浆NT-proBNP水平可能在早期容量复苏评估中有一定价值,其升高但Lac下降或LCR升高,血流动力学指标改善,说明容量复苏有效。
参考文献:
[1] Yamanouchi S, Kudo D, Endo T, et al. Blood N-terminal proBNP as a potential indicator of Cardiac preload in patients with high volume load[J]. Tohoku J Exp Med, 2010,221(3):175-180.
[2] Papanikolaou J, Makris D, Mpaka M, et al. New insights into the mechanisms involved in B-type natriuretic peptide elevation and its prognostic value in septic patients[J]. Crit Care, 2014,18(3):R94.
[3] Wang F, Wu Y, Tang L, et al. Brain natriuretic peptide for prediction of mortality in patients with sepsis: a systematic review and meta-analysis[J]. Crit Care, 2012,16(3):R74.
[4] Dellinger RP, Levy MM, Rhodes A, et al. The surviving sepsis campaign guidelines committee including the pediatric subgroup.surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med, 2013,41(2):580-637.
[5] White NJ, Wang X, Bradbury N, et al. Fluid resuscitation of uncontrolled hemorrhage using a hemoglobin-based oxygen carrier: Effect of traumatid brain injury[J]. Shock, 2013,39(2):210-219.
[6] 赵昕,徐凯智,张咏晖.限制性输液与充分液体复苏在感染性休克患者中的应用比较[J].中华医院感染学志,2014,24(2):411-413.
[7] 方晓华.限制性输液在感染中毒性休克麻醉中应用分析[J].心血管病防治知识:学术版,2013(7):77-79.
[8]谭小丽,李峥,刘丽秀,等.脉搏指示连续心排血量监测在脓毒性休克中的应用[J].中国医药导报,2016,13(22):172-175.
[9]叶宥文.心力衰竭患者血浆脑利钠肽水平与无创血流动力学监测的相关性[J].中国老年学杂志,2011,31(4):578-580.
[10]陈炜.急性心力衰竭的诊断和治疗指南解读:2012年更新版ESC急慢性心力衰竭诊断和治疗[J].中华危重病急救医学,2013,25(11):698-702.
[11] Hall C. Essential biochemistry and physiology of NT-proBNP[J]. Eur J Heart Fail, 2004,6(3):257-260.
[12]Woodard GE, Rosado JA. Recent advances in natriuretic peptide research[J]. J Cell Mol Med, 2007,11(6):1263-1271.
[13] Madamanchi C, Alhosaini h, Sumida A, et al. Obesity and natriuretic peptides, BNP and NT-proBNP: mechanisms and diagnostic implications for heart failure[J]. Int J Cardiol, 2014,176(3):611-617.
[14] 刘健,王洪霞,门昆.血清N末端脑钠肽前体水平与脓毒症预后的关系[J].中国危重病急救医学,2012,24(11):662-664.
[15] Turner KL, Moore LJ, Todd SR, et al. Identification of cardiac dysfunction in sepsis with B-type natriuretic peptide[J]. J Am Coll Surg, 2011,213(1):139-146.
[16] Chiba A, Watanabe-Takano H, Miyazaki T, et al. Cardiomyokines from the heart[DB/OL]. Cell Mol Life Sci, 2017.https://doi.org/10.1007/s00018-017-2723-6.
[17] Papanikolaou J, Makris D, Mpaka M, et al. New insights into the mechanisms involved in B-type natriuretic peptide elevation and its prognostic value in septic patients[J]. Crit Care, 2014,18(3):R94.
[18] Yamanouchi S, Kudo D, Endo T, et al. Blood N-terminal proBNP as a potential indicator of cardiac preload in patients with high volume load[J]. Tohoku J Exp Med, 2010,221(3):175-180.
