血清miR-26a、miR-122、AFP联合检测对肝癌的诊断效能
2018-04-20赵文淘韩留鑫夏加伟余向琼白彬沈丽达
赵文淘,韩留鑫,夏加伟,余向琼,白彬,沈丽达
(1昆明医科大学第三附属医院,云南省肿瘤医院,云南省癌症中心,昆明650118;2昆明市第三人民医院)
原发性肝癌起病隐匿、恶性程度高、早期诊断困难、预后差[1,2]。甲胎蛋白(AFP)作为一个重要的肝癌诊断标志物在临床上广泛应用,但其敏感度仅为39%~65%、特异度为76%~94%,诊断效率有限[3]。因此寻找高敏感度、高特异度的肝癌诊断标志物是临床亟待解决的难题。微小RNA(miRNAs)是一类长度约22个核苷酸序列的单链非编码小RNA,在肝脏中表达丰富,其通过调控特定的靶基因表达在新陈代谢、发育、凋亡、分化、病毒感染及肿瘤发生等过程中发挥重要作用[4]。miRNAs表达改变可能是肝炎、肝癌发生的关键机制[5,6]。现已经证实,外周血中的miRNAs可作为早期诊断肝癌的标志物[7]。miR-122是含量最丰富的肝脏特异miRNA,占肝脏miRNAs的70%[8],我们前期研究也发现miR-122可抑制肝癌的侵袭转移[6]。也有研究[9]报道,miR-26a参与了肝癌的发生及发展过程,在肝癌动物模型体内上调miR-26a表达后,癌结节可消退[10]。本研究观察了血清miR-26a、miR-122联合AFP检测在肝癌诊断中的应用价值,现报告如下。
1 资料与方法
1.1 临床资料 选取昆明医科大学第三附属医院(云南省肿瘤医院)2016年10月~2017年3月收治的新发肝癌患者114例(肝癌组),其中男100例、女14例;年龄(51.8±11.5)岁;乙型肝炎108例,丙型肝炎4例,无肝炎2例;所有患者均经穿刺活检或术后病理证实为原发性肝细胞癌,并未进行过针对性抗肿瘤治疗。另选新发肝炎患者87例(肝炎组),其中男61例、女26例;年龄(44.2±12.8)岁;所有患者均临床确诊为乙型肝炎(78例)或丙型肝炎(9例),且未经抗病毒治疗。随机选取同期来院做健康体检的健康人94例为对照组,其中男44例、女50例;年龄(40.2±10.2)岁;排除肿瘤、传染病等病史。抽取三组外周血,收集血清,置于-80 ℃冰箱备用。
1.2 血清miR-26a、miR-122检测 采用TRIzol试剂和RNA提取试剂盒提取血RNA[11]。用Nanodrop ND-1000检测仪检测RNA浓度。采用逆转录试剂盒将RNA逆转录为cDNA[12]。利用NCBI(https://www.ncbi.nlm.nih.gov/gene)数据库,确定基因序列。使用软件Primer premier5.0进行引物设计。以cel-miR-39为内参,上游引物序列为5′-GCGGTCACCGGGTGTAAATC-3′,下游引物序列为5′-GTGCAGGGTCCGAGGT-3′;miR-26a逆转录引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCA-
CTGGATACGACAGCCT-3′,其qPCR反应时的上游引物为5′-GACTGTTCAAGTAATCCAGGATA-3′,下游引物为5′-GTGCAGGGTCCGAGGTATTC-3′;miR-122上游引物序列为5′-GACTGTGGAGTGTGACAATGGTG-3′,下游引物序列为5′-GTGCAGGGTCCGAGGTATTC-3′。qPCR反应体系20 μL,包括cDNA 1.33 μL、2×Taqman PCR master mixture 10 μL、TaqMan MicroRNA Assay 1 μL、ddH2O 7.67 μL。用ABI7500型实时定量PCR仪进行qPCR反应,反应条件为95 ℃预变性10 min,然后95 ℃ 15 s、60 ℃ 1 min,进行40个循环反应。以cel-miR-39作为内参,采用公式[11]计算miRNA相对表达量,ΔCtmiRNA值越低代表miRNA的表达水平越高。
1.3 血清AFP检测 采用电化学发光法检测三组血清AFP。
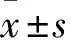
2 结果
肝癌组、肝炎组、对照组中miR-26a ΔCtmiRNA值分别为20.59±2.54、15.96±3.79、15.29±2.10,miR-122 ΔCtmiRNA值分别为8.35±2.90、11.48±3.06、13.79±2.84,AFP水平分别为(18 207.78±3 701.95)、(12.15±2.79)、(3.51±0.17)ng/mL。肝癌组miR-26a相对表达量低于肝炎组和对照组,AFP水平高于肝炎组和对照组,肝癌组、肝炎组、对照组miR-122相对表达量依次降低(P均<0.05)。
分析miR-26a、miR-122在肝癌诊断中的效能结果显示,miR-26a、miR-122均可作为鉴别肝癌患者和健康人的标志物:miR-26a单项检测AUC为0.738(95%CI为0.631~0.846),miR-122单项检测的AUC为0.828(95%CI为0.736~0.919)。miR-26a检测诊断临界值为18.26,敏感度和特异度分别为52.1%、94.3%;miR-122检测诊断临界值为10.63,敏感度和特异度分别为79.9%、84.8%。AFP单项检测AUC为0.801(95%CI为0.702~0.900),敏感度和特异度分别为59.2%、93.7%。miR-26a、miR-122、AFP联合检测AUC为0.926(95%CI为0.871~0.981),敏感度和特异度分别为86.4%、82.5%。三项指标联合检测对肝癌的诊断效能高于单一指标检测。
分析miR-26a、miR-122在肝癌和肝炎鉴别诊断中的效能结果显示,miR-26a单项检测AUC为0.752(95%CI为0.645~0.860),miR-122单项检测AUC为0.688(95%CI为0.571~0.806)。miR-26a检测诊断临界值为16.81,敏感度和特异度分别为73.9%、72.4%;miR-122检测诊断临界值为9.01,敏感度和特异度分别为78.2%、59.4%。AFP单项检测AUC为0.701(95%CI为0.587~0.816),敏感度和特异度分别为58.3%、92.6%。miR-26a、miR-122、AFP联合检测AUC提高到0.865(95%CI为0.781~0.949),敏感度和特异度分别为76.5%、85.1%。三项指标联合检测对肝癌和肝炎的鉴别诊断效能优于单项指标检测。
3 讨论
肝癌恶性程度高、起病隐匿,早期诊断并手术切除是延长患者生存期的关键,但多数通过影像学检查发现的肝癌已为晚期,失去手术机会。目前除了影像学诊断方法,实验室主要通过检测血清AFP来辅助诊断肝癌,但AFP的诊断效率有限,有近三分之一的早期肝癌被漏诊[13]。因此,急需寻找一种准确、便捷的诊断肝癌的血清学指标。
miRNAs调控着人类基因组中超过60%的基因表达,某个miRNA的表达变化能够影响着数百个靶基因表达,并显著改变了转录组基因的表达谱[14]。包括肿瘤在内的多种疾病的发生可能是miRNAs表达谱改变所导致的。研究表明,肝脏中的miRNAs通过凋亡、坏死等过程或通过外泌体分泌、病毒颗粒分泌等过程,释放入外周血中,并且miRNAs在外周血中的表达相当稳定[15],可以作为肝癌早期诊断标志物[7]。
miR-26a在肝癌中发挥着抑制肝癌细胞增殖和转移的功能[9]。Zhou等[16]研究显示,miR-26a在肝癌患者外周血中的表达低于健康对照者,外周血中miR-26与其他六个miRNAs(miR-122、miR-192、miR-21、miR-223、miR-27a、miR-801)的组合检测有助于诊断肝癌。Tan等[17]的研究也显示miR-26a在肝癌患者外周血中的表达低于健康对照者,外周血中miR-26a、miR-206、miR-141-3p、miR-433-3p、miR-1228-5p、miR-199a-5p、miR-122-5p、miR-192-5p联合检测也可用于肝癌的诊断。miR-122作为含量最丰富的肝脏特异miRNA,发挥着抑制肝癌细胞增殖和转移的功能[6]。多项研究[12,18~20]结果显示,miR-122在肝癌患者外周血中的表达高于健康对照者,将miR-122与其他miRNAs联合检测可用于肝癌的诊断。
在本研究中,我们检测了三组血清miR-26a、miR-122、AFP,并评价了三项指标检测在肝癌诊断中的应用价值。研究结果显示,肝癌组miR-26a相对表达量低于肝炎组和对照组,AFP水平高于肝炎组和对照组,肝癌组、肝炎组、对照组miR-122相对表达量依次降低。ROC曲线分析结果显示,miR-26a、miR-122、AFP单项检测诊断肝癌的AUC分别为0.738、0.828、0.801,三项指标联合检测的AUC提高到0.926,对肝癌的诊断效能明显提高。同时,我们还评价了miR-26a、miR-122、AFP单项与联合检测在肝癌和肝炎鉴别诊断中的价值,结果显示三项指标同样能将肝癌和肝炎患者进行鉴别,miR-26a、miR-122、AFP单项检测的AUC分别为0.752、0.688、0.701,三项指标联合检测的AUC则提高到0.865。以上研究结果说明,miR-26a、miR-122可以作为肝癌的诊断标志物,并且与AFP单独检测相比,miR-26a、miR-122、AFP联合检测对肝癌的诊断效率明显提高。上述研究结果与既往相关报道一致,且本研究只将两个指标与临床常用的AFP联合检测即达到较高的诊断效能,优化了诊断方法。本研究提供了一种准确、便捷的肝癌血清学诊断方法,但还需大样本的前瞻性研究来进一步验证。
参考文献:
[1] Crocetti L, Bargellini I, Cioni R. Loco-regional treatment of HCC: current status[J]. Clin Radiol, 2017,72(8):626-635.
[2] Wen Y, Han J, Chen J, et al. Plasma miRNAs as early biomarkers for detecting hepatocellular carcinoma[J]. Int J Cancer, 2015,137(7):1679-1690.
[3] Zinkin NT, Grall F, Bhaskar K, et al. Serum proteomics and biomarkers in hepatocellular carcinoma and chronic liver disease[J]. Clin Cancer Res, 2008,14(2):470-477.
[4] Li Y, Kowdley KV. MicroRNAs in common human diseases[J]. Genomics proteomics bioinformatics, 2012,10(5):246-253.
[5] Waidmann O, Bihrer V, Pleli T, et al. Serum microRNA-122 levels in different groups of patients with chronic hepatitis B virus infection[J]. J Viral Hepat, 2012,19(2):58-65.
[6] Wang SC, Lin XL, Li J, et al. MicroRNA-122 triggers mesenchymal-epithelial transition and suppresses hepatocellular carcinoma cell motility and invasion by targeting RhoA[J]. PLoS One, 2014,9(7):1-10.
[7] Shaker O, Alhelf M, Morcos G, et al. miRNA-101-1 and miRNA-221 expressions and their polymorphisms as biomarkers for early diagnosis of hepatocellular carcinoma[J]. Infect Genet Evol, 2017,51:173-181.
[8] Chang J, Guo JT, Jiang D, et al. Liver-specific microRNA miR-122 enhances the replication of hepatitis C virus in nonhepatic cells[J]. J Virol, 2008,82(16):8215-8223.
[9] Li Y, Ren M, Zhao Y, et al. MicroRNA-26a inhibits proliferation and metastasis of human hepatocellular carcinoma by regulating DNMT3B-MEG3 axis[J]. Oncol Rep, 2017,37(6):3527-3535.
[10] Kota J, Chivukula RR, O′Donnell KA, et al. Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model. Cell. 2009,12;137(6):1005-1017.
[11] Kroh EM, Parkin RK, Mitchell PS, et al. Analysis of circulating microRNA biomarkers in plasma and serum using quantitative reverse transcription-PCR(qRT-PCR)[J]. Methods, 2010,50(4):298-301.
[12] Qi P, Cheng SQ, Wang H, et al. Serum microRNAs as biomarkers for hepatocellular carcinoma in Chinese patients with chronic hepatitis B virus infection[J]. PLoS One, 2011,6(12):1-8.
[13] Simpson HN, McGuire BM. Screening and detection of hepatocellular carcinoma[J]. Clin Liver Dis, 2015,19(2):295-307.
[14] Kerr TA, Korenblat KM, Davidson NO, et al. MicroRNAs and liver disease[J]. Transl Res, 2011,157(4):241-252.
[15] Cortez MA, Bueso-Ramos C, Ferdin J, et al. MicroRNAs in body fluids-the mix of hormones and biomarkers[J]. Nat Rev Clin Oncol, 2011,8(8):467-477.
[16] Zhou J, Yu L, Gao X, et al. Plasma microRNA panel to diagnose hepatitis B virus-related hepatocellular carcinoma[J]. J Clin Oncol, 2011,29(36):4781-4788.
[17] Tan Y, Ge G, Pan T, et al. A serum microRNA panel as potential biomarkers for hepatocellular carcinoma related with hepatitis B virus[J]. PLoS One, 2014,19,9(9):1-12.
[18] Li LM, Hu ZB, Zhou ZX, et al. Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma[J]. Cancer Res, 2010,70(23):9798-9807.
[19] Xing TJ, Jiang DF, Huang JX, et al. Expression and clinical significance of miR-122 and miR-29 in hepatitis B virus-related liver disease[J]. Genet Mol Res, 2014,13(3):7912-7918.
[20] Xu J, Wu C, Che X, et al. Circulating microRNAs, miR-21, miR-122, and miR-223, in patients with hepatocellular carcinoma or chronic hepatitis[J]. Mol Carcinog, 2011,50(2):136-142.
