上皮性卵巢癌组织中Nanog、FOXD3 mRNA及蛋白的表达变化
2018-04-20臧星卉李红雨孙玮鱼志琪刘端李玉光
臧星卉,李红雨,孙玮,鱼志琪,刘端,李玉光
(郑州大学第三附属医院,郑州450052)
卵巢癌最常见的类型是上皮性卵巢癌。上皮性卵巢癌病死率较高,在过去25年间总生存期改善较小[1]。因此,探究上皮性卵巢癌发生、发展、侵袭、转移的相关机制有着重要意义。胚胎干细胞关键因子(Nanog)表达于全能或多能干细胞中,是维持胚胎干细胞自我增殖和多向分化潜能的关键性转录因子。有学者推测Nanog与肿瘤发病有关[2,3]。Nanog通过调控肿瘤干细胞、细胞分化、上皮间质转化(EMT)、化疗耐药及免疫耐受等多种机制参与肿瘤发生发展的多个环节[4]。FOX指叉头框转录因子家族,主要在干细胞中表达,发挥调控胚胎干细胞亚全能性与增殖分化的作用。研究发现,FOX基因通过EMT介导肿瘤干细胞的形成过程、维持肿瘤干细胞的特性及肿瘤耐药[5]。FOXD3是FOX家族的一员。研究[6]报道,FOXD3可通过调节相关蛋白(如E-钙黏蛋白、N-钙黏蛋白、层黏连蛋白等)的表达而诱导EMT,从而赋予细胞迁移能力。目前对FOXD3基因的研究甚少,其表达调控机制尚不清楚。本研究观察了上皮性卵巢癌组织中Nanog、FOXD3 mRNA及蛋白的表达变化,并探讨其临床意义。
1 材料与方法
1.1 标本来源 2015年1月~2017年3月于郑州大学第三附属医院手术留取的上皮性卵巢癌组织40例份(恶性组),良性卵巢上皮性肿瘤组织26例份(良性组),正常卵巢组织25例份(对照组)。恶性组标本来源患者年龄13~75岁;浆液性囊腺癌27例、黏液性囊腺癌5例、子宫内膜样癌6例、透明细胞癌2例;FIGO分期Ⅰ期11例、Ⅱ期5例、Ⅲ期18例、Ⅳ期6例;低分化23例、中等分化10例、高分化7例;行淋巴结清扫共23例,有转移11例、无转移12例;所有患者术前均未接受放疗、化疗、激素及免疫治疗,除外其他转移性癌。良性组标本来源患者年龄9~63岁;浆液性囊腺瘤和黏液性囊腺瘤各13例。对照组标本来源患者包括子宫内膜癌12例、宫颈癌8例、其他病变5例,经病理证实为正常卵巢组织。各组均留两份标本待测。
1.2 Nanog、FOXD3 mRNA检测 采用qRT-PCR法。将三种组织在液氮中磨碎,每80~100 mg组织加入1 mL的RNA提取液,总RNA被提取后,用紫外分光光度计分别测定纯度及浓度。提取1 μg总RNA,按逆转录试剂盒说明书将其逆转录成cDNA,逆转录反应体系为25 μL,反应条件为37 ℃孵育1 h。取cDNA 2μL进行PCR反应,总反应体系为20 μL。反应条件为95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,共40个循环。目的基因的相对表达量用2-ΔΔCt表示。
1.3 Nanog、FOXD3蛋白检测 采用免疫组化SP法。取三组石蜡标本做4 μm厚切片,脱蜡、水化,高温抗原修复,血清修复,加一抗,然后加二抗,DAB染色,苏木紫复染,脱水,透明,最终封片。以PBS代替一抗作为阴性对照,用已知阳性组织切片作为阳性对照。采用半定量计数法进行结果判定。于高倍镜(400×)视野下随机地选择5个视野(每个视野细胞数目不少于100个)。根据细胞着色强度计分,无色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;根据阳性细胞百分比计分,0计0分,<25%计1分,25%~<50%计2分,50%~<75%计3分,75%~100%计4分;上述两项得分相乘,0~1为蛋白表达阴性,≥2为蛋白表达阳性。

2 结果
2.1 三组Nanog、FOXD3 mRNA表达比较 对照组、良性组、恶性组Nanog mRNA相对表达量分别为0.827±0.243、1.009±0.747、3.266±1.413,FOXD3 mRNA相对表达量分别为0.571±0.266、0.976±0.369、1.457±0.496。恶性组Nanog、FOXD3 mRNA相对表达量高于良性组及对照组,且良性组FOXD3 mRNA相对表达量高于对照组(P均<0.05)。
2.2 三组Nanog、FOXD3蛋白表达比较 Nanog及FOXD3主要表达于卵巢上皮组织细胞质内,呈棕黄色、颗粒状分布。上皮性卵巢癌组织中Nanog、FOXD3蛋白均呈强表达,卵巢正常组织和良性卵巢上皮性肿瘤中Nanog、FOXD3蛋白呈弱表达甚至不表达。对照组、良性组、恶性组Nanog蛋白阳性表达率分别为24.0%、34.6%、80.0%,FOXD3蛋白阳性表达率分别为20.0%、65.0%、87.5%。恶性组Nanog、FOXD3蛋白阳性表达率高于良性组及对照组,且良性组FOXD3蛋白阳性表达率高于对照组(P均<0.05)。
2.3 Nanog、FOXD3蛋白表达与上皮性卵巢癌临床病理参数的关系 Nanog蛋白表达与上皮性卵巢癌患者年龄、肿瘤组织学类型、淋巴结转移无关(P均>0.05),而与临床分期、分化程度有关,其中Ⅲ、Ⅳ期组织中Nanog蛋白表达高于Ⅰ、Ⅱ期组织,低分化组织中Nanog蛋白表达高于中、高分化组织(P均<0.05)。FOXD3蛋白表达与上皮性卵巢癌患者的年龄、肿瘤组织学类型、临床分期、分化程度及淋巴结转移等无关(P均>0.05)。详见表1。
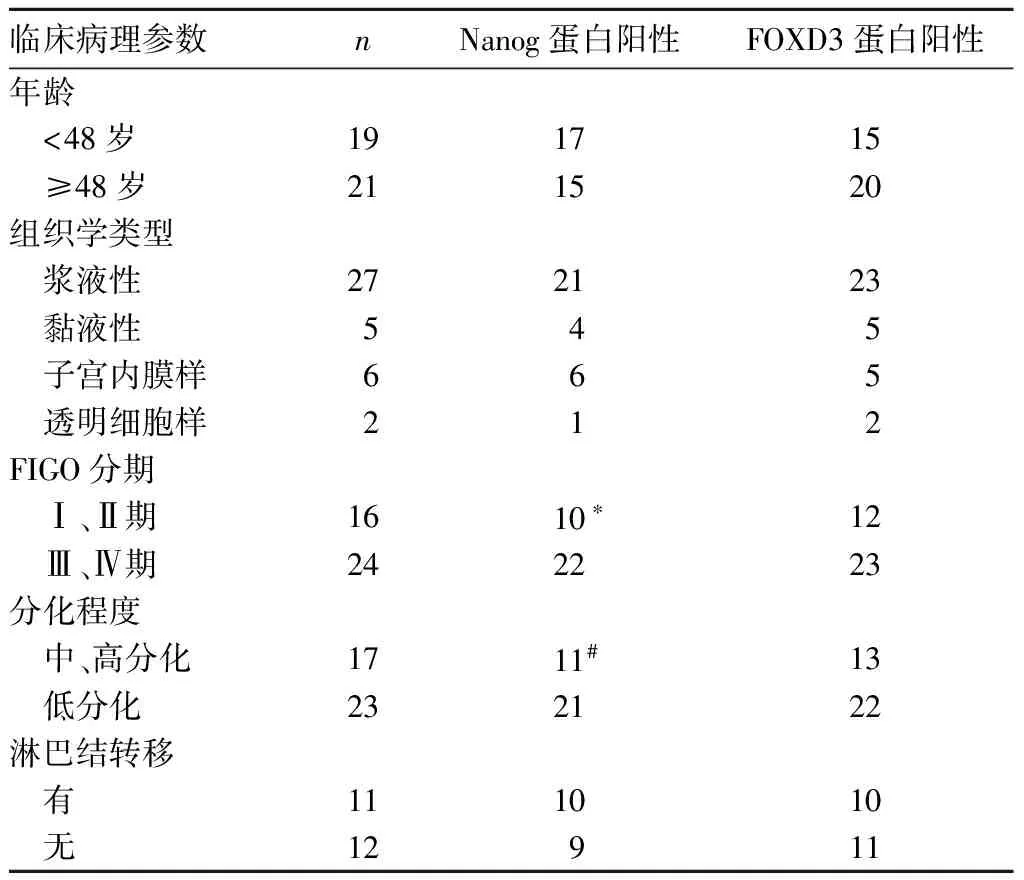
表1 Nanog、FOXD3蛋白阳性表达与上皮性卵巢癌临床病理参数的关系(例)
注:与Ⅲ、Ⅳ期组织相比,*P<0.05;与低分化组织相比,#P<0.05。
2.4 上皮性卵巢癌组织中Nanog、FOXD3蛋白表达的相关性 Spearman相关分析结果显示,上皮性卵巢癌组织中Nanog、FOXD3蛋白表达呈正相关(r=0.652,P<0.01)。
3 讨论
文献[7]报道Nanog能作用于下游基因E-钙黏蛋白和叉头框转录因子J1(FOXJ1),通过抑制二者的表达促进卵巢癌细胞侵袭、转移;在术后经联合化疗的卵巢癌患者中,Nanog核内表达的增高与耐药性产生及患者低生存率相关。黄清梅等[8]发现随Nanog基因表达增强,胃癌细胞株对顺铂的敏感性减弱。Wang等[9]提出Nanog高表达提示乳腺癌患者预后不良。本研究结果显示,Nanog基因及蛋白在恶性组中的表达明显高于良性组及对照组,提示Nanog可能促进细胞增殖分化,参与了上皮性卵巢癌的形成。其次,Nanog蛋白表达与上皮性卵巢癌临床分期及分化程度有关,期别越晚、分化程度越低则蛋白阳性表达越高,提示Nanog可能在上皮性卵巢癌的进展中占重要地位,其高表达可能提示患者预后不良,或许能通过干扰Nanog的表达抑制肿瘤进展。本研究发现,良性卵巢上皮肿瘤及正常卵巢组织中Nanog均呈低表达或不表达,提示Nanog有望成为上皮性卵巢癌的检测标志物和治疗靶点,从而为卵巢癌的诊断、治疗提供新的思路。
Chu等[10]研究显示FOXD3可通过诱导EMT而促进乳腺癌发病及肿瘤淋巴结转移。Chen等[11]发现FOXD3在脑胶质瘤中高表达,且表达水平与患者的预后呈负相关。本研究中,恶性组FOXD3基因及蛋白的表达高于良性组及对照组,且良性组FOXD3基因及蛋白的表达高于对照组,提示其可能发挥促癌基因的作用,推测其可能通过介导EMT促进细胞增殖及卵巢癌的发生。我们同时发现,FOXD3蛋白的表达与患者年龄、组织学类型、临床分期、分化程度、淋巴结转移均无关。然而,FOXD3也被报道在神经源性肿瘤中可通过抑制肿瘤增殖、侵袭、迁移、新生血管形成等一系列作用从而充当抑癌基因的角色[12]。Li等[13]报道在结直肠癌肿瘤中,FOXD3可抑制肿瘤细胞体外侵袭和肺转移能力。可见,FOXD3在人体不同肿瘤组织中的作用不尽相同。目前针对FOXD3在卵巢肿瘤组织中的表达与临床意义的相关研究较少,因此,FOXD3在卵巢癌发生、发展、浸润、迁移、耐药等过程中的作用及其机制仍有待继续探究。
Nanog和FOXD3作为参与胚胎干细胞自我更新的转录因子,既维持了胚胎干细胞的多能性,在胚胎早期发育中发挥重要作用,也与多种肿瘤息息相关,两者关系密切而又复杂。有研究称FOXD3可与Nanog启动子连接,激活Nanog表达,并通过正反馈增加二者的表达[14]。也有研究提出FOXD3是Nanog的核心下游靶基因[15]。本研究发现,在上皮性卵巢癌中,Nanog和FOXD3的表达呈正相关,提示在上皮性卵巢癌的发生发展过程中,Nanog与FOXD3可能存在协同作用,具体机制尚待明确。
综上所述,上皮性卵巢癌组织中Nanog、FOXD3 mRNA及蛋白表达增高,Nanog、FOXD3可能参与了上皮性卵巢癌的发生、发展,且二者之间可能存在协同作用。然而本研究样本量有限,且未将腹水和腹腔冲洗液中是否存在肿瘤细胞的因素考虑在内,后续研究还需尽可能扩大样本量并完善分组。
参考文献:
[1] Lowe KA, Chia VM, Taylor A, et al. An international assessment of ovarian cancer incidence and mortality[J]. Gynecol Oncol, 2013,130(1):107-114.
[2] Borrull A, Ghislin S, Deshayes F, et al. Nanog and Oct4 overexpression increases motility and transmigration of melanoma cells[J]. J Cancer Res Clin Oncol, 2012,138(7):1145-1154.
[3] Jeter CR, Yang T, Wang J, et al. Concise review: NANOG in cancer stem cells and tumor development: an update and outstanding questions[J]. Stem Cells, 2015,33(8):2381-2390.
[4] Iv Santaliz-Ruiz LE, Xie X, Old M, et al. Emerging role of nanog in tumorigenesis and cancer stem cells[J]. Int J Cancer, 2014,135(12):2741-2748.
[5] Benayoun BA, Caburet S, Veitia RA. Forkhead transcription factors: key players in health and disease[J]. Trends Genet, 2011,27(6):224-232.
[6] Arduini BL, Brivanlou AH. Modulation of FOXD3 activity in human embryonic stem cells directs pluripotency and paraxial mesoderm fates[J]. Stem Cells, 2012,30(10):2188-2198.
[7] Siu MK, Wong ES, Kong DS, et al. Stem cell transcription factor NANOG controls cell migration and invasion via dysregulation of E-cadherin and FoxJ1 and contributes to adverse clinical outcome in ovarian cancers[J]. Oncogene, 2013,32(30):3500-3509.
[8] 黄清梅,杜小波.食管癌相关标志物研究进展[J].华西医学,2017,32(10):1620-1623.
[9] Wang D, Lu P, Zhang H, et al. Oct-4 and Nanog promote the epithelial-mesenchymal transition of breast cancer stem cells and are associated with poor prognosis in breast cancer patients[J]. Oncotarget, 2014,5(21):10803-10815.
[10] Chu TL, Zhao HM, Tian J, et al. FOXD3 feficiency promotes breast cancer progression by induction of epithelial-mesenchymal transition[J]. Biochem Biophys Res Commum, 2014,446(2):580-584.
[11] Chen ZH, Hu HK, Zhang CR, et al. Down-regulation of long non-coding RNA FOXD3 antisense RNA 1 (FOXD3-AS1) inhibits cell proliferation, migration, and invasion in malignant glioma cells[J]. Am J Transl Res, 2016,8(10):4106-4119.
[12] Fairchild CL, Conway JP, Schiffmacher AT, et al. FOXD3 regulates cranial neural crest EMT via downregulation of tetraspanin 18 independent of its functions during neural crest formation[J]. Mech Dev, 2014,132:1-12.
[13] Li K, Guo QF, Yang J, et al. FOXD3 is a tumor suppressor of colon cancer by inhibiting EGFR-Ras-Raf-MEK-ERK signal pathway[J]. Oncotarget, 2017,8(3):5048-5056.
[14] Pan GJ, Li J, Zhou YL, et al. A negative feedback loop of transcription factors that controls stecell pluripotency and self- renewal[J]. FASEB J, 2006,20(10):1730-1732.
[15] Loh YH, Wu Q, Chew JL, et al. The Oct4 and Nanog transcription network regulates pluripotency in mouse embryonic stem cells[J]. Nat Genet, 2006,38(4):431-440.
