急性心肌梗死血浆标志代谢物及相关代谢通路的筛选
2018-04-20许文轩李彤张磊连烁稂与恒胡晓旻高文卿宁萌
许文轩,李彤,张磊,连烁,稂与恒,胡晓旻,高文卿,宁萌
(1天津医科大学三中心临床学院,天津300000;2天津市第三中心医院;3天津市人工细胞重点实验室,卫生部人工细胞工程技术研究中心)
急性心肌梗死(AMI)是一种常见的心血管急症,发病率呈逐渐升高趋势[1],早期发现和治疗对改善AMI患者预后、降低病死率至关重要[2]。经皮冠状动脉介入(PCI)术为经心导管技术疏通狭窄甚至闭塞的冠状动脉从而改善心肌灌注的治疗方法。但患者在经PCI治疗后,仍有部分指标改变不明显。同时,心肌梗死后并发症也严重威胁着患者的生命。代谢组学能够在特定的环境和时间条件下,定量检测生物体内代谢物水平并分析其变化趋势。本研究借助代谢组学方法,对PCI治疗的AMI患者血浆代谢轮廓进行分析,筛选与AMI疾病过程高度相关的特征代谢物,以便进一步认识AMI的发生发展机制,探讨特征代谢物的临床应用价值。
1 资料与方法
1.1 临床资料 选择2015年12月~2016年7月于天津市第三中心医院住院并施行PCI术的AMI患者。所有入选患者必须至少符合以下3条标准中的2条:①缺血性胸痛病史;②心电图动态演变;③AMI相关血清心肌标志物动态改变。排除心绞痛、主动脉夹层、急性心包炎、急性肺动脉栓塞、心肌炎及心肌病等;排除其他非冠状动脉粥样硬化造成的AMI;排除合并糖尿病、脂肪肝、肝硬化等对代谢造成较大影响的疾病及其他肝肾疾病者。本研究共选入AMI患者25例,男13例、女12例,年龄(65±15)岁,设为病例组。分别于PCI术前和术后1 d采集患者的血液标本。选择在天津市第三中心医院体检中心体检的健康志愿者26例纳入对照组,其中男14例、女12例,年龄(67±13)岁。两组一般资料比较见表1。两组血液标本采集后经2 500 g离心,取血浆分装,并于-80 ℃保存。本研究经天津市第三中心医院伦理委员会批准,所有血液标本的采集和临床资料收集均获得受检者本人知情同意。

表1 病例组与对照组血浆TG、CHO、LDL、HDL、Hs-CRP、BNP CK CK-MB水平比较
注:与对照组相比,*P<0.05;与同组术后相比,#P<0.05。
1.2 血浆样本处理及总离子色谱、质谱分析 取两组解冻后的血浆标本200 μL,与600 μL甲醇溶液混合,于4 ℃静置10 min。然后于4 ℃、10 000 g下离心30 min,提取上清液,经真空离心蒸干得到干粉。然后以200 μL的5%甲酸乙腈溶液重溶,经0.22 μm孔径滤膜过滤后即得到待测样品。采用基于超高效液相色谱与超高分辨生物质谱联用(UPLC-MS)平台进行血浆总离子色谱、质谱分析。参照张立等[3]方法,进入Accela超高效液相色谱系统分析。采用二元溶剂梯度洗脱方式。流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈混合溶液。色谱洗脱过程15 min,进液量10 μL,流动相流速为200 μL/min,自动进样器温度为4 ℃,柱温20 ℃。起始梯度为5%流动相B,持续2.5 min,至8.5 min线性增至95%,维持3 min后降回5%,维持2.5 min以平衡色谱柱。质谱系统为LTQ Orbitrap XL系统。选取正离子扫描模式。离子源电压4.5 kV、锥孔电压150 V、毛细管电压30 V、去溶剂化温度275 ℃、鞘气流速30 arb(99.999%氮气)、辅气流速5 arb(99.999%氮气)。数据采集贯穿色谱洗脱过程,采集范围为质核比(m/z)50~1 000、质谱分辨率为100 000(FWHM全峰高半峰宽分辨率)。二级质谱检测采用碰撞诱导解离模式(CID),能量设定为35(标准化碰撞能量),碰撞气体为99.999%高纯氦气。
1.3 血浆代谢轮廓分析 将由UPLC-MS平台得到的数据导入MZmine2.0系统进行数据前处理[4]。规则为提取离子色谱峰强度信噪比S/N>30、保留时间(RT)偏移不超过±0.1 min、m/z偏差不超过±0.02。按照如上规则对离子色谱峰进行识别、匹配及归一化处理。将得到的数据导入SIMCA-P+12.0.1.0系统进行数据分析[5]。通过模式识别,构建得到主成分分析(PCA)及正交偏最小二乘判别(OPLS-DA)模型。
1.4 血浆标志代谢物及相关代谢通路筛选 根据离子对模型的贡献度及置信区间,初步筛选潜在标志代谢离子。然后利用SPSS22.0软件对所得变量进行配对样本非参数检验。将部分特征性代谢离子通过与标准品的色谱峰、质谱峰进行比对得到鉴定结果。无标准品可供对比的特征性代谢离子参照文献[6]方法进行鉴定:①将特征代谢离子的精确m/z值输入HMDB(http://hmdb.ca/)数据库,按照m/z偏差不超过0.01的原则、准确电荷数及与实验条件相符的电离方式对筛查结果进行校验,保留相符的鉴定结果;②特征离子经MS/MS扫描,将二级质谱图与Mass Frontier6.0软件自带数据库模拟的鉴定结果相比对,以比对偏差不超过20%为准。将筛选鉴定出的标志代谢物输入MetaboAnalyst3.0数据库,进行代谢通路分析。
2 结果
2.1 病例组与对照组血浆总离子流图 采用UPLS-MS平台获取了病例组PCI手术前后及对照组的血浆总离子流图(图1)。由图1中可看出,病例组术前、术后及对照组的色谱峰分布存在差异。根据前述数据处理方法,通过MZmine2.0软件从76份样本中共提取出384种代谢物离子及对应的色谱峰积分面积值。将所得数据导入SIMCA-P+12.0.1.0系统进行数据分析。

图1 病例组与对照组血浆样本总离子流图
2.2 血浆代谢轮廓分析模型 经SIMCA-P+12.0.1.0系统分析,得到PCA模型(R2X=42.8%,Q2=9.99%),共计6个主成分,见图2。由图中可看出,病例组手术前后和对照组的血浆成分有一定聚类趋势。虽然趋势并不十分明显,但可以说明AMI是这一趋势的主要影响因素。同时构建了OPLS-DA模型(R2X=68.6%,R2Y=88.1%,Q2=65.7%),见图3。各组间有明显的聚类区分趋势。其中Y轴方向上的趋势变化反映了AMI患者PCI术后代谢轮廓转向正常方向,说明AMI患者施行PCI手术是造成这一聚类趋势的最主要因素。

图2 病例组PCI手术前后血浆样本PCA模型

图3 病例组PCI手术前后血浆样本OPLS-DA模型
2.3 血浆标志代谢物筛选结果 提取OPLS-DA模型评分VIP值大于1且可信区间不包含0的变量。将病例组术前与对照组数据进行非参数检验,共筛选出有统计学差异的代谢物8种,即溶血磷脂酰胆碱(LysoPC)类物质[18∶2(9Z,12Z)]、LysoPC(16∶0) 、LysoPC(18∶0)、LysoPC(P-16∶0),溶血磷脂酸(LPA)类物质[0∶0/18∶1(9Z)]、孕烷三醇(Pregnanetriol)、N-软脂酰基鞘氨醇(N-Palmitoylsphingosine),神经酰胺类物质Cer(d18∶0/16∶0),具体见表2。比较病例组手术前后上述8种特征性代谢物水平,发现LysoPC[18∶2(9Z,12Z)]、LysoPC(16∶0)、Pregnanetriol、LysoPC(P-16∶0)、N-Palmitoylsphingosine水平在患者PCI术后有所恢复。
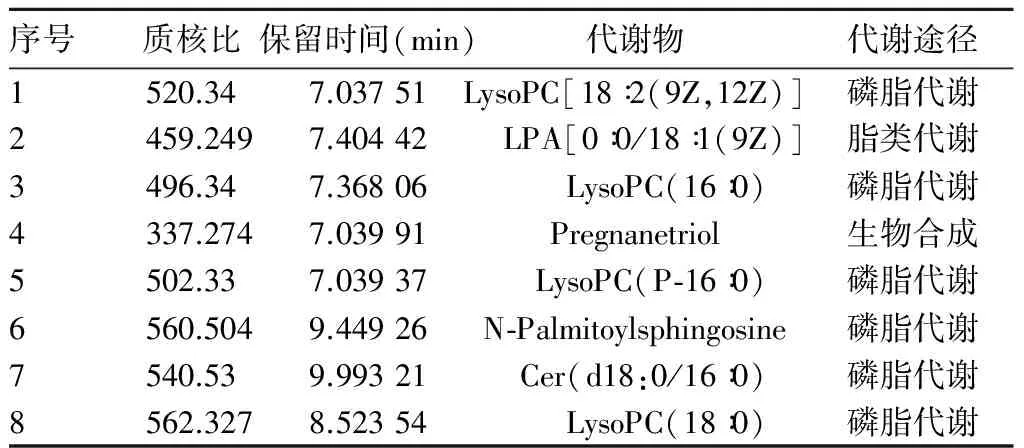
表2 AMI患者特征代谢物鉴定结果
2.4 代谢物相关代谢通路分析 根据病例组术前与对照组的差异性代谢物,共筛查出与AMI相关的两条代谢通路,为甘油磷脂代谢通路和甘油脂类代谢通路,其中甘油磷脂代谢通路差异性更为明显。通过比对两条代谢通路发现,在两条代谢通路中存在一个共有的受到AMI影响的代谢物,即磷脂酸类物质1,2-diacyl-sn-glycerol-3-phosphate。
3 讨论
本研究利用代谢组学研究平台及相关分析方法对AMI特征性代谢物进行了研究。研究对象主要为施行PCI的AMI患者。通过分析患者手术前后血浆代谢轮廓变化以及相关代谢产物恢复情况,寻找与AMI高度相关的代谢信息,并根据患者手术前后相关代谢物的恢复情况,对于术后的干预性治疗提供参考。
本研究利用UPLC-MS平台对血浆样本进行了分析,构建了以模式识别技术为基础的代谢轮廓聚类区分模型。由OPLS-DA模型的聚类区分趋势可看出,AMI是造成这一趋势的最主要原因。而且随着冠状动脉的再度开通,患者的血浆代谢轮廓与术前有明显差异,并向对照组趋近,但仍与对照组存在一定差异。凭借代谢轮廓模型,可直观地得到AMI患者PCI手术前后机体内小分子内源性物质的变化态势,继而分析相关代谢通路,对患者术后的干预性治疗提供建议,为临床诊疗提供新思路。
本研究筛选和鉴定出的特征性代谢物所涉及的代谢过程主要包括磷脂代谢、脂肪酸代谢及激素合成等。我们发现,AMI患者PCI术前血浆多种溶血磷脂酰胆碱水平与对照组有明显差异,其中LysoPC[18∶2(9Z,12Z)]、LysoPC(P-16∶0)升高,可能与心肌细胞坏死、细胞膜崩解后大量入血有一定关系。LysoPC水平升高对机体危害巨大。相关研究发现,LysoPC参与多种机体内生理生化反应过程,其中包括血管内皮损伤与炎症反应,并导致血管硬化[7]。同时,LysoPC在体内大量贮存会引起心肌细胞电生理紊乱,引发心律失常,影响心肌收缩功能[8]。临床表现为AMI患者患病期间伴随不同程度的心电生理信号紊乱,甚至发生室速或室颤等危急症状。本研究结果显示,LysoPC[18∶2(9Z,12Z)]和LysoPC(P-16∶0)由于AMI的影响表现出一定的升高趋势,随着PCI手术的实施,上述两种特征性代谢产物恢复至与对照组相近的水平,或有一定恢复趋势。
另外,LysoPC(16∶0)、LysoPC(18∶0)呈现出下降趋势,同时发现,磷脂酸类物质LPA[0∶0/18∶1(9Z)]亦在AMI患者术前组呈下降趋势,这一变化应该与磷脂酸类物质引起的细胞外钙离子内流动员效应有关[9],同时也提示心肌收缩力下降[10]。随着冠状动脉的再度开通,LysoPC(16∶0)恢复至与对照组相近的水平,然而LysoPC(18∶0)和LPA[0∶0/18∶1(9Z)]仍然保持在与术前相近的低水平,此现象提醒临床医师及研究者应高度重视此两种代谢产物的变化,可给予相关治疗,改善患者预后。
神经酰胺(N-软脂酰基鞘氨醇)是重要的信号转导代谢产物。神经酰胺已被证实参与多种心血管功能的调节,包括心肌舒缩功能[11]、血管舒缩反应[12]及内皮功能[13~15]。总体来说,神经酰胺参与多种心血管疾病的发病过程[16~18],只有极少数情况下起保护作用[19]。本研究结果显示,AMI患者的血浆神经酰胺水平明显低于对照组,考虑是由于低水平神经酰胺释放进入血液循环,或神经酰胺磷酸化增加导致的,这一结果与Xu等[20]及Luan等[21]的研究一致。通过对比患者PCI手术前后代谢物水平发现,患者在经过PCI手术后,血浆中N-软脂酰基鞘氨醇恢复到与对照组相近水平,而神经酰胺类物质Cer(d18∶0/16∶0)仍然维持在术前水平,提醒临床医师或可使用相关药物使此类代谢物水平恢复正常,避免此类物质代谢紊乱造成不良后果。
孕烷三醇是17-α-羟孕酮的一种代谢产物,AMI患者术前孕烷三醇水平较对照组明显升高,可在一定程度上反映患者体内羟孕酮升高。研究[22]表明,羟孕酮可降低体内HDL水平,上调低密度脂蛋白LDL水平。所以,孕烷三醇在一定程度上可提示冠心病或AMI的发生。我们通过对孕烷三醇手术前后水平统计分析发现,随着患者冠状动脉血流恢复,孕烷三醇的血浆水平亦得到恢复。
本研究通过对上述代谢产物进行鉴定,筛选出了与AMI相关的两条代谢通路,即甘油磷脂代谢通路和甘油脂类代谢通路。在两条代谢通路中存在一个共有的受到AMI影响的代谢物,即磷脂酸类物质1,2-diacyl-sn-glycerol-3-phosphate,同时也是上述两条代谢通路的交汇点。磷脂酸是一种具有生物活性的脂质,广泛参与人体生理生化反应,如血小板聚集、平滑肌收缩、心肌舒缩等。提示广大临床医师及研究者应提高对此类物质的重视。
总之,本研究从代谢通路、细胞信号传导等层面对AMI进行了研究与分析,得到了AMI患者和健康人群的代谢谱差异,并筛选出与AMI高度相关的特征代谢物。这些特征代谢物随着疾病进程所产生的变化多指向甘油磷脂类物质代谢通路异常,对这一通路进行深入研究有助于发现AMI新的治疗靶点及高度相关的危险因子。同时,对比患者PCI手术前后的血浆代谢轮廓及代谢标志物,发现部分代谢物并未恢复正常,对这些特征性代谢物深入研究,分析其代谢通路,可为防止疾病复发、改善患者预后提供参考。
参考文献:
[1] 张啸飞,胡大一,丁荣晶,等.中国心脑血管疾病死亡现况及流行趋势[J].中华心血管病杂志,2012,40(3):179-187.
[2] Lewis GD, Asnani A, Gerszten RE. Application of metabolomics to cardiovascular biomarker and pathway discovery[J]. J Am Coll Cardiol, 2008,52(2):117-123.
[3] 张立,马亚楠,张磊,等.乙肝相关性肝癌手术前后血清代谢轮廓分析及特征代谢物筛选[J].中华肝胆外科杂志,2013,19(2):81-87.
[4] Katajamaa M, Oresic M. Processing methods for differential analysis of LC/MS profile data[J]. BMC Bioinformatics, 2005,6:179-190.
[5] 陈静,单圆鸿,严沁,等.一种基于液相色谱-质谱技术进行血清代谢组学研究的方法:从代谢指纹到潜在标志物[J].中国科学化学,2009,39(10):1268-1276.
[6] Nie CY, Han T, Zhang L, et al. Cross-sectional and dynamic change of serum metabolite profiling for hepatitis B-related acute-on-chronic liver failure by UPLC/MS[J]. J Viral Hepat, 2014,21(1):53-63.
[7] Mannheim D, Herrmann J, Versari D, et al. Enhanced expression of Lp-PLA2 and Lysophosphatidylcholine in Symptomatic Carotid Atherosclerotic Plaques[J]. Stroke, 2008,39(5): 1448-1455.
[8] 郑明奇,刘刚,田立.溶血磷脂酰胆碱对T型钙离子通道的心肌细胞内信号调控机制[J].中华心脏与心率电子杂志,2013,1(1):24-26.
[9] Van Brocklyn JR, Williams JB. The control of balance between ceramide and sphingosine-1-phosphate by sphingosine kinase: oxidative stress and the seesaw of cell survival and death[J]. Comp Biochem Physiol B Biochem Mol Bio, 2012,163(1): 26-36.
[10] Cremers B, Flesch M, Kostenis E, et al. Modulation of myocardial contractility by lysophosphatidic acid[J]. J Mol Cell Cardiol, 2003,35(1):71-80.
[11] Simon JN, Chowdhury SA, Warren CM, et al. Ceramide-mediated depression in cardiomyocyte contractility through PKC activation and modulation of myofilament protein phosphorylation[J]. Basic Res Cardiol, 2014,109(6):445-471.
[12] Moreno L, Moral-Sanz J, Morals-Cano D, et al. Ceramide mediates acute oxygen sensing in vascular tissues[J]. Antioxid Redox Signal, 2014,20(1):1-14.
[13] Zhang DX, Zou AP, Li PL. Ceramide-induced activation of NADPH oxidase and endothelial dysfunction in small coronary arteries[J]. Am J Physiol Heart Circ Physiol, 2003,284(2): H605-612.
[14] Alewijnes AE, Peters SL, Michel MC. Cardiovascular effect of sphingosine-1-phosphate and other sphingomyelin metabolites[J]. Br J Pharmacol, 2004,143(6):666-684.
[15] Novqorodov SA, Gudz TI. Ceramide and mitochondria in ischemia/reperfusion[J]. J Cardiovasc Pharmacol, 2009,53(3):198-208.
[16] Zhang H, Li J, Li L, et al. Ceramide enhances COX-2 expression and VSMC contractile hyperreactivity via ER stress signal activation[J]. Vascul Pharmacol, 2017(96-98):26-32.
[17] Leonardini A, D′Oria R, Incalza MA, et al. GLP-1 receptor activation inhibits palmitate-induced apoptosis via ceramide in human cardiac progenitor cell[J]. J Clin Endocrinol Metab, 2017,102(11):4136-4147.
[18] Li X, Becker KA, Zhang Y. Ceramide in redox signaling and cardiovascular disease[J]. Cell Physiol Biochem, 2010,26(1):41-48.
[19] Chen I, Ginis Y, Hallenbeck JM. The protective effect of ceramide in immature rat brain hypoxia-ischemia involves upregulation of Bcl-2 and reduction of TUNEL-positive cells[J]. J Cereb Blood Flow Metab, 2001,21(1):34-40.
[20] Xu XB, Gao BB, Guan QJ, et al. Metabolomic profile for the early detection of coronary artery disease by using UPLC-QTOF/MS[J]. J Pharmaceut Biomed, 2016,129:34-42.
[21] Luan HM, Chen XM, Zhong SL, et al. Serum metabolomics reveals lipid metabolism variation between coronary artery disease and congestive heart failure: a pilot study[J]. Biomarker, 2013,18(4):314-321.
[22] LaRosa JC. Women, lipoproteins, cardiovascular disease risk[J]. Can J Cardiol, 1990,6(Suppl B):23-29.
