IL-34对类风湿关节炎髓系树突状细胞表型的影响*
2018-04-20孙晓彤邬秀娣
张 振 孙晓彤 邬秀娣 黄 华 李 霞 王 冰
(宁波市第一医院, 宁波 315010)
类风湿关节炎(Rheumatoid arthritis,RA)的主要病理特征为滑膜炎症、滑膜增生,最终破坏软骨及骨组织,其发病机制十分复杂。目前认为自身抗体产生与细胞因子异常表达都与RA的发病密切相关。RA自身抗体的产生往往与外周辅助性T细胞的过度活化有关,该辅助性T细胞可促进B细胞活化从而产生自身抗体[1]。而髓样树突状细胞(Myeloid dendritic cells,mDC)是体内抗原提呈能力最强的细胞,mDC可通过直接接触及分泌细胞因子诱导外周辅助性T细胞的生成[2]。因此mDC在自身抗体产生环节中发挥了重要作用。
近年发现IL-34参与RA的发病,但具体机制不详[3]。生理状态下IL-34含量很低,主要是参与维系髓系细胞的生存,促进巨噬细胞的分化[4],但对DC的形成目前鲜有报道。因此本实验通过检测IL-34诱导下,其对RA单核细胞、单核细胞衍生的不成熟DC及成熟DC的表型表达的影响,初步探讨IL-34对RA DC分化的作用。
1 材料与方法
1.1材料
1.1.1实验材料 PBMC取材于2017年5月至2017年7月在浙江省宁波市第一医院风湿免疫科住院RA患者,共30例,诊断均符合1987年美国风湿病学会(ACR)修订的RA分类标准[5],并均排除妊娠、其他自身免疫性疾病和其他急、慢性疾病。本研究中标本的采集均经过宁波市第一医院伦理委员会的批准(批准文号:2017-05),并取得患者的知情同意。
1.1.2试剂 RPMI1640、胎牛血清(Fetal Bovine Serum,FBS)购自美国Gibco公司,淋巴细胞分离液Ficoll购自天津灏扬生物制品科技有限责任公司,rhIL-4、rhGM-CSF、rhTNF-α购自PeproTech 公司,rhIL-34购自Miltenyi公司,PE-anti-CD83、anti-CD14,APC-anti-CD86单抗、鼠APC IgG 同型对照、鼠PE IgG 同型对照均购自eBioscience公司。
1.1.3实验仪器 CO2细胞培养箱(Thermo公司),流式细胞仪(BD 公司)。
1.2方法
1.2.1RA PBMC的分离培养 将每2 ml EDTA抗凝血于300 g离心5 min,吸取血浆保存。每管中加入2 ml PBS混匀。向15 ml管中加入4 ml Ficoll溶液,沿管壁将PBS混合血缓慢加入。500 g离心20 min,吸取中间白膜层(1~2 ml)置于另15 ml管中,加入PBS至12 ml离心:250 g,10 min。置24孔板中,10% FBS RPMI培养。
1.2.2DC细胞的诱导 将取出的PBMC按照密度1×106/ml/孔接种到24孔板中,静置4 h后吸弃悬浮细胞。检测IL-34对不成熟DC诱导表型的影响:将贴壁细胞分成3组,每组细胞分别加入GM-CSF(100 ng/ml)+IL-4(50 ng/ml)、IL-4(50 ng/ml)、IL-4(50 ng/ml)+IL-34(50 ng/ml)刺激3 d后分别加入对应的新鲜细胞因子继续刺激2 d,收集细胞进行表型鉴定。检测IL-34对成熟DC诱导表型的影响:将贴壁细胞分成3组,每组细胞分别加入GM-CSF(100 ng/ml)+IL-4(50 ng/ml),刺激3 d后换新鲜的细胞因子继续刺激2 d,然后再分别加入TNF-α(1 000 U/ml)、IL-34(50 ng/ml)、TNF-α(1 000 U/ml)+IL-34(50 ng/ml)刺激2 d,收集细胞进行表型鉴定。
1.2.3流式细胞仪检测表型 将PBMC中贴壁的单核细胞、诱导的各阶段DC分别加入Anti-CD83-PE、Anti-CD86-APC和(或)Anti-CD14-PE,4℃避光孵育30 min,PBS(含0.5%BSA)洗涤,流式细胞仪检测各组细胞表面CD83、CD86和(或)CD14平均荧光强度。

2 结果
2.1IL-34联合IL-4在诱导单核细胞分化过程中可促进其表达CD83、CD86 见图1。流式细胞仪检测结果显示:与未诱导组相比,IL-34+IL-4诱导的DC表面CD83和CD86分子明显升高,而CD14表达下降(P<0.005)。不同诱导组间对比,IL-34+IL-4组较GM-CSF+IL-4组CD83表达无差异(P>0.05),CD86及CD14表达均下降(P<0.05);IL-34+IL-4组较单纯IL-4组DC的CD83及CD86表达均增加(P<0.05),CD14表达无差异(P>0.05)。
2.2IL-34 在诱导不成熟DC分化过程中不能促进其表达CD83、CD86 见图2。流式细胞仪检测结果显示:IL-34+GM-CSF+IL-4诱导的DC表面CD83和CD86与GM-CSF+IL-4组相比,表达差异无统计学意义(P>0.05),与GM-CSF+IL-4+TNF-α组相比,CD83、CD86表达均下降(P<0.05)。
2.3IL-34 不能进一步促进成熟DC表达CD83、CD86 见图3。流式细胞仪检测结果显示:IL-34在加入诱导的成熟DC体系后,细胞表面CD83水平较加入前表达下降(P<0.05), CD86及CD14表达无明显差异(P>0.05)。
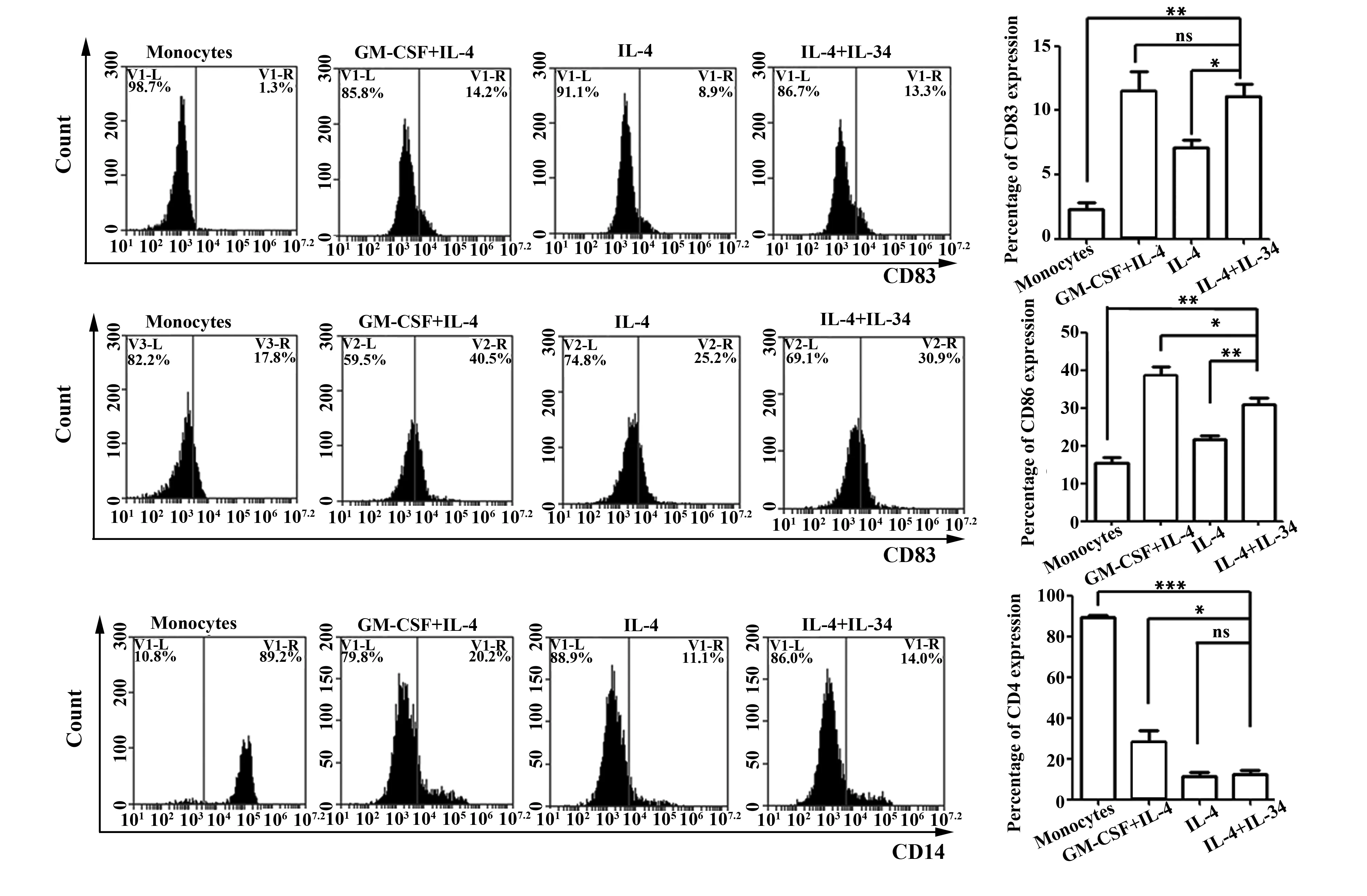
图1 不同细胞因子诱导单核细胞向不成熟DC分化表面CD83、CD86及CD14表达情况Fig.1 Expression of CD83,CD86 and CD14 was detected by FACS on immature cells induced by different cytokinesNote:*.P<0.05;**.P<0.005;***.P<0.000 5.ns.No significant.
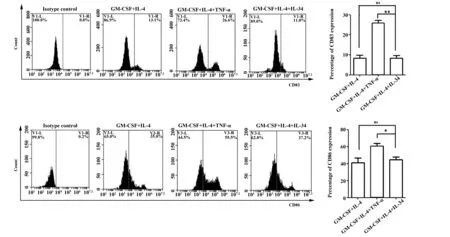
图2 不同细胞因子诱导不同阶段DC表面CD83、CD86表达情况Fig.2 Expression of CD83 and CD86 on DC surface was induced by different cytokinesNote:*.P<0.05;**.P<0.005;ns.No significant.
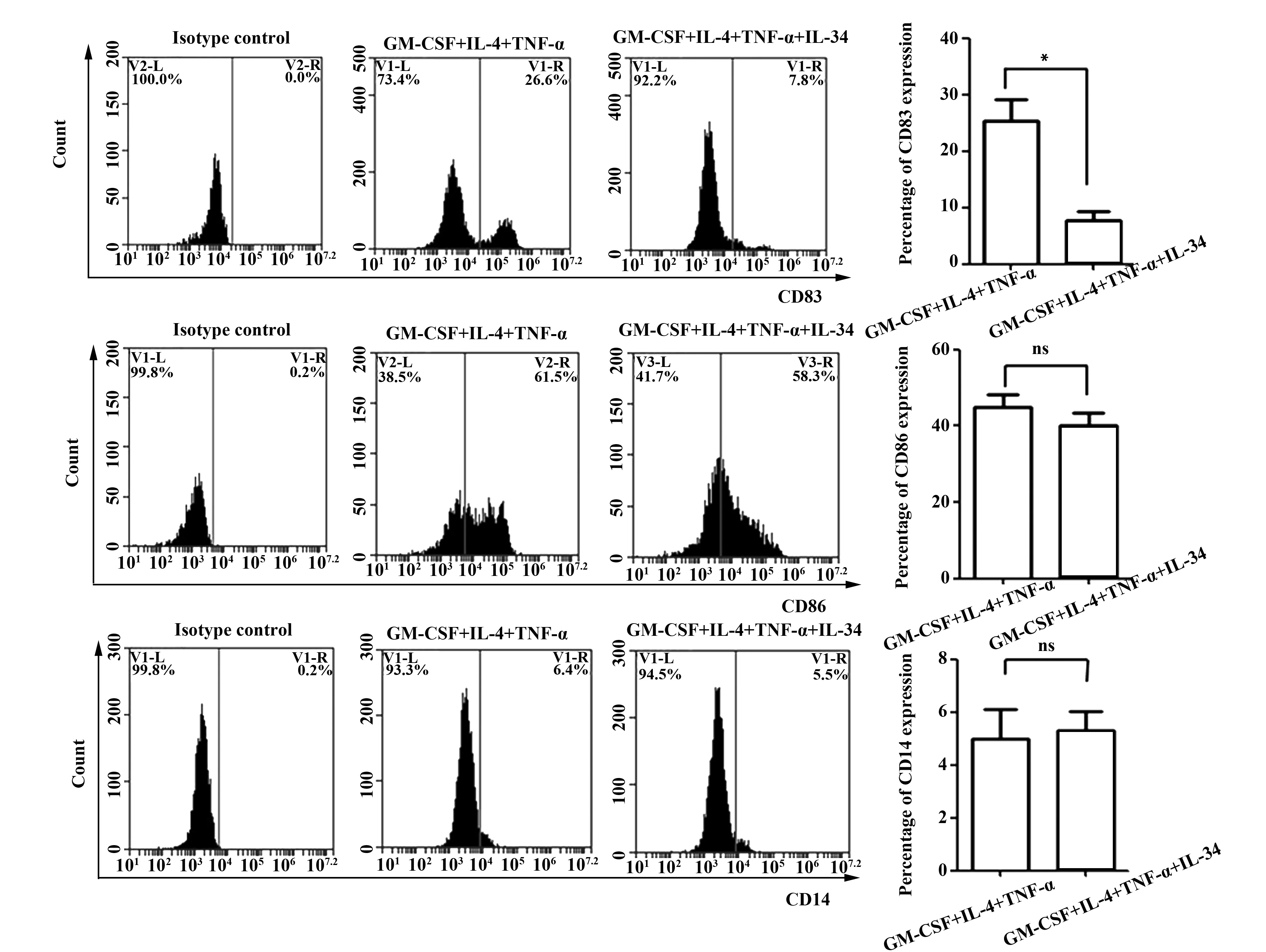
图3 IL-34对成熟DC诱导前后细胞表面CD83、CD86及CD14表达情况Fig.3 Expression of CD83,CD86 and CD14 on mature DC induced with or without IL-34Note:*.P<0.05;ns.No significant.
3 讨论
RA是一种以关节滑膜炎症为主要表现的自身免疫病,发病机制复杂。研究表明,炎性细胞因子的释放、淋巴细胞过度活化和自身抗体生成是RA发病机制中的重要环节。T淋巴细胞活化需要抗原提呈细胞辅助,当T淋巴细胞被激活后,可分泌大量细胞因子并促进B细胞产生抗体,导致关节滑膜增生及炎性细胞浸润,进而破坏关节的正常结构乃至引起系统性病变。本研究体外检测IL-34对RA单核细胞向树突状细胞诱导分化过程中对其表型的影响,从而寻找IL-34参与RA发病的依据。
IL-34是白介素家族成员之一,是髓系细胞生存、增殖和分化的重要调节因子,尤其对单核细胞、巨噬细胞和破骨细胞的生存发育作用显著[6]。IL-34与M-CSF可共用相同的受体CSF-1R,但两者与受体结合的特点、信号通路模式仍存在差别[7]。除此之外IL-34在体内的表达具有组织特异性,皮肤角质细胞和处于静息状态的神经元可分泌IL-34,对朗格汉斯细胞和小胶质细胞的维持和发育发挥关键作用。相关研究表明体内某些细胞在应激状态下可以分泌IL-34,这一过程受NF-κB信号通路调节[8,9]。这表明IL-34参与某些疾病的病理过程,其中包括RA。IL-34在RA患者血清及关节滑液中增高并与疾病活动度指标呈正相关[10],此外IL-34还可刺激成纤维样滑膜细胞及单核细胞分泌炎性因子,进而影响T细胞亚群的数量[11,12]。
DC主要由骨髓中髓样祖细胞和淋巴样祖细胞衍生而来,根据来源表型及功能的差异,DC又分为髓样DC、浆细胞样DC及来源于间充质干细胞的滤泡DC。其中髓样DC是体内抗原提呈能力最强的细胞,未成熟状态主要具有迁移、抗原加工处理等功能,成熟后能有效激活初始T细胞。由单核细胞衍生的成熟髓系DC高表达CD83、CD86,低表达CD14[13]。本研究检测了IL-34诱导不同阶段DC对其表型的影响,如结果所示,IL-34联合IL-4可诱导单核细胞分化为不成熟DC,细胞表面CD83、CD86水平均上升,CD14表达下降,优于单独使用IL-4,但较传统GM-CSF联合IL-4的作用略低;而IL-34诱导成熟DC分化的作用很弱,在使用GM-CSF、IL-4诱导单核细胞分化为不成熟DC后,再加入IL-34,发现CD83、CD86表达并没有明显变化,且在传统诱导剂TNF-α诱导成熟DC分化过程中加入IL-34,前后对比发现CD86和CD14表达水平无差异,而CD83表达水平反而下降。该研究表明IL-34在单核细胞诱导分化为不成熟DC过程中发挥作用,虽然作用略弱于GM-CSF且对诱导成熟DC分化并不显著,但仍可推测IL-34促进不成熟DC分化进而影响其抗原加工处理能力。
综上所述,本研究通过揭示IL-34对不成熟DC的维系及分化具有较重要的作用,为IL-34参与RA的发病机制提供了新的线索,但具体机制尚需进一步深入研究探讨。
参考文献:
[1] Rao DA,Gurish MF,Marshall JL,etal.Pathologically expanded peripheral T helper cell subset drives B cells in rheumatoid arthritis [J]. Nature,2017,542(7639):110-114.
[2] Ueno H,Schmitt N,Palucka AK,etal.Dendritic cells and humoral immunity in humans [J]. Immunol Cell Biol,2010,88(4):376-380.
[3] Baghdadi M,Endo H,Tanaka Y,etal.Interleukin 34,from pathogenesis to clinical applications [J].Cytokine,2017,99:139-147.
[4] Foucher ED,Blanchard S,Preisser L,etal.IL-34-and M-CSF-induced macrophages switch memory T cells into Th17 cells via membrane IL-1α [J]. Eur J Immunol,2015,45(4):1092-1102.
[5] Arentt FC,Edworthy SM,Bloch DA,etal.The ARA 1987 revised criteria for classification on rheumatoid arthritis [J].Arthritis Rheum,1988,31:315-324.
[6] Foucher E,Blanchard S,Preisser L,etal.IL-34 induces the differentiation of human monocytes into immunosuppressive macrophages;antagonistic effects of GM-CSF and IFNγ [J].PLoS One,2013,8(2):e56045.
[7] Wei S,Nandi S,Chitu V,etal.Functional overlap but differential expression of CSF-1 and IL-34 intheir CSF-1 receptor-mediated regulation of myeloid cells [J]. J Leukoc Biol,2010,88(3):495-505.
[8] Yu Y,Yang D,Qiu L,etal.Tumor necrosis factor-α induces interleukin-34 expression through nuclear factor-κB activation in MC3T3-E1 osteoblastic cells [J].Mol Med Rep,2014,10:1371-1376.
[9] Eda H,Shimada H,Beidler D,etal.Proinflammatory cytokines,IL-1β and TNF-α,induce expression of interleukin-34 mRNA via JNK-and p44/42 MAPK-NF-κB pathway but not p38 pathway in osteoblasts [J].Rheumatol Int,2011,31(2011):1525-1530.
[10] Chemel M,Goff B,Brion R,etal.Interleukin 34 expression is associated with synovitis severity in rheumatoid arthritis patients [J].Ann Rheum Dis,2012,71:150-154.
[11] Wang B,Ma Z,Wang M,etal.IL-34 upregulated Th17 production through increased IL-6 expression by rheumatoid fibroblast-like synoviocytes [J].Mediators Inflamm,2017.doi:10.1155
[12] Wang B,Tang Y,Sun X.etal.Increased IL-6 expression on THP-1 by IL-34 stimulation up-regulated rheumatoid arthritis Th17 cells [J].Clin Rheumatol,2017.doi:10.1007.
[13] 朱 娜,王海桃,李 昌,等.未成熟树突状细胞快速分离与体外诱导培养及其鉴定研究[J].中国免疫学杂志,2017,33(7):1043-1047.
Zhu N,Wang HT,Li C,etal.Isolation,induced culture and identification of immature dendritic cells[J].Chin J Immunol,2017,33(7):1043-1047.