重组人红细胞生成素与β-七叶皂甙钠对大鼠脊髓损伤后功能恢复和神经细胞继发性损伤的影响
2018-04-20赵亮曹阳徐莉
赵 亮 曹 阳 徐 莉
(锦州医科大学附属第一医院骨外科,锦州 121000)
脊髓损伤(Spinal cord injury,SCI),是中枢神经系统常见的损伤,不仅会由创伤导致的直接损伤,还会出现脊髓局部伴发一定的继发性病理改变,与原发性损伤相比,这种损伤的危害性要强[1]。随着临床医学水平的提高,出现了细胞凋亡这一概念,随之也就证实了当中枢神经系统损伤后,出现神经细胞凋亡是一种比较常见的情况[2]。换言之,中枢神经系统损伤后,神经细胞凋亡在继发性损伤中发挥重要作用。目前,对于中枢神经损伤的治疗措施比较多,比如:手术治疗、药物治疗、高压氧治疗、微波治疗等,但效果均不佳[3,4]。本文就50只大鼠为实验对象,观察重组人红细胞生成素与β-七叶皂甙钠在大鼠脊髓损伤中的治疗功效。
1 材料与方法
1.1实验材料 选购锦州医科大学动物中心的雌性成年SD大鼠,共计50只,体重:240~260 g,平均体重为(251.2±18.6)g。依据随机数字表法将其分为5组,每组各10只。即空白组(仅暴露,不损伤脊髓)、损伤组(损伤脊髓,但不使用药物)、rhEPO组(仅使用重组人红细胞生成素治疗)与β-SE组(仅使用β-七叶皂甙钠治疗)、联合治疗组(同时应用重组人红细胞生成素与β-七叶皂甙钠治疗)。
1.2方法
1.2.1动物模型的制作 脊髓损伤模型采用Nystrom法[5]进行制备。首先,对大鼠采用10%水合氯醛 (上海铭博生物科技有限公司)0.4 ml/100 g腹腔注射进行麻醉,无菌操作,背部正中背皮,然后进行背部中段正中切口,仔细咬除T13椎板及黄韧带,将35 g自制标准重锤通过2.5 mm×5.0 mm弧形光滑金属垫片压迫于该段脊髓后正中,时间为5 min,致以中度脊髓损伤。术后每日人工挤压膀胱排尿3次至自主排尿。
1.2.2治疗方法 在造膜成功之后的1 h,经尾静脉给药。空白组:不给予打击及治疗,经尾静脉推注剂量相同的生理盐水(浙江济民制药股份有限公司)。损伤组:打击后给予等量生理盐水作为对照。rhEPO组:打击后仅使用重组人红细胞生成素(沈阳三生制药有限责任公司),剂量与方法等同联合治疗组。β-SE组:打击后予以0.1 mg/kg的β-七叶皂甙钠(山东绿叶制药股份有限公司),使用盐水稀释后行静脉推注,每天一次,连续使用7 d。联合治疗组:打击后予以0.1 mg/kg的β-七叶皂甙钠,使用盐水稀释后行静脉推注,每天一次,连续使用7 d;重组人红细胞生成素每天1次,行静脉推注,使用剂量为300 U/kg。
1.2.3观察指标
1.2.3.1神经功能评判标准[6]主要包括行为观察与斜板试验。①行为观察[7]:0分代表损伤平面之下未见任何反应,双后肢无肌力,感觉丧失;6分代表能够正常行走、跑。分值越高,行为能力越强。②斜板试验:采用改良的 Rivlin法[8],大鼠置于40×80 cm的平整木板之上,呈俯卧状,头侧方缓慢的抬高,当大鼠往下滑行时,对大鼠功能恢复的情况进行观察。对脊髓损伤大鼠进行斜板倾斜角度的测定,测定的时间分别于术后4 h、1 d、4 d、7 d、14 d。
1.2.3.2组织学检查 术后对五组大鼠在各个时间点进行功能评分,其中空白组取材在对大鼠进行观察的末期进行,另外四组大鼠麻醉下,将大鼠的损伤段脊髓取出,取损伤中心部位约5 mm,横切面以5 mm厚度连续切片,HE 染色,观察脊髓组织的形态变化,另外观察脊髓组织的结构变化。
1.2.3.3NF-κB 的免疫组化检测 针对NF-κB 表达的具体表现,本次采取SP方案来实施,标本取得后行免疫组化染色。试剂:北京中山公司(SP染色),一抗用PBS来替换形成阴性对照,保证一抗工作浓度为1∶100。清洗载玻片并用粘合剂处理,常规脱腊至水,用 3%H2O2室温孵育 10 min灭活内源性过氧化物酶;蒸馏水冲洗、PBS 冲洗等处理,最后 DAB 显色,苏木素复染 1 min,水洗,1%盐酸酒精分化,脱水,透明,封固。图像分析,细胞着色处理,颜色如棕黄色或棕褐色。之后显微镜收集图像和图片数据处理,软件为HPIAS-2000,全自动分析,获取和保存阳性细胞的吸光度值,每个切片的NF-κB 相对含量采用上述吸光度值的平均值来记录。
1.2.3.4脊髓组织Ca2+、Mg2+含量检测 将脊髓组织于烘箱中烘焙,直到恒重后,然后加入浓硝酸和高氯酸混合溶液5 ml,其中浓硝酸∶高氯酸的比例按照5∶2 进行,常温消化48 h,烧瓶消化液放置,500℃石棉炉时间1 h,5%盐酸溶解烧瓶无机物,进行定容,用原子发射光谱仪中对Ca2+、Mg2+含量进行测定。Ca2+或者Mg2+含量为:测定标准液Ca2+或者Mg2+浓度/样本干重×稀释倍数(μg/g样本干重)。
2 结果
2.1各组大鼠在不同时间的BBB评分比较 空白对照组大鼠的功能表现比较稳定,空白对照组大鼠的神经功能正常,评分均为 21 分。12 h 后,损伤组、rhEPO组、β-SE组大鼠的功能均没有恢复,联合治疗组的大鼠出现部分功能恢复。其中,损伤组大鼠的功能受损表现比较严重,并且大鼠的恢复也非常缓慢,损伤后14 d 时,损伤组大鼠的评分值升至最大,达8分左右。本组结果显示,损伤组BBB 运动功能评分均显著低于rhEPO组、β-SE组和联合治疗组,组间比较差异均存在显著统计学意义(P<0.01)。另外,联合治疗组运动功能恢复表现比较明显,14 d 时,联合治疗组的评分至19分,与空白对照组比较,功能基本接近正常。本组调查显示,rhEPO组、β-SE组功能恢复表现比较缓慢,在1、3、5、7、14 d的评分值均高于损伤组,差异有显著统计学意义(P<0.01)。在14 d时,rh-EPO组、β-SE组两组的评分值升至最大值,但是与空白组比较,差异比较大,另外,大鼠尚存留部分肢体功能残疾。见表1。
2.2各组神经功能的观察与评价对比 空白组动物的神经功能正常、运动正常。rhEPO组、β-SE组、联合治疗组的神经功能要比损伤组好,且其中联合治疗组的神经功能优于rhEPO组、β-SE组,差异比较有统计学意义(P<0.05)。 见表2。
2.3各组大鼠脊髓损伤后NF-κB免疫组化检测结果比较 NF-κB阳性细胞一般在以下的细胞中比较常见,比如脊髓神经元、神经胶质细胞、血管内皮细胞等,并且在胞质或者是胞核中会着色,主要表现为棕黄色或棕褐色,见图1~3。本组资料显示,空白组出现较少的 NF-κB 阳性细胞。损伤组伤后4 h NF-κB 的表现比较明显,其中,在14 h出现了最高峰,之后开始出现下降趋势,在伤后7 d ,NF-κB已降低为正常的水平。NF-κB 表达比较,联合治疗组显著低于损伤组、Rh-EPO组、β-SE组,差异具有显著统计学意义(P<0.05);Rh-EPO组、β-SE组显著低于损伤组,差异有显著统计学意义(P<0.05),其中以8、12 h两时间点尤为显著(P<0.01)。空白对照组均显著低于其他四组,差异有显著统计学意义(P<0.05)。伤后7 d,rhEPO组、β-SE组、联合治疗组的 NF-κB 含量均已明显下降至正常水平。见表3。
2.4各组大鼠脊髓损伤后组织Ca2+、Mg2+含量比较 大鼠脊髓损伤后空白对照组Ca2+含量显著高于损伤组、rhEPO组、β-SE组及其联合治疗组,差异有显著统计学意义(P<0.05);另外,rhEPO组、β-SE组、联合治疗组的Ca2+含量显著高于损伤组,差异有显著统计学意义(P<0.05);联合治疗组的Ca2+含量显著高于rhEPO组、β-SE组,差异有显著统计学意义(P<0.05)。空白对照组Mg2+含量显著低于损伤组、rhEPO组、β-SE组及其联合治疗组,差异有显著统计学意义(P<0.05);另外,rhEPO组、β-SE组、联合治疗组的Mg2+含量显著低于损伤组,差异有显著统计学意义(P<0.05);联合治疗组 的Mg2+含量显著低于rhEPO组、β-SE组,差异有显著统计学意义(P<0.05)。见表4。
表1各组在不同时间的BBB评分比较
Tab.1ComparisonofBBBscoresateachtimeineachgroup
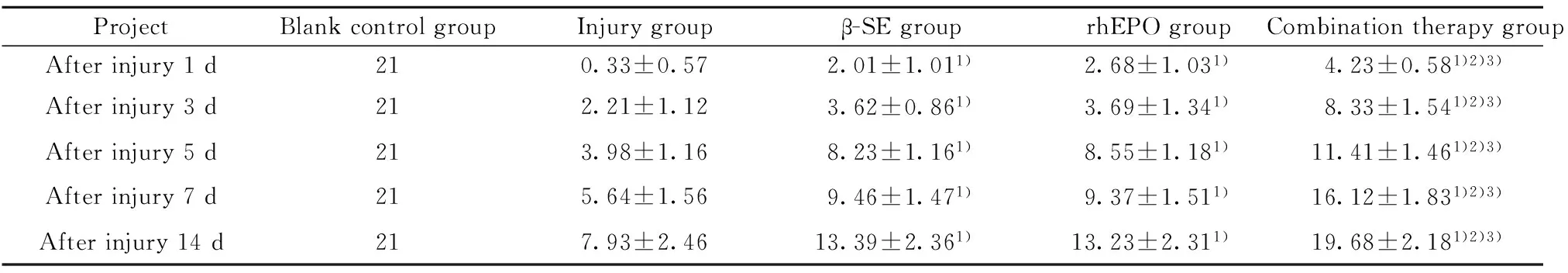
ProjectBlankcontrolgroupInjurygroupβ-SEgrouprhEPOgroupCombinationtherapygroupAfterinjury1d210.33±0.572.01±1.011)2.68±1.031)4.23±0.581)2)3)Afterinjury3d212.21±1.123.62±0.861)3.69±1.341)8.33±1.541)2)3)Afterinjury5d213.98±1.168.23±1.161)8.55±1.181)11.41±1.461)2)3)Afterinjury7d215.64±1.569.46±1.471)9.37±1.511)16.12±1.831)2)3)Afterinjury14d217.93±2.4613.39±2.361)13.23±2.311)19.68±2.181)2)3)
Note:Compared with the injury group,1)P<0.01;compared with the rhEPO group,2)P<0.01;compared with the β-SE group,3)P<0.01.
ProjectTimeBlankcontrolgroupInjurygroupβ-SEgrouprhEPOgroupCombinationtherapygroupBehaviorevaluation(score)4h6.0±2.00.3±0.10.7±0.31)0.6±0.21)0.9±0.31)1d6.0±2.00.6±0.30.9±0.31)0.8±0.21)1.0±0.31)4d6.0±2.01.2±0.32.3±0.71)2.1±0.61)3.5±1.31)2)3)7d6.0±2.01.6±0.33.0±0.41)3.1±0.91)4.8±1.31)2)3)12d6.0±2.01.8±0.43.6±0.51)3.4±1.11)5.2±1.21)2)3)Swashplateangle(°)4h73.3±16.410.1±5.815.2±6.11)15.3±2.91)23.1±3.61)2)3)1d72.3±15.411.23±6.322.9±7.61)23.1±2.71)37.0±3.51)2)3)4d71.2±8.915.3±3.625.4±3.81)25.6±3.71)40.3±5.11)2)3)7d70.3±9.518.3±3.829.5±3.31)30.1±3.41)48.6±4.51)2)3)12d69.6±11.822.4±4.136.1±3.21)38.3±4.51)54.0±6.51)2)3)
Note:Compared with the injury group,1)P<0.01;compared with the rhEPO group,2)P<0.01;compared with the β-SE group,3)P<0.01.
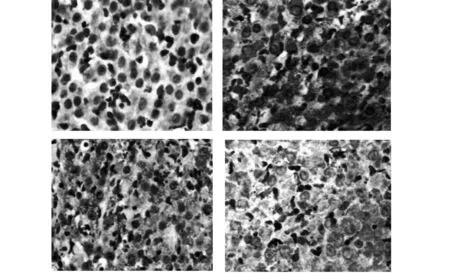
图1 各组Bcl-2的表达(×400)Fig.1 Expression of Bcl-2 in each group(×400)Note: From left to right were the expression of injury group,β-SE group,rhEPO group and Combination therapy group
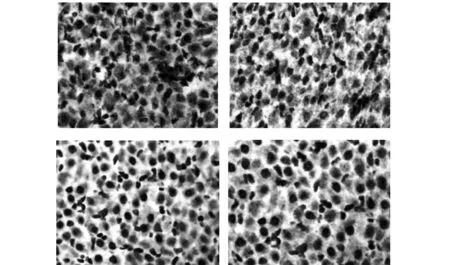
图2 各组bax的表达(×400)Fig.2 Expression of bax in each group(×400)Note: From left to right were the expression of injury group,β-SE group,rhEPO group and Combination therapy group
表3各组大鼠脊髓损伤后NF-κB免疫组化检测结果比较
Tab.3ComparisonofNF-κBimmunohistochemicalresultsafterspinalcordinjuryineachgroup
ProjectBlankcontrolgroupInjurygroupβ-SEgrouprhEPOgroupCombinationtherapygroupAfterinjury4h4.85±0.0430.04±0.5222.12±0.301)22.68±0.311)12.21±0.532)3)4)Afterinjury8h4.85±0.0440.17±0.9829.87±0.561)28.78±0.581)19.98±0.962)3)4)Afterinjury14h4.85±0.0455.68±0.5742.95±1.011)42.77±1.041)15.33±0.542)3)4)Afterinjury1d4.85±0.0434.61±0.3823.97±0.561)23.95±0.551)14.41±0.422)3)4)Afterinjury3d4.85±0.0422.47±0.5211.14±0.261)11.23±0.271)12.13±0.542)3)4)Afterinjury5d4.85±0.0415.64±0.415.92±0.091)5.91±0.081)10.12±0.382)3)4)Afterinjury7d4.85±0.044.49±0.234.93±0.094.82±0.074.88±0.21
Note:Compared with the injury group,1)P<0.01;compared with the rhEPO group,2)P<0.01;Compared with the β-SE group,3)P<0.01;compared with the blank control group,4)P<0.05.
ProjectBlankcontrolgroupInjurygroupβ-SEgrouprhEPOgroupCombinationtherapygroupCa2+contents(μg/g)Afterinjury1h811±12485±152)3)4)623±231)3)4)625±241)2)4)756±261)2)3)4)Afterinjury1d809±12423±142)3)4)612±191)3)4)614±201)2)4)716±241)2)3)4)Afterinjury2d810±12468±172)3)4)596±181)3)4)598±191)2)4)693±221)2)3)4)Mg2+contents(μg/g)Afterinjury1h395±5546±122)3)4)435±212)3)4)433±191)2)4)411±121)2)3)4)Afterinjury1d395±5503±82)3)4)486±111)3)4)492±111)2)4)456±91)2)3)4)Afterinjury2d395±5512±132)3)4)503±131)3)4)508±111)2)4)467±81)2)3)4)
Note:Compared with the injury group,1)P<0.01;compared with the rhEPO group,2)P<0.01;compared with the β-SE group,3)P<0.01;compared with the blank control group,4)P<0.05.
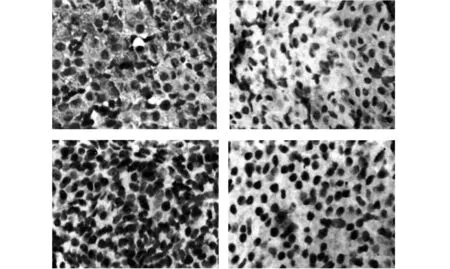
图3 各组fas的表达(×400)Fig.3 Expression of fas in each group(×400)Note: From left to right were the expression of injury group,β-SE group,rhEPO group and Combination therapy group
3 讨论
SCI是致残的一个非常重要因素,对患者的生命健康造成严重的影响。另外,还有一大部分 SCI 是由于原发性损伤处理措施不到位,从而引起更加严重的继发性损害[9,10],β-七叶皂甙钠(β-SE)是七叶树科植物中提取的皂甙钠盐,是一种无菌制剂。首先能够起到促进机体ACTH的提高,另外还能促进可的松血浆浓度的提高,能有效促进拮抗前列腺素E1(Prostaglandin E1,PGE1)增加,对机体中的自由基实现彻底清除,以此来发挥有效的抗炎效果,另外还能发挥抗渗出作用;其次,β-SE还能起到改善微循环的作用,能起到有效消除局部肿胀的效果[12,13]。总的来说,使用β-七叶皂甙钠治疗脊髓损伤可有效保护脊髓神经细胞的亚微结构,有利于神经功能的进一步恢复。
重组人红细胞生成素的作用机理在于:靶细胞在受到重组人红细胞生成素的刺激之后,伴发细胞质内的Ca2+聚集。单一的红系前体细胞在受到重组人红细胞生成素的刺激之后,细胞质中的Ca2+浓度便会随之升高,发生这种变化的因素在于细胞中Ca2+的重新分布,并不是由于细胞之外的Ca2+进入到细胞中[14]。因而,重组人红细胞对脊髓损伤之后的细胞内钙过载起到抑制作用。除此之外,当重组人红细胞生成素作用于靶细胞之后,会发生另一种效应便是增加细胞内的DNA合成。同时,血红蛋白的合成也会在一定程度上受到影响。
通过重组人红细胞生成素的使用,可促使血液红细胞数的增加,继而增加血氧饱和度,使血氧含量大幅增加。就此来看,重组人红细胞生成素可有效改善损伤区的血氧供应,对局部微循环有着很好的改善效用[15]。胡杨等[16]研究表明,rhEPO通过调控NF-κB而起到抗炎的作用[17]。任宪盛等[18]研究发现:rhEPO能够明显降低脊髓损伤后丙二醛含量,因此能明显减轻SCI后的超微结构改变,因此可以起到很好的保护脊髓组织的效果,从而起到保护神经的作用。
目前常用的评分方法包括以下几个方面:①斜板试验;②Talove评分法;③Gale行为学评分法。与其他的评价方法进行比较,斜板试验具有操作简单、方便的效果[19]。BBB神经功能评定法,更加详细的对神经功能的改善进行了描述,同时还减少了一些人为因素对评分的干扰,提高了评分的准确性。本组实验采取斜板法和BBB评分法这两组办法相结合的评价方法。空白对照组大鼠功能稳定,神经功能正常,评分均为21分。致伤后12 h除联合治疗组可见大鼠出现部分功能恢复表现外,损伤组、rhEPO组、β-SE组均无明显功能恢复。损伤组大鼠伤后功能受损明显,恢复缓慢,1 d时仅有1只大鼠有微弱的关节活动,至14 d时评分值升至最大,达8分以上,其中,损伤组BBB运动功能评分均显著低于rhEPO组、β-SE组和联合治疗组,差异均存在显著统计学意义(P<0.01)。联合治疗组大鼠后肢运动功能恢复较快,伤后14 d时评分至18分以上,功能基本接近正常。rhEPO组、β-SE组恢复缓慢,各时间点评分值虽明显高于损伤组,但均落后于联合治疗组,差异有显著统计学意义(P<0.01)。说明重组人红细胞生成素与β-七叶皂甙钠联合治疗组大鼠的功能恢复显著优于单组治疗。
NF-κB被认为是普遍存在于细胞浆中的一种快反应转录因子,它可以被许多刺激剂激活,比如:细胞因子、氧化剂、病毒、紫外线等。NF-κB活性增高一方面能增加炎症反应的发生率,另外还会使得机体出现神经组织损伤,同时,对于细胞死亡起到了一定的促进作用。本组资料显示,损伤组伤后4 h NF-κB的表现比较明显,其中,在14 h出现了最高峰,之后开始出现下降趋势,在伤后7 d,NF-κB已降低为正常水平。NF-κB表达比较:联合治疗组显著低于损伤组、Rh-EPO组、β-SE组,差异有显著统计学意义(P<0.05);Rh-EPO组、β-SE组显著低于损伤组,差异有显著统计学意义(P<0.05),其中以8、12 h两时间点尤为显著(P<0.01)。空白对照组均显著低于其他四组,差异有显著统计学意义(P<0.05)。伤后7 d,rhEPO组、β-SE组、联合治疗组的 NF-κB含量已明显下降至正常水平。说明,重组人红细胞生成素与β-七叶皂甙钠联合有助于减少炎症反应,减少神经组织损伤,降低细胞死亡。
Ca2+、Mg2+离子对细胞的调控也比其他的离子更具有影响力。Mg2+是细胞内第二种含量丰富的阳离子,SCI后受损微环境中Ca2+聚集的同时伴有Mg2+流失,SCI后局部Mg2+下降,且下降程度与脊髓组织损伤的程度及SCI后的预后水平呈正相关,说明Mg2+下降参与了脊髓损伤过程。Mg2+在细胞内参与多种代谢过程,并是许多酶的活性中心,通过与磷脂形成稳定复合物影响细胞膜流动性和膜结合酶的活性。本组资料显示,鼠脊髓损伤后空白对照组Ca2+含量显著高于损伤组、rhEPO组、β-SE组及联合治疗组,差异有显著统计学意义(P<0.05);联合治疗组Ca2+含量显著高于rhEPO组、β-SE组,差异有显著统计学意义(P<0.05)。空白对照组Mg2+含量显著低于损伤组、rhEPO组、β-SE组及其联合治疗组,差异有显著统计学意义(P<0.05);另外,rhEPO组、β-SE组,联合治疗组的Mg2+含量显著低于损伤组,差异有显著统计学意义(P<0.05);联合治疗组的Mg2+含量显著低于rhEPO组、β-SE组,差异有显著统计学意义(P<0.05)。说明,重组人红细胞生成素与β-七叶皂甙钠联合抑制Ca2+的作用,能起到抑制脊髓组织损伤的效果。
综上,重组人红细胞生成素与β-七叶皂甙钠联合治疗有助于改善BBB运动功能评分,促进大鼠运动功能恢复。可以阻止局部Ca2+聚集致超载引起SCI对神经细胞继发性损伤,阻止Mg2+浓度下降,有效改善局部Ca2+超载以及能量代谢状态,延缓神经细胞继发性损伤的发展。
参考文献:
[1] 史志勤,卞红磊,魏艳静,等.重组人红细胞生成素对癫痫持续状态大鼠海马线粒体凋亡途径相关调控因子的影响及作用机制[J].中国全科医学,2015,18(19):2310-2316.
Shi ZQ,Bian HL,Wei YJ,etal.Effect of recombinant human erythropoietin on related regulators of mitochondrial apoptosis pathway in hippocampus of rats with status epilepticus[J].Chin General Practice,2015,18(19):2310-2316.
[2] 汤海玲,范丽梅.多发性骨髓瘤小鼠注射重组鼠源促红细胞生成素后对免疫功能的影响[J].西安交通大学学报(医学版),2015,36(4):487-490.
Tang HL,Fan LM.Effect of recombinant murine erythropoietin on immune function in multiple myeloma mice[J].J Xi'an Jiaotong Uni(Medical Science),2015,36(4):487-490.
[3] 陈艳霞,吴险峰,房向东,等.重组人红细胞生成素对高糖诱导人肾小管上皮细胞增殖及凋亡的影响及其可能机制[J].天津医药,2015,36(1):25-29.
Chen YX,Wu XF,Fang XD .etal.Effects of recombinant human erythropoietin on proliferation and apoptosis of human renal tubular epithelial cells induced by high glucose and its possible mechanism[J].Tianjin Med,2015,43(1):25-29.
[4] 潘振华,徐院花,田 田,等.重组人红细胞生成素对大鼠癫痫持续状态诱导的神经元凋亡的保护机制[J].江苏医药,2015,43(16):1877-1880.
Pan ZH,Xu YH,Tian T,etal.Protective mechanism of recombinant human erythropoietin on neuronal apoptosis induced by status epilepticus in rats[J].Jiangsu Yiwu,2015,43(16):1877-1880.
[5] Nystrom B,Berglund JE,Bergquist E.Methodological analysis of an experimental spinal cord compression model in the rat[J].Acta Neurol Scand,1998,78(2):460-463.
[6] 卞中国,钱志远,沈合春,等.重组人红细胞生成素对大鼠颅脑损伤后脑核因子-κB活性和表达的影响[J].中华实验外科杂志,2013,30(12):2768.
Bian ZG,Qian ZY,Shen HC,etal.Effects of recombinant human erythropoietin on the activity and expression of NF-κB after traumatic brain injury in rats[J].Zhonghua Chuan surgical,2013,30(12):2768.
[7] 吴玉杰.沈康平,金文杰.β-七叶皂甙钠对脊髓损伤大鼠神经功能的保护作用[J].上海交通大学学报(医学版),2007,27(8):913-914.
Wu YJ,Shen KP,Jin WJ.Protective effect of β-aescinate on neural function in rats with spinal cord injury[J].J Shanghai Jiaotong Uni,2007,27(8):913-914.
[8] Rivlin AS,Tator CH. Objective clinical assessment of motor fuction after experimental spinal cord injury in the rat[J].J Neurosurg,1977,47(4):577-581.
[9] 赵 鹏,纪忠义,杨 震,等.七叶皂苷钠联合碱性成纤维生长因子对大鼠脊髓损伤神经保护作用的实验研究[J].中国社区医师,2013,15(3):7-8.
Zhang P,Ji ZY,Yang Z ,etal.Experimental study on neuroprotective effects of sodium aescinate combined with basic fibroblast growth factor on spinal cord injury in rats[J].Chin Community Physicians,2013,15(3):7- 8.
[10] 朱庆茂,蒋电明,孟纯阳,等.LPS预处理通过Nrf2介导对脊髓损伤的保护作用[J].中国免疫学杂志,2015,31(2) :197-203.
Zhu QM,Jiang DM,Meng CY,etal.Study on the protective effect of LPS preconditioning on spinal cord injury mediated by Nrf2[J].Chin J Immunol ,2015,31(2):197-203.
[11] 丁 勇,吴玉杰,傅智轶,等.β-七叶皂甙钠对脊髓损伤大鼠保护作用的实验研究[J].中国骨科临床与基础研究杂志,2012,4(6):441-442.
Ding Y,Wu YJ,Fu ZY,etal.Experimental study on the protective effect of β-aescinate on rats with spinal cord injury[J].Chin J Orthoped Clin Res ,2012,4(6):441-442.
[12] 毛 敏,张 婷,刘 滢,等.三种不同脊髓机械性损伤对大鼠继发性神经细胞凋亡的影响研究[J].中国免疫学杂志,2015,31(11) :1461-1464.
Mao M,Zhang Ting,Liu Yingetal.Effects of Three Different Spinal Cord Mechanisms on apoptosis of secondary neurons in rats[J].Chin J Immunol ,2015,31(11):1461-1464.
[13] 陈通恒,周子伟,李盛杰,等.重组人红细胞生成素改善小鼠颅脑创伤后认知功能的机制探讨[J].中国现代神经疾病杂志,2013,13(2):142-148.
Chen TH,Zhou ZW,Li SJ,etal.Mechanism of recombinant human erythropoietin in improving cognitive function after traumatic brain injury in mice[J].Acta Metallurgica Sinica,2013,13(2):142-148.
[14] 庄丽丽,李晓宾,李传玲,等.急性脑梗死后白细胞介素6与神经功能缺损评分的相关性及β-七叶皂甙钠的治疗作用[J].中华老年心脑血管病杂志,2014,16(8):840-842.
Zhuang LL,Li XB,Li CL,etal.Correlation between interleukin-6 and neurological deficit scores after acute cerebral infarction and the therapeutic effect of beta-aescinate[J].Zhonghua Elderly Cardiovascular Cerebrovascular Dis ,2014,16(8):840-842.
[15] 王 保,尧新华,肖珍科,等.鞘内β-七叶皂甙钠对神经病理性疼痛大鼠脊髓背角细胞因子的影响[J].广州医科大学学报,2016,44(2):6-8.
Wang B ,Yao XH,Xiao ZK,etal.Effect of intrathecal β-aescinate on cytokines in dorsal horn of spinal cord in rats with neuropathic pain[J].Guangzhou Med Uni ,2016,44(2):6- 8.
[16] 胡 杨,郑启新,秦 文.促红细胞生成素对大鼠脊髓损伤后caspase-3表达及神经细胞凋亡的影响[J].生物骨科材料与临床研究,2008,5(6):14-16,21.
Hu Y,Zheng QX,Qin W.Effects of erythropoietin on caspase-3 expression and neuronal apoptosis after spinal cord injury in rats[J].Physiol Orthoped ,2008,5(6):14-16,21.
[17] 谢金元,郑启新,郭晓东,,等.重组人红细胞生成素对大鼠背根神经节细胞钙通道的调节作用[J].中华实验外科杂志,2007,24(6):727-730.
Xie JY,Zheng QX,Guo XD,etal.Regulatory effect of recombinant human erythropoietin on calcium channel in rat dorsal root ganglion cells[J].Zhonghua Experimental Surg ,2007,24(6):727-730.
[18] 任宪盛,杨有庚,焦静雪.重组人促红细胞生成素对大鼠脊髓损伤后脂质过氧化的影响[J].中国临床康复,2006,10(44):78-80.
Ren XS,Yang Y ,Jiao JX.Effects of recombinant human erythropoietin on lipid peroxidation after spinal cord injury in rats[J].China J Clin Rehabilit ,2006,10(44):78-80.
[19] 霍 岩,沈兆亮,王 冬,等. 重组人促红细胞生成素对大鼠脊髓损伤后NF-κB表达的影响[J].解剖科学进展,2012,18(2):70-73.
Huo Y ,Shen ZL,Wang D ,etal.Effect of recombinant human erythropoietin on NF-κB expression after spinal cord injury in rats[J].Adv Anatomy,2012,18(2):70-73.