腹腔热灌注化疗联合腹部射频热疗对老年晚期卵巢癌患者的疗效分析*
2018-04-20王爱红赵菊梅房德芳房新建王明全
王爱红 赵菊梅 杜 娟 房德芳 房新建 王明全
(延安大学医学院及延安市肿瘤防治研究重点实验室,延安 716000)
卵巢癌是妇科常见恶性肿瘤,死亡率高,且早期不易发觉,75%的卵巢癌确诊时已属晚期,无法实施根治性手术,即使初治有效,但复发率较高,其死亡率居于妇科恶性肿瘤之首。因此,对于晚期卵巢癌采用术前新辅助化疗及细胞减灭术(Cytoreductive surgery,CRS)来减小肿瘤体积,减轻临床症状,改善预后[1]。然而晚期卵巢癌患者多已存在腹腔转移及积液,而细胞减灭术并不能完全去除腹腔转移病灶,大大降低了手术效果。随着肿瘤生物学行为研究的深入和治疗技术进步,以细胞减灭术联合腹腔热灌注化疗(Intraperitoneal perfusion chemotherapy,IPHC)的治疗策略逐渐在临床上推广应用[2]。其中IPHC是将热疗与化疗结合的治疗方法,被应用于腹、盆腔肿瘤来源的腹膜癌,取得了较好的疗效。但临床上关于CRS、IPHC联合腹部局部射频热疗治疗晚期卵巢癌的临床报道较少。我院自2015年6月将CRS、IPHC联合腹部局部射频热疗应用于老年晚期卵巢癌患者的治疗中,疗效较好。本研究通过观察其对老年晚期卵巢癌患者CA125、HE4和YKL及免疫功能指标的影响,旨在评价其疗效机制及安全性。
1 资料与方法
1.1临床资料 选择2015年6月~2016年8月于连云港市第二人民医院肿瘤科住院治疗的晚期卵巢癌患者72例作为研究对象。所有患者均符合以下纳入标准:①年龄在60~74岁的年轻老年人(据联合国世界卫生组织提出新的年龄分段);②经病理组织学确诊,TNM分期为Ⅲ~Ⅳ期,无法行根治性手术或手术后复发;③腹腔内无黏连;④预计生存期≥6个月,KPS评分≥70分;⑤患者及家属知情同意。排除标准:①合并心肺功能不全、肾功能不全者;②近1个月接受任何抗肿瘤药物治疗患者;③合并精神类疾病不能合作者;④有远处器官(肺、肝脏、脑、骨)转移者;⑤合并常规手术禁忌症者。72例患者的平均年龄(67.5±8.2)岁;TNM分期:Ⅲ期47例,Ⅳ期25例;病理分型:浆液性囊腺癌34例,黏液性囊腺癌19例,混合性上皮癌15例,透明细胞癌4例。采用随机数字表法将72例患者随机分为对照治疗组和联合治疗组,每组36例。两组在年龄、TNM分期、病理分型等一般资料方面差异无统计学意义(P>0.05),具有可比性(见表1)。本研究经我院伦理委员会同意。
1.2方法 所有患者入组前均行新辅助化疗2~3个周期。具体方案采用紫杉醇150 mg/m2+顺铂70 mg/m2(TP)化疗。28 d为一个周期。
在排除手术禁忌症后,对照治疗组患者给予CRS联合IPHC治疗,其中CRS按照肝圆韧带、大网膜、小网膜、右上腹、左上腹、膈面腹膜、侧壁腹膜、右骼窝、左骼窝、盆底腹膜和小肠系膜的顺序行最大程度的CRS,对壁层腹膜行区域性整片剥脱术,对病变肠道行肠管切除术。对于与重要器官黏连的肿瘤可以用球形电刀气化、碳化肿瘤组织。闭合式IPHC:将灌注导管置入腹腔,入口管位于膈肌下方,出口管位于盆腔。首先以43℃生理盐水冲洗腹腔,恒温后加入化疗药物,以顺铂80 mg+地塞米松10 mg+生理盐水1 800 ml经腹腔灌注化疗仪加热至43~45℃后快速滴入腹腔,灌注时间为60 min。随后用2~3 L 平衡盐溶液清洗腹腔。隔日第2次热灌注化疗后拔除灌注治疗相关组件。术后第28天在常规腹腔穿刺下行第2次腹腔热灌注化疗,用药及方法同前。
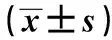


IndexContrasttreatmentgroup(n=36)Combinedtreatmentgroup(n=36)t/χ2PAge67.2±9.167.8±9.70.271>0.05TNMstaging0.551>0.05PhaseⅢ2225PhaseⅣ1411Pathologicclassification0.333>0.05Serouscystadenocarcinoma1618Mucinouscystadenocarcinoma118Mixedepithelialcancer69Transparentcellcarcinoma31SurgicalconditionsOperationtime(min)159.2±23.5165.3±21.61.147>0.05Intraoperativebloodloss(ml)539.2±121.8521.7±112.50.633>0.05Ascites(ml)638.2±137.6687.9±121.31.626>0.05
联合治疗组在行对照治疗组治疗基础上联合腹部局部射频热疗:采用SR-1000射频热疗机进行。治疗前测量患者体厚,根据患者体厚,选择合适厚度的极板、水袋。热疗机功率600~800 w,肛门放置测温线并记录,温度设定为43℃,时间60~90 min。以冰袋保护患者手术瘢痕、脐部及皮下脂肪,防止烫伤。隔日第2次热灌注化疗后行第2次热疗。第2个疗程方法同前。
两组术后继续给予TP方案化疗:紫杉醇150 mg/m2+顺铂70 mg/m2,28 d为一个周期,具体化疗、腹腔热灌注化疗及热疗疗程根据患者病情而定。
1.3观察指标
1.3.1手术情况 观察比较两组的术中出血量、术中腹水量、手术时间、术后感染率。
1.3.2临床疗效 所有患者2个疗程后复查腹部、盆腔CT或MRI、血清CA125水平,评价疗效。腹水控制:参照WHO恶性肿瘤不可测量病变疗效评定标准[3]:腹水完全吸收或明显减少(>50%以上)持续4周以上为有效,腹水减少不明显(腹腔积液减少不足50%,增加不到25%并至少维持4周以上)或腹水增多(腹腔积液增加超过25%以上)为无效。疗效评定:①完全缓解(CR):复查时各项生化指标结果均显示正常,肿瘤完全消失且未见新发病灶;②部分缓解(PR):肿瘤体积明显缩小>50%且未见新发病灶;③稳定(SD):肿瘤体积增大≤25%,且未出现新发病灶;④进展(PD):肿瘤体积增大>25%或可见新发病灶出现。以CR和PR之和除以总例数为临床总有效率,比较两组患者治疗后临床总有效率。
1.3.3血清CA125、HE4、YKL水平 所有患者术前及2个疗程后采集空腹肘静脉血5 ml,分离血清,以酶联免疫吸附法检测HE4、YKL水平,电化学发光免疫法检测CA125水平。
1.3.4免疫功能指标 术前及2个疗程后采集外周静脉血测定T细胞亚群水平,包括CD3+、CD4+、CD8+、CD4+/CD8+指标。
2 结果
2.1两组患者一般资料及手术情况比较 两组患者年龄、TNM分期、病理分型差异无统计学意义(P>0.05)。所有患者均手术顺利,两组的手术时间、术中出血量和腹水量之间的差异均无统计学意义(P>0.05)。见表1。
2.2临床疗效 对照治疗组术后平均腹腔热灌注化疗(6.3±2.1)次,平均全身化疗(6.8±2.3)次,联合治疗组平均腹腔热灌注化疗(7.2±2.3)次,平均全身化疗(7.5±1.9)次,平均热疗(6.2±1.7)次。两组的平均腹腔热灌注化疗次数及全身化疗次数无统计学差异(P>0.05)。
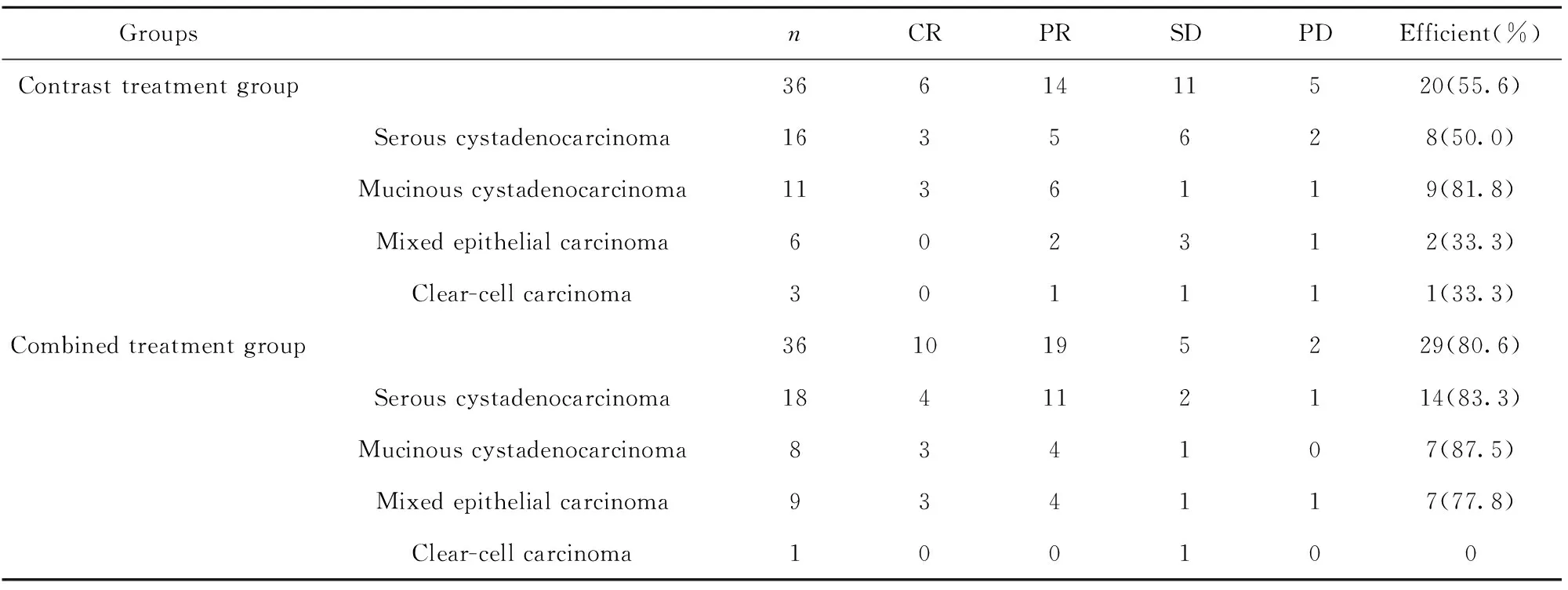
联合治疗组患者临床总有效率为80.6%,显著优于对照治疗组的55.6%,差异具有显著的统计学意义(χ2=5.175,P<0.01)。各病理类型疗效比较,联合治疗组对浆液性囊腺癌、黏液性囊腺癌、混合性上皮癌的总有效率均较高于对照治疗组,但差异均无统计学意义(P>0.05)。其中联合治疗组中25例有腹水者有效20例(80.0%),对照治疗组21例有腹水者有效11例(52.4%),联合组的腹水控制有效率显著高于对照治疗组,差异有统计学意义(χ2=3.962,P<0.05)。见表2。
2.3两组血清CA125、HE4、YKL水平 治疗前,两组的CA125、HE4、YKL水平之间的差异均无统计学意义(P>0.05)。治疗后,两组的CA125、HE4、YKL均较治疗前显著降低,且联合治疗组下降程度较对照治疗组更加显著,差异均有统计学意义(P<0.05)。见表3。
2.4两组免疫功能指标的比较 治疗前,两组的CD3+、CD4+、CD8+、CD4+/CD8+水平之间的差异均无统计学意义(P>0.05)。治疗后,两组的CD3+、CD4+、CD4+/CD8+均较治疗前提高,CD8+较治疗前降低,且联合治疗组各指标改善程度较对照治疗组更加显著,差异均有统计学意义(P<0.05)。见表4。
2.5安全性 两组的毒副反应均主要为骨髓抑制、消化道反应及肝肾功能损伤,未发生其他严重不良反应。两组的不良反应之间的差异无统计学意义(P>0.05)。见表5。
表2两组临床疗效比较(n)
Tab.2Comparisonofclinicalefficacyoftwogroups
GroupsnCRPRSDPDEfficient(%)Contrasttreatmentgroup3661411520(55.6)Serouscystadenocarcinoma1635628(50.0)Mucinouscystadenocarcinoma1136119(81.8)Mixedepithelialcarcinoma602312(33.3)Clear-cellcarcinoma301111(33.3)Combinedtreatmentgroup3610195229(80.6)Serouscystadenocarcinoma184112114(83.3)Mucinouscystadenocarcinoma834107(87.5)Mixedepithelialcarcinoma934117(77.8)Clear-cellcarcinoma100100
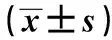


GroupsnCA125(U/ml)HE4(pmol/L)YKL(μg/L)Contrasttreatmentgroup36Beforetreatment462.7±73.5472.9±38.6136.5±21.6Aftertreatment157.3±71.21)182.7±21.91)72.1±16.31)Combinedtreatmentgroup36Beforetreatment471.8±82.3469.5±31.7138.9±23.5Aftertreatment106.5±26.71)2)126.3±23.51)2)56.1±15.91)2)
Note:Compared with the before treatment,1)P<0.05;compared with the contrast treatment group,2)P<0.05.
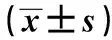
Tab.4Comparisonofimmunologicfunctionoftwogroups

GroupnCD3+(%)CD4+(%)CD8+(%)CD4+/CD8+Contrasttreatmentgroup36Beforetreatment0.51±0.050.41±0.040.34±0.061.21±0.11Aftertreatment0.56±0.061)0.43±0.051)0.31±0.031)1.39±0.131)Combinedtreatmentgroup36Beforetreatment0.50±0.060.42±0.030.33±0.041.27±0.12Aftertreatment0.63±0.071)2)0.47±0.071)2)0.28±0.031)2)1.68±0.151)2)
Note:Compared with before treatment,1)P<0.05;compared with the contrast treatment group,2)P<0.05.
表5两组毒副反应比较(n)
Tab.5Comparisonoftoxicandsideeffectsoftwogroups

AdversereactionsContrasttreatmentgroup0Ⅰ-ⅡⅢ-ⅣCombinedtreatmentgroup0Ⅰ-ⅡⅢ-ⅣZPNauseaandvomiting21150191700.471>0.05Lossofappetite13185102060.723>0.05Leukopenia21123201330.211>0.05Thrombocytopenia2781251100.442>0.05Liverdamage333035101.022>0.05Renalimpairment360035101.000>0.05
3 讨论
卵巢癌早期不易察觉,较多的患者在发现时已属晚期,因此无法进行根治性手术。近年来新辅助化疗联合细胞减灭术对晚期卵巢癌的疗效较好[4]。但晚期卵巢癌因其易通过直接蔓延和腹腔种植导致腹腔及盆腔转移,形成癌性腹水,并进一步影响治疗效果,且细胞减灭术本身无法取出腹腔内的转移病灶,并同时存在病灶扩散的可能,因此增加了术后复发的风险。且常规的全身化疗方法到达腹腔的浓度较低,不足以杀灭肿瘤细胞。因此腹腔灌注化疗成为治疗晚期乳腺癌的重要途径。根据癌细胞的不耐热特点,腹腔热灌注化疗逐渐应用于临床,即使是局部热疗,亦能对肿瘤的原发灶、转移灶产生免疫刺激作用,并可进一步通过降低肿瘤细胞对化疗药物的多重耐药性,从而提高临床疗效。Tentes等[5]观察了CRS联合IPHC用于原发或复发性卵巢癌并弥漫性腹膜转移的患者,平均生存期为(30±6)月,5年总生存率为54%。中位生存期为24个月,疗效良好。任红娟等[6]对妇科恶性肿瘤来源腹膜癌患者,采取CRS联合HIPEC治疗方法,能够显著延长患者生存率,且安全性较好。刘贤莲[7]报道CRS联合HIPEC治疗后,卵巢癌患者的血清恶性生物学指标较常规静脉化疗组显著降低,田兆华等[8]观察了CRS联合HIPEC有助于抑制卵巢癌血管新生,提升细胞免疫功能,且显著提高卵巢癌患者的远期生存率[9]。CRS+HIPEC可延长晚期卵巢癌Ⅲc期患者生存时间,并不显著增加严重不良事件[10]。特别是对于老年卵巢癌患者,因其免疫力及耐药等因素使卵巢癌复发的风险更高[11,12]。因此,将CRS联合IPHC用于老年晚期卵巢癌有望提高临床疗效。
根据腹腔热灌注化疗的治疗机制,本研究在CRS、IPHC基础上进一步联合应用腹部局部射频热疗治疗老年晚期卵巢癌患者,进一步加强了局部热效应对肿瘤细胞的杀伤作用。结果显示,两组的手术时间、术中出血量和腹水量之间的差异均无统计学意义,CRS手术效果一致。在手术效果一致的基础上,进一步比较两组的临床疗效,显示联合治疗组治疗后其临床总有效率为80.6%,显著优于未联合热疗的对照治疗组的55.6%(χ2=5.175,P<0.01),且联合治疗组中腹水控制率达到80.0%,显著高于对照治疗组的52.4%(χ2=3.962,P<0.05)。说明热疗能进一步提高CRS、IPHC的疗效。其主要作用机制可能与以下因素有关[13]:持续循环的热灌注可对腹腔内的游离癌细胞起到机械性冲刷作用;热效应能在分子水平上使癌细胞膜蛋白变性,干扰蛋白质、DNA、RNA的合成,也能在细胞水平上激活溶酶体,诱导肿瘤细胞凋亡,还能在组织水平上,抑制癌组织内血管的生长,使肿瘤组织缺氧、酸中毒、营养障碍,从而变性坏死;热效应可增强化疗药的渗透性;热疗可使机体免疫功能增强,刺激机体免疫系统产生特异性免疫反应,从而增加抗肿瘤作用。即使是局部热疗,对肿瘤的原发灶和转移灶也能产生免疫刺激作用。
人体免疫功能的降低与肿瘤细胞的增殖、转移及临床预后密切相关。T细胞是人体中重要的免疫细胞,T细胞表面不同的细胞分化群(CD)可作为分类标志。其中CD3分子主要表达于成熟T细胞表面,用于成熟T细胞的检测。CD4+、CD8+是T细胞的重要组成部分,中晚期卵巢癌患者存在免疫抑制现象[14],呈现CD4+水平降低,CD4+/CD8+比值降低。通过观察CD3+、CD4+、CD4+/CD8+水平的变化,可对恶性肿瘤患者进行疗效评估[15]。本研究结果显示,两组的CD3+、CD4+、CD4+/CD8+治疗后均较治疗前提高,且联合治疗组各指标改善程度较对照治疗组更加显著,说明经治疗两组的免疫抑制均得到改善,而且联合局部热疗对患者免疫功能的提高作用更显著。
血清糖类抗原125(CA125)、人附睾蛋白4(HE4)、甲壳质酶蛋白(YKL)均是卵巢癌诊断的特异性指标,常用于卵巢癌的早期诊断、治疗效果及预后判断[16]。CA125在浆液性卵巢癌中具有高度表达性,随着卵巢癌的进展呈升高趋势。HE4在正常卵巢组织中不表达,而在卵巢恶性肿瘤中高表达,且与卵巢癌患者的生存期有关[17]。YKL与肿瘤细胞增殖、分化、转移和细胞外组织重塑有关,高水平的YKL提示患者预后不良。本研究结果显示,治疗后两组的CA125、HE4、YKL均较治疗前显著降低,且联合治疗组下降程度较对照治疗组更加显著(P<0.05),提示在CRS、IPHC基础上联合腹部局部射频热疗显著降低了患者CA125、HE4、YKL等肿瘤标志物的水平,抑制了肿瘤细胞的生长,改善患者预后,且临床安全性较好,未增加毒副反应的发生率。
综上,CRS、IPHC细胞减灭术联合腹部局部射频热疗能显著改善卵巢癌的免疫抑制,降低CA125、HE4、YKL水平,提高老年晚期卵巢癌患者的近期临床疗效,但由于本研究仅为初步的疗效研究,且样本量较少,其抗肿瘤及免疫调节机制尚需进一步探讨。
参考文献:
[1] 谭细凤,李怀芳,谷雨枫,等.新辅助化疗联合肿瘤细胞减灭术治疗晚期上皮性卵巢癌的随访观察[J].实用妇产科杂志,2017,33(1):62-65.
Tan XF,Li HF,Gu YF,etal. A follow-up study of neoadjuvant chemotherapy combined with tumor cell reduction in the treatment of advanced epithelial ovarian cancer[J]. J Practical Obstetrics Gynecol,2017,33(1):62-65.
[2] 李 雁,周云峰,梁 寒,等.细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[J].中国肿瘤临床,2015,42(4):198-206.
Li Y,Zhou YF,Liang H,etal. The expert consensus on the treatment of peritoneal surface tumor with cytoreductive surgery and intraperitoneal hyperthermic infusion chemotherapy[J].Chin J Clin Oncol,2015,42(4):198-206.
[3] 汤钊猷.现代肿瘤学[M].第2版.上海:上海复旦大学出版社,2000:483.
Tang Zhaoyou.Modern oncology[M].The 2 edition.Shanghai: Shanghai Fudan University Press,2000:483.
[4] Glasgow MA,Yu H,Rutherford TJ,etal. Neoadjuvant chemotherapy (NAGT) is an effective way of managing elderly women with advanced stage ovrain cancer (FTGO Stage III and IV) [J].J Surg Oncol,2013,107(2):195-200.
[5] Tentes A A,Kakolyris S,Kyziridis D,etal. Cytoreductive surgery combined with hpyerthermic intraperitoneal intraoperative chemotherapy in the treatment of advanced epithelial ovarian cancer[J].J Oncol,2012,2012:358341.
[6] 任红娟,李 鹏.肿瘤细胞减灭术联合腹腔热灌注化疗术治疗晚期妇科恶性肿瘤来源腹膜癌患者的效果及安全性[J].广东医学,2016,37(22):3440-3444.
Ren HJ,Li P.Effect and safety of tumor cell subtraction combined with intraperitoneal perfusion chemotherapy in the treatment of advanced gynecologic malignant tumor derived from peritoneal carcinoma[J].Guangdong Medical J,2016,37(22):3440-3444.
[7] 刘贤莲,杨 蕾.细胞减灭术辅助术后腹腔热灌注化疗联合静脉化疗对卵巢癌患者血清恶性生物学指标的影响[J].海南医学院学报,2015,21(10):1411-1414,1417.
Liu XL,Yang L.Effect of intraperitoneal hyperthermic infusion chemotherapy combined with intravenous chemotherapy on serum malignant biological indexes of ovarian cancer patients after cytoreductive surgery[J]. J Hainan Medical University,2015,21(10):1411-1414,1417.
[8] 田兆华,苗凤台,李晓丽,等.细胞减灭术联合腹腔热灌注化疗对卵巢癌患者血管新生和免疫功能指标影响的临床研究[J].中国现代医学杂志,2015,25(23):91-94.
Tian ZH,Miao FT,Li XL,etal. Clinical study on the effect of cytoreductive surgery combined with intraperitoneal hyperthermic chemotherapy on angiogenesis and immune function in patients with ovarian cancer [J].China J Modern Medicine,2015,25(23):91-94.
[9] 卞翠翠,陈涛利,杨 雷,等.卵巢癌肿瘤细胞减灭术后腹腔热灌注联合静脉化疗疗效分析[J].中国妇幼保健,2015,30(5):791-793.
Bian CC,Chen TL,Yang L,etal. Analysis of the efficacy of intraperitoneal hyperthermic perfusion combined with intravenous chemotherapy after tumor cell reduction in ovarian cancer [J].Maternal Child Health Care China,2015,30(5):791-793.
[10] 卢玉兰,李 蓁,李 雁,等.细胞减灭术中腹腔热灌注化疗治疗卵巢癌Ⅲc期的疗效观察[J].武汉大学学报(医学版),2015,36(4):562-567.
Lu YL,Li Z,Li Y,etal. Efficacy of intraperitoneal hyperthermic infusion chemotherapy in the treatment of stage Ⅲ c ovarian cancer[J].Medical J Wuhan University,2015,36(4):562-567.
[11] Rustin GJS,van der Burg MEL,Griffin CL,etal. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): a randomized trial[J].Lancet,2010,376(9747):1155-63.
[12] 韦佩佳.老年复发卵巢癌患者预后影响因素[J].中国老年学杂志,2014,34(8):2081-2082.
Wei PJ.Prognostic factors in elderly patients with recurrent ovarian cancer[J].Chin J Gerontol,2014,34(8):2081-2082.
[13] Omar MR,Masayuki N,Subramaniam R,etal.Resection of the primary tumor improves survival in metastatic breast cancer by reducing overall tumor burden[J].Surgery,2013,153(6):771-778.
[14] 苏 静.静脉联合腹腔热灌注化疗对晚期卵巢癌疗效及免疫功能的影响[J].中国现代医学杂志,2014,24(10):107-109.
Su J.Effect of intravenous combined intraperitoneal perfusion chemotherapy on the efficacy and immune function of advanced ovarian cancer [J].China J Modern Medicine ,2014,24(10):107-109.
[15] 顾佳颖,胡春梅,石 光,等.CD4+、CD8+细胞水平变化与恶性肿瘤疗效的关系[J].中国老年学杂志,2015,35(22):6454-6455.
Gu JY,Hu CM,Shi G,etal.The relationship between the changes of CD4+,CD8+cell level and the curative effect of malignant tumor[J].Chin J Gerontol,2015,35(22):6454-6455.
[16] 侯娟娟,虎淑妍,刘婷婷,等.血清肿瘤标志物在卵巢癌早期诊断中的临床价值[J].中国免疫学杂志,2014,30(8):1101-1104,1107.
Hou JJ,Hu SY,Liu TT,etal.Clinical value of serum tumor markers in early diagnosis of ovarian cancer[J].Chin J Immunol,2014,30(8):1101-1104,1107.
[17] Kalapotharakos G,Asciutto C,Henic E,etal. High preoperative blood levels of HE4 predicts poor prognosis in patients with ovarian cancer[J].J Ovarian Res,2012,5(1):20.