肠道病毒71型通过下调IRF9的蛋白水平抑制干扰素的抗病毒作用*
2018-04-20王春阳魏兰兰严琴琴严喜章杜向阳
王春阳 魏兰兰 严琴琴 严喜章 白 丹 倪 菁 杜向阳
(西安医学院临床医学院,西安 710021)
肠道病毒71型(Enterovirus 71,EV71)是引起手足口病的主要病原体。EV71属于小RNA病毒科,肠道病毒属,单股正链RNA病毒。近年来因其会引起重症患儿神经系统并发症甚至死亡而引起国内外广泛关注。大部分EV71感染的患儿主要表现为手足口臀部的疱疹,一周内可自愈。少部分病例会出现神经系统并发症,如脑干脑炎、脊髓灰质炎样麻痹,甚至出现神经源性肺水肿、肺出血,最终危及生命。目前临床上针对EV71感染的治疗主要为对症治疗和支持治疗,尚无有效的抗病毒药物以及上市的疫苗。尽管几十年来干扰素(Interferon,IFN)作为临床一线的抗病毒药物被用来治疗多种病毒的感染,但临床上用IFN治疗EV71感染的效果却并不显著[1]。并且体外实验表明,只有高剂量提前应用IFN才能对EV71感染的Vero细胞有一定的保护作用[2]。因此EV71必然存在可以拮抗IFN-β反应的机制。
IFN-β发挥其抗病毒作用依赖于JAK-STAT信号通路。IFN-β首先与其受体结合,引起与受体相连的JAK激酶磷酸化,进一步诱导下游STAT1和STAT2的磷酸化,然后与胞浆中的IRF9一起组合成磷酸化的复合物ISGF3,ISGF3入核诱导成千上万的抗病毒基因(ISGs)的表达[3,4]。
迄今为止,对EV71感染后抑制JAK-STAT信号通路的具体机制仍不明确,亟待进一步研究。Lu等[5]的研究发现EV71 2A 蛋白能够裂解IFN受体IFNAR1,降低IFN与其受体的结合,从而抑制IFN的下游信号通路。然而,另外一项研究表明,EV71并不是通过降低干扰素受体IFNAR1的蛋白水平,而是通过降低JAK1的蛋白水平,来阻断Ⅰ型IFN的反应[6]。本研究旨在通过研究JAK-STAT信号通路,探究EV71感染抑制IFN-β抗病毒作用的具体机制,从而为今后EV71感染的治疗提供思路。
1 材料与方法
1.1材料
1.1.1细胞和病毒 人横纹肌肉瘤RD 细胞购自美国典型培养物中心(American type culture collection,ATCC); EV71病毒(阜阳株)由江苏省疾病预防与控制中心惠赠。
1.1.2试剂和仪器 反转录试剂盒、SYBR荧光定量PCR试剂盒购于TaKaRa公司;Anti-phosphorylated STAT1抗体、Anti-STAT1、Anti-histone H1、Anti-IRF-9 (D2T8M) 抗体购自美国Cell signaling公司;Anti-GAPDH抗体及辣根过氧化物酶标记的山羊抗小鼠IgG购自武汉巴傲得生物科技有限公司;StepOneTMReal-time PCR 仪器为美国ABI公司产品;NANODROP 2000核酸定量仪为美国Thermo公司产品;凝胶成像仪和水平电泳仪为美国Bio-Bad公司产品。
1.2实验方法
1.2.1细胞分组 本实验分为4组,包括正常对照组(Control组)、EV71病毒对照组(EV71组)、仅有IFN-β处理组(IFN-β组)、EV71+IFN-β处理组(EV71+IFN-β组)。
1.2.2免疫印迹检测 EV71以MOI为1感染RD细胞,为感染组做对照,24 h后,加入IFN-β(终浓度为20 ng/ml)共同孵育30 min。弃去上清,预冷的PBS洗涤3次后用1×SDS sample buffer冰上裂解细胞蛋白20 min,4℃ 12 000×g离心10 min,将上清转移至新离心管中。用于后续PAGE和Western blot实验。电泳后将细胞蛋白转移到PVDF膜上,用5%的小牛血清(BSA)室温封闭1 h,然后将膜与含一抗的封闭液一起孵育,4℃静置过夜。用TBST漂洗膜3次,每次10 min。再将膜与含二抗的封闭液一起室温孵育2 h。TBST漂洗膜3次,每次10 min。然后将膜放于凝胶成像仪中拍照。
1.2.3细胞核和细胞质蛋白分离 感染和未感染的RD细胞在IFN-β处理30 min后,根据核质抽提试剂盒(P0027,碧云天,江苏,中国)说明书先配好相关试剂,放于冰上备用。用PBS将细胞清洗3遍,然后用EDTA溶液处理细胞,离心收集细胞至新的EP管中,尽量吸尽上清,留下沉淀。然后根据试剂盒说明书进行核质蛋白抽提。将抽提的蛋白放于-70℃冻存。胞核和胞浆成分用BCA蛋白定量试剂盒进行定量,用于后续的电泳实验。
1.2.4实时荧光定量PCR(Real-time PCR)测定ISGs mRNA的表达 根据RNA提取试剂盒(Qiagen,Germany)说明书提取感染细胞和未感染细胞的总RNA。用美国Thermo公司的Nanodrop测定RNA的浓度与纯度。按照TaKaRa公司的2 Step Real-time RT-PCR逆转录试剂盒(RRO36A)说明书,取500 ng RNA反转录成cDNA。然后用获得的cDNA作为模版按照TaKaRa的SYBR荧光定量Real-time PCR试剂盒(RR420A)的说明书配制PCR反应液,然后在Applied Biosystems StepOnePlusTM仪器上进行荧光定量反应。PCR反应条件是:95℃预变性30 s,然后95℃ 5 s 60℃ 30 s,进行40个循环。内参基因选取磷酸甘油醛脱氢酶(Glyceraldehyde phosphate dehydrogenase,GAPDH)基因。每个3个孔,每次实验重复3次。基因的表达水平按照公式2(ΔCt of Gene-ΔCt of GAPDH)进行计算。各种ISGs的引物序列见表1。
1.3统计学处理 采用SPSS统计软件进行统计学分析。P<0.05表示差异有统计学意义。
2 结果
2.1EV71 抑制ISGs的产生 EV71以MOI为1感染RD细胞24 h,随后用IFN-β处理细胞,24 h后提取总RNA,并用Real-time PCR法检测ISGs的表达。结果显示,OAS1、MX1、ISG54 mRNA表达水平在EV71组和未感染组并无明显差别。IFN-β组与Control组相比,OAS1、 MX1、ISG54 mRNA表达水平明显升高,分别上调约74倍、79倍、121倍,差异有统计学意义(P<0.05);EV71+IFN-β组与Control组相比,OAS1、 MX1、ISG54 mRNA表达水平也明显升高,分别上调约27倍、29倍、73倍,差异有统计学意义(P<0.05)。但EV71+IFN-β组与IFN-β组相比,OAS1、 MX1、ISG54 mRNA表达水平明显降低,分别下降约47%、50%和48%,差异有统计学意义(P<0.05,图1),提示EV71感染抑制了IFN-β诱导的ISGs mRNA的表达。
表1ISGs的引物序列
Tab.1PrimersforISGs

GenenameForwardprimerReverseprimerβ-actinATGGATGACGATATCGCTGATGAGGTAGTCTGTCAGGTOAS1CCAAGCTCAAGAGCCTCATCTGGGCTGTGTTGAAATGTGTMX1GGGAAGGAATGGGAATCAGTCCCACAGCCACTCTGGTTATISG54AGCGAAGGTGTGCTTTGAGAGAGGGTCAATGGGCGTTCTGA
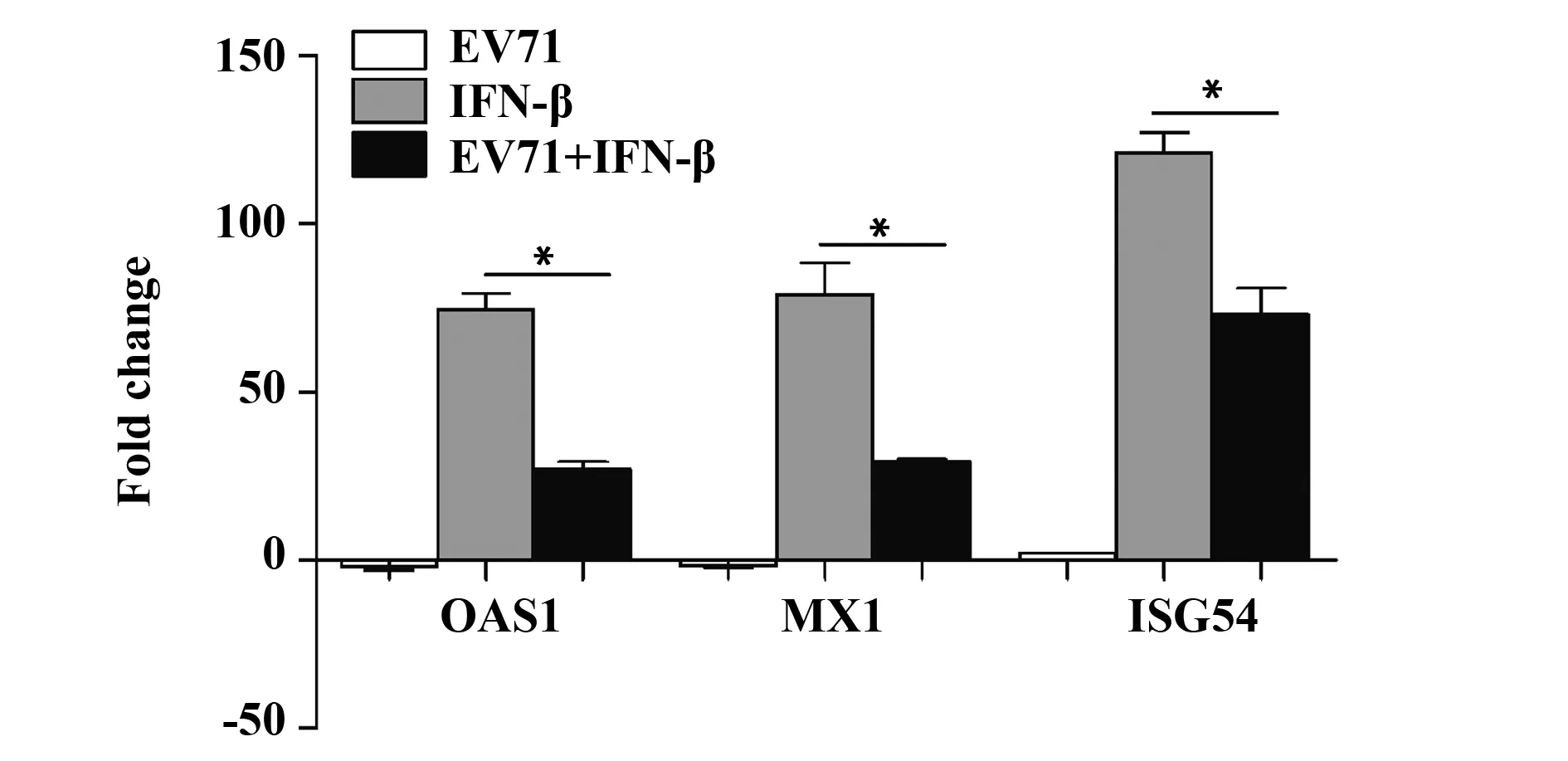
图1 EV71 抑制IFN诱导ISGs的产生Fig.1 EV71 inhibited induction of ISGs stimulated by IFN-β
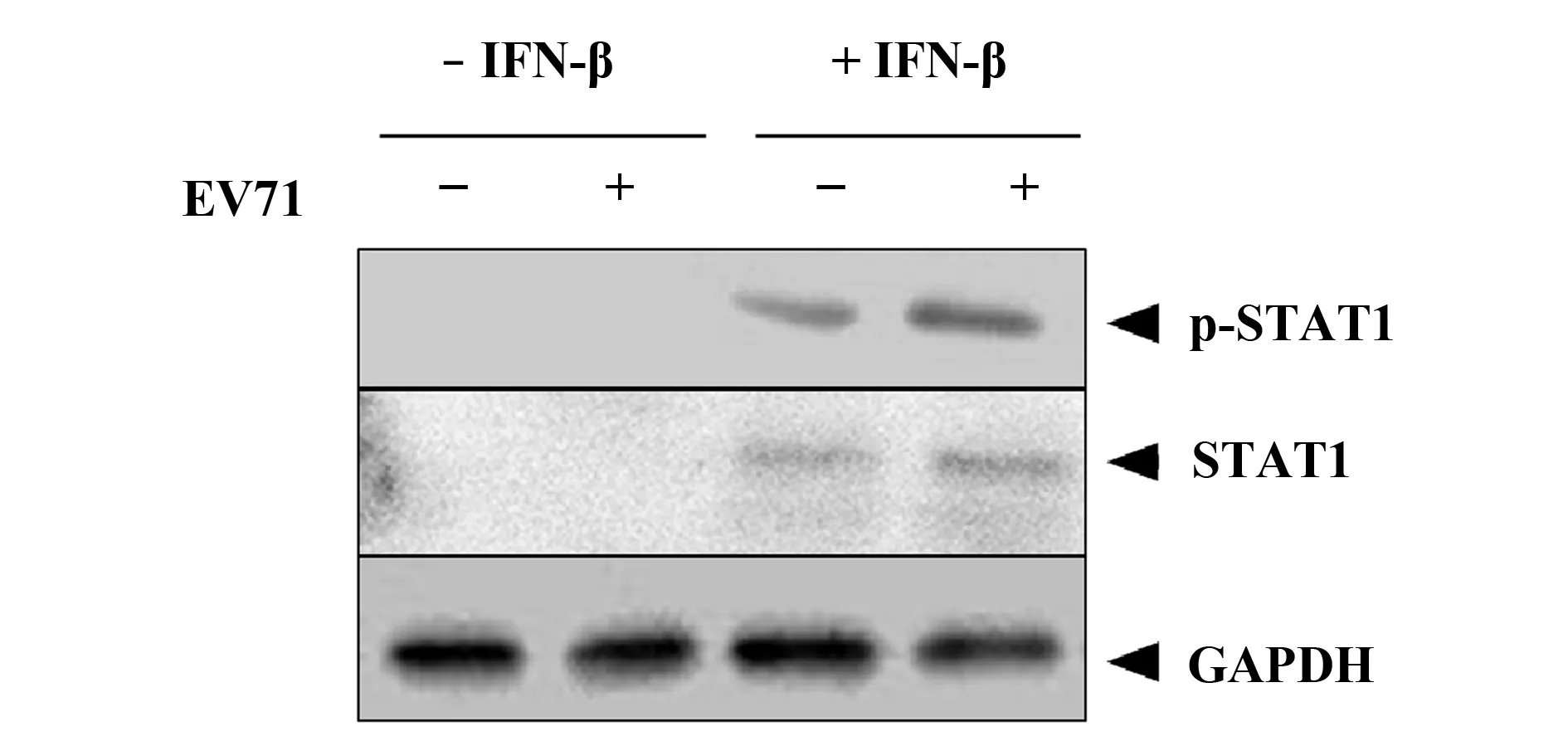
图2 EV71感染并不影响STAT1/2的磷酸化水平和蛋白水平Fig.2 EV71 did not affect phosphorylation and expression of STAT1/2
2.2EV71感染并不影响STAT1/2的磷酸化水平和蛋白水平 EV71以MOI为1感染RD细胞24 h,随后用IFN-β处理细胞,24 h后提取总蛋白,并应用免疫印迹技术检测STAT1/2的磷酸化水平和蛋白水平。结果显示,与Control组相比,IFN-β组和EV71+IFN-β组STAT1和p-STAT1的蛋白水平明显升高,表达量无明显差异(图2),提示EV71感染并不影响STAT1的蛋白水平和磷酸化过程。
2.3EV71抑制p-STAT1的入核 EV71感染RD细胞24 h后,加入IFN-β处理细胞30 min,分别提取细胞胞浆蛋白和核蛋白,用免疫印迹法检测p-STAT1在细胞中的定位情况,未感染组做对照。结果表明,IFN-β组,p-STAT1主要定位在胞核中(图3),而EV71+IFN-β组的p-STAT1主要定位在胞浆中,提示EV71可能抑制了p-STAT1的核转位。
2.4EV71感染能够降低IFN-β诱导的IRF9的表达 EV71感染RD细胞24 h后,加入IFN-β处理细胞30 min,然后提取细胞总蛋白,应用免疫印迹技术检测IRF9蛋白的表达。结果表明,在IFN-β组细胞中,IRF9的表达明显上调;而与IFN-β组相比,EV71+IFN-β组IRF9的蛋白水平明显下调(图4),提示EV71感染抑制了IFN-β诱导的IRF9的表达。

图3 EV71抑制p-STAT1的入核Fig.3 EV71 inhibited translocation of p-STAT1

图4 EV71抑制IFN-β诱导的IRF9的表达Fig.4 EV71 inhibited expression of IRF9 induced by IFN-β
综上,EV71可能是通过下调IRF9的表达来抑制IRF9与p-STAT1的相互作用,进而阻断ISGF3的核转位。
3 讨论
EV71是目前继脊髓灰质炎病毒后又一个引起神经系统并发症的肠道病毒。临床上尚无有效的抗EV71病毒的药物和疫苗。IFN-β作为天然免疫的第一道防线,因其具有广泛的抗病毒效应而在临床上被用于各种病毒感染的治疗。然而IFN-β治疗EV71感染的患儿却疗效甚微,其机制亟待研究。高剂量的IFN的确可以提高EV71感染小鼠的生存率,但是高剂量的IFN因其有不可忽视的副作用而不能用于临床。病毒在长期演化中进化出了各种各样的策略来逃逸或对抗IFN介导的宿主抗病毒免疫反应。据报道,病毒可以通过多种机制抑制IFN-β的抗病毒作用。比如流感病毒非结构蛋白NS1可以抑制STAT1/2的磷酸化,抑制下游的相关信号转导[7]。腺病毒的E1A蛋白能够降低STAT1和IRF9的蛋白水平,从而阻断ISGF3的形成[8,9]。呼肠孤病毒 μ2蛋白能促使IRF9 在细胞核内的不正常累积,导致IRF9核输出障碍[10]。目前关于EV71抑制IFN的JAK-STAT信号通路的具体机制研究尚少。Lu等[5]的研究发现EV71 2A 蛋白能够裂解IFN的受体IFNAR1,从而降低IFN与其受体的结合,抑制IFN的下游信号通路。然而,另外一项研究表明,EV71并不是通过降低IFN受体IFNAR1的蛋白水平,而是通过降低JAK1的蛋白水平,来阻断Ⅰ型IFN的反应[6]。关于EV71如何逃逸IFN的抗病毒作用仍然存在争议,因此妨碍了IFN将来用于治疗临床上的重症患者。
本研究以EV71感染人横纹肌肉瘤细胞建立感染模型,在此基础上研究了EV71与外源性IFN-β的相互作用过程。我们发现EV71感染并不影响IFN-β诱导的p-STAT1的磷酸化和其蛋白的表达,说明在IFN-β作用过程中,EV71对JAKs的激活并没有明显的影响。并且在EV71感染过程中,IFN-β虽然能够诱导STAT1 的磷酸化,但p-STAT一直停留在胞浆中,并没有入核,说明EV71能够抑制其核转位。进一步研究发现这种抑制作用可能通过下调IRF9的蛋白水平,进而抑制IRF9与p-STAT1的相互作用。
参考文献:
[1] Liu ML,Lee YP,Wang YF,etal.Type I interferons protect mice against enterovirus 71 infection[J].J Gen Virol,2005,86(Pt 12):3263-3269.
[2] Yi L,He Y,Chen Y,etal.Potent inhibition of human enterovirus 71 replication by type I interferon subtypes[J].Antivir Ther,2011,16(1):51-58.
[3] Darnell JE,Kerr IM,Stark GR.Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins[J].Science,1994,264(5164):1415-1421.
[4] Platanias LC.Mechanisms of type-I-and type-II-interferon-mediated signalling.[J].Nat Rev Immunol,2005,5(5):375-386.
[5] Lu J,Yi L,Zhao J,etal.Enterovirus 71 disrupts interferon signaling by reducing the level of interferon receptor 1[J].J Virol,2012,86(7):3767-3776.
[6] Liu Y,Zhang Z,Zhao X,etal.Enterovirus 71 inhibits cellular type I interferon signaling by downregulating JAK1 protein expression[J].Viral Immunol,2014,27(6):267-276.
[7] Jia D,Rahbar R,Chan RWY,etal.Influenza virus non-structural protein 1 (NS1) disrupts interferon signaling[J].PLoS One,2010,5(11):e13927.
[8] Leonard GT,Sen GC.Effects of Adenovirus E1A Protein on Interferon-Signaling[J].Virology,1996,224(1):25-33.
[9] Leonard GT,Sen GC.Restoration of interferon responses of adenovirus E1A-expressing HT1080 cell lines by overexpression of p48 protein.[J].J Virol,1997,71(7):5095-5101.
[10] Zurney J,Kobayashi T,Holm GH,etal.Reovirus mu2 protein inhibits interferon signaling through a novel mechanism involving nuclear accumulation of interferon regulatory factor 9[J].J Virol,2009,83(5):2178-2187.