有氧训练联合补充亮氨酸对增龄小鼠骨骼肌蛋白质代谢的影响
2018-04-20尚画雨杨力源孙君志苏全生
夏 志,赵 艳,尚画雨,杨力源,付 玉,孙君志,苏全生
有氧训练联合补充亮氨酸对增龄小鼠骨骼肌蛋白质代谢的影响
夏 志1,赵 艳1,尚画雨2,杨力源3,付 玉2,孙君志2,苏全生2
1.井冈山大学 体育学院, 江西 吉安 343009; 2.成都体育学院 运动医学与健康学院, 成都 610041; 3.成都大学 体育学院, 四川 成都 610106。
目的:探讨有氧训练联合补充亮氨酸对增龄小鼠骨骼肌蛋白质合成与降解代谢的影响及机制。方法:将32只13月龄雄性CD-1®小鼠随机纳入安静对照组(Sed组)、运动对照组(Tra组)、补充亮氨酸组(Leus组)和补充亮氨酸+训练组(Leu T组),其中,亮氨酸以5%剂量进行补充,训练方案为以自体重3%的负荷进行45 min游泳,每周训练6 天,共计8 周。采用Bradford法进行蛋白定量,Western blotting法检测蛋白表达与磷酸化率,酶联免疫吸附测定血清炎性细胞因子含量,氨基酸分析仪检测骨骼肌氨基酸谱,荧光法检测类糜蛋白酶活性。结果:有氧训练与补充5%剂量亮氨酸未显著影响小鼠体重与采食量。但蛋白总量、肌原纤维与肌浆蛋白浓度、mTORSer2448、4E-BP1Thr37/46与p70S6KThr389磷酸化率及MHCⅡ蛋白表达显著升高,Ubiquitin、Atrogin-1与MuRF-1蛋白表达以及血清促炎因子则均显著下降。此外,单纯补充亮氨酸导致了类糜蛋白酶活性的显著下降,以及骨骼肌亮氨酸、异亮氨酸和缬氨酸含量的增加,有氧训练未产生类似影响。较单纯有氧训练与补充亮氨酸而言,联合干预可产生更为显著的效果。结论:中等强度有氧训练联合补充5%亮氨酸可促进增龄小鼠在餐后状态的骨骼肌蛋白质合成,抑制降解,具有防治Sarcopenia的重要潜力,其机制可能与其对mTOR-p70S6K/4E-BP1途径功能表达的上调以及对泛素-蛋白酶体系统活性的下调有关。
有氧训练;亮氨酸;骨骼肌;衰老;蛋白质合成;蛋白质降解
骨骼肌萎缩可由慢性炎症反应、摄食量下降或体力活动不足等多种因素所诱发,但蛋白质平衡紊乱才是导致骨骼肌萎缩的直接原因[20],可能是蛋白质合成率下降、降解率升高或两者共同作用的结果[10,17]。就衰老性骨骼肌萎缩(Sarcopenia,SP)而言,其发生与发展主要由于蛋白质合成减少所致,蛋白质降解增多在其中亦有贡献:衰老骨骼肌质量的维持主要由基础(basal)和餐后(post-prandial)肌肉蛋白质合成(muscle protein synthesis,MPS)与降解(muscle protein breakdown,MPB)所调节,其中餐后刺激则是调节肌肉质量最为重要的因素。
目前临床对于SP的治疗仍无明确标准与指引,现有药物及干预手段亦未能有效应对其发生与发展[22]。为此,近年来国内外学者逐渐意识到其防治应考虑患者的“合成抵抗”(即餐后MPS下降)特点,并认为以囊括运动、营养及药物等两种或3种手段的多模式干预方式(multimodal treatment),共同对抗SP及其继发的不良影响可能具有较好效果[2,13]。其中,运动联合营养支持的非药物干预模式倍受关注,但相关研究方兴未艾[6],目前尚无公认干预策略,作用机理亦不清楚[7]。我们前期的研究表明,有氧训练和/或5%亮氨酸均能够刺激衰老骨骼肌在基础状态下的蛋白质合成,削弱蛋白质降解,抑制萎缩性病变,具有一定的抗SP潜力[2,3]。相比之下,有氧训练联合亮氨酸的作用更为显著[29],佐证了多模式干预的优势,但其对餐后状态下骨骼肌蛋白质代谢的影响则仍不清楚。本研究拟测定自然增龄小鼠骨骼肌内反映蛋白质合成代谢水平的肌原纤维蛋白质、肌浆蛋白质及游离氨基酸含量;检测蛋白质合成关键信号通路蛋白哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p70核糖体蛋白S6 激酶(p70 ribosomal protein S6 kinase,p70S6K)、真核翻译起始因子4E结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4E-BP1)及与反映骨骼肌快肌质量的肌球蛋白重链Ⅱ(Myosin heavy chain Ⅱ,MHCⅡ)表达;测定骨骼肌类糜蛋白酶活性、E3泛素连接酶肌萎缩蛋白Fbox-1(Muscle atrophy F-box,也称Atrogin-1)与肌肉环指蛋白-1(Muscle ring finger protein-1,MuRF-1)等蛋白质降解关键蛋白的表达以及血清促炎细胞因子TNF-α、IL-6与IL-1β含量,从蛋白质代谢平衡过程中合成与降解两个途径的变化,系统探讨有氧训练联合膳食补充亮氨酸对衰老所致骨骼肌萎缩的保护作用及其可能性机制。
1 材料和方法
1.1 实验动物与分组
SPF级雄性CD-1®小鼠32只,13月龄,体重48.5±0.5 g,购自成都达硕实验动物有限公司,合格证号:SCXK(川)2008-24。单笼饲养,自由摄水、进食。每周更换垫料3次,每日清洗消毒饮水瓶,室内照明控制为12 h,室温20±2 ℃,湿度50%~55%。采用区间分组法根据体重将小鼠随机纳入安静对照组(Sed组)、运动对照组(Tra组)、补充亮氨酸组(LeuS组)和补充亮氨酸+训练组(LeuT组)4个处理组,普通国标维持饲料适应性饲养1周。各组小鼠每日称量体重与采食量。
1.2 饲料配置
饲料配制方法与我们的前期报道相同:以普通国标饲料为基础,在LeuS与LeuT两处理组小鼠饲料内添加5%剂量亮氨酸,对照Sed与Tra组小鼠饲料中则添加3.4%剂量不影响骨骼肌蛋白质代谢的非必需氨基酸丙氨酸[2,3],配为等氮对照饲料,以消除不同饲料粗蛋白含量差异可能对结果造成的潜在影响。亮氨酸饲料的消化能、粗蛋白、钙、总磷与有效磷含量分别为14.35 MJ/kg、21.2%(w/w)、1.32%(w/w)、1.17%(w/w)与0.96%(w/w)。对照饲料的消化能、粗蛋白、钙、总磷与有效磷含量分别为14.22 MJ/kg、21.8%(w/w)、1.35%(w/w)、1.19%(w/w)与0.93%(w/w)。各组饲料的氨基酸含量参见表1。

表1 本研究小鼠饲料氨基酸含量
1.3 训练方案
Tra与LeuT组小鼠在体积为100×70×60 cm的玻璃水缸内进行游泳训练,水温30±2 ℃,水深约40 cm以使小鼠无法通过尾尖支撑缸底而休息。训练时在小鼠尾根绑缚3%比例体重的铅皮作为负荷[29],每日训练45 min,每周训练6天(周日休息),为期8周。每日训练前根据小鼠体重调整铅皮重量。专人监控游泳情况,若小鼠在训练过程中出现漂浮或“集团游泳”等消极运动表现,则驱赶其继续进行游泳。前期预实验中,我们采用便携式乳酸分析仪在小鼠游泳过程中和结束后即刻采集尾尖血进行乳酸含量分析,血乳酸水平均介于2.9~3.7 mmol/l范围内,提示所采用训练方案为典型有氧运动。
1.4 取材
参考Rieu研究组的设计[22],末次训练后当天24:00至次日晨6:00剥夺各组小鼠食物使其处于吸收后状态(post-absorptive),于6:00~7:00期间各组小鼠投喂2g普通国标维持饲料使其进食1h。进食后2 h(9:00),各组小鼠称重后以0.3 ml/100 g体重剂量腹腔注射10%水合氯醛进行麻醉并摘眼球取血,完整分离腓肠肌,生理盐水冲洗后滤纸吸干并称重,经液氮速冻后置超低温冰箱保存待测。其中,Tra和LeuT组小鼠的处死时点与末次训练结束间隔24 h,以减少末次游泳运动对实验结果可能产生的急性影响。
1.5 主要仪器与试剂
主要仪器:电泳仪购自美国伯乐公司;Mini P-4电泳槽购自北京凯元公司;L8800全自动氨基酸分析仪购自日本日立公司;LS-45荧光分光光度计购自美国珀金埃尔默公司;MultiSkan3酶标仪购自美国热电公司。
主要试剂:亮氨酸(LB0922)与丙氨酸(AD0022)购自上海生工;蛋白提取试剂(78510)购自美国热电;蛋白酶抑制剂购自瑞士罗氏(11836153001);Bradford蛋白定量试剂盒(P0006)购自北京碧云天公司;Ubiquitin(Ab7780)、Atrogin-1(Ab74023)、MuRF-1(Ab172479)与MHCⅡ(Ab51263)蛋白表达一抗均购自英国艾博抗公司;mTORSer2448(5536S、2983S)、p70S6KThr389(2708S、9234S)、4E-BP1Thr37/46(2855S、9644S)的蛋白总量与磷酸化表达一抗均购自美国赛信通公司;HRP标记二抗(111-035-003、115-035-003)购自美国杰克森公司;GAPDH鼠单抗(60004-1-Ig)购自武汉三鹰公司;ECL Plus(WBKLS0010)购自德国密理博公司;荧光底物Suc-LLVY-AMC(AAT-13453)购自武汉艾美捷公司;TNF-α(EM008)、IL-1β(EM001)与IL-6(EM004)ELISA试剂盒购自上海吉泰依科赛公司;常规试剂均购自国家标准物质中心、国药或金山试剂公司,为优级纯或分析纯。
1.6 实验指标检测
1.6.1 肌原纤维与肌浆蛋白定量
定量方法参考Koopman等[18]的报道,取待测肌样在5%预冷缓冲液(含0.25 M蔗糖、2mM EDTA与10mM pH为7.4的Tris-HCl)中进行匀浆,此后600×g离心20 min,收集含肌原纤维蛋白的沉降物,上清则于4℃以100,000×g转速离心60 min分离肌浆蛋白。Bradford法分别进行蛋白定量。蛋白含量均采用毫克蛋白/克湿肌重表示。
1.6.2 免疫印迹
蛋白表达采用免疫印迹法进行分析,检验参照我们前期报道[2,3,30]的方法进行:取腓肠肌加入蛋白提取试剂,肌样剪成1~2 mm3碎粒后匀浆,吸取混悬液于4℃以10,000×g离心20 min取上清。Bradford法蛋白定量后以每次上样120μg的标准进行分装,PBS补足20μl。加入5X蛋白上样缓冲液 5μl后变性10 min。配置5%浓缩胶与15%分离胶,浓缩胶80V恒压30~40 min,分离胶120 V恒压,溴酚蓝至板底后停止。湿转法转膜,恒流300 mA,转膜时间根据目的蛋白分子量大小进行相应调整:MHCⅡ转膜时间为2.5 h,稀释比1:3 000;mTORSer2448总量与磷酸化表达转膜时间均为2 h,稀释比1:1 000;P70S6KThr389总量与磷酸化表达以及Atrogin-1与MuRF-1表达的转膜时间均为1 h,稀释比分别为1:2000、1:500、1:1 000和1:1 000;4E-BP1Thr37/46总量与磷酸化表达以及Ubquitin表达转膜时间均为0.5 h,稀释比均为1:1 000。一抗和二抗(1:50 000~1:200 000)孵育后,ECL plus使目的条带发出荧光并压片检测二抗信号,据荧光强弱调节压片时间,据预染蛋白marker位置判断蛋白大体位置。
1.6.3 20S蛋白酶体活性测定
20S蛋白酶体活性采用类糜蛋白酶活性进行评价,参照Hepple等[15]的方法进行检测:以荧光肽Suc-LLVY-AMC为作用底物。将肌样萃取物于37℃在缓冲液(含100 mM pH 8.0 Tris-HCl、1mM DTT、5mM MgCl2、1mM Suc-LLVY-AMC、2mg/ml ovalbumin和0.07% SDS)中孵育30 min后,加入25μl 10% SDS终止反应。荧光分光光度计检测酶活性,激发波长380 nm,发射波长460 nm。酶活性以每微克蛋白每分钟的荧光AU表示。
1.6.4 游离氨基酸谱定量
检测骨骼肌游离氨基酸含量时,肌样于65 ℃烘干后研碎,乙醚脱脂24 h。脱脂肌样置于水解管内,加入6 mol/l盐酸后抽真空并封管,110 ℃烘箱内水解24 h。过滤定容后取全量消化液至干燥箱60 ℃真空挥干,加入200μl超纯水后再真空挥干,重复2次。0.02 mol/l盐酸溶解后过滤膜进样分析。色谱条件同我们的前期报道[2,3,30]。
1.6.5 炎性细胞因子定量
所采集血样常规分离血清后,采用ELISA法进行TNF-α、IL-1β与IL-6定量分析。检测时按照试剂盒说明书进行操作,450 nm为检测波长,570 nm为参比波长。
1.7 统计学分析

2 结果
2.1 体重与采食量
各时点体重的重复测量方差分析结果表明,各组小鼠体重无随时间变化的趋势,在干预期内均较为稳定(=2.262,=0.068);分组因素即不同处理对小鼠体重具有影响,各处理组小鼠体重总体而言并不相同(=7.970,=0.001)。对小鼠各时点体重与初始体重的纵向多重比较发现,仅Sed组小鼠在第2周(=0.007)、第5周(=0.026)和处死前(=0.031)体重变化具有统计学意义(图1A)。
就各组小鼠平均采食量而言,重复测量方差分析结果显示,平均采食量具有随时间而变化的趋势(=6.128,=0.000);不同处理并未产生显著影响,各组平均采食量总体相同(=2.007,=0.136)(图1B)。此外,对总采食量进行组间多重比较,亦未见具有统计学意义的差异(图1C)。

图1 有氧训练和/或补充亮氨酸对小鼠体重(A)、平均采食量(B)和总采食量(C)的影响示意图
Figure 1 Effect of Aerobic Training and/or Leucine Supplementation on Body Weight (A), Average Daily (B) and Total Food Intake (C) of Mice (n=8)
注:@:<0.05 vs Initial;@@:<0.01 vs Initial.
2.2 肌原纤维、肌浆蛋白含量及蛋白质总量
与Sed组小鼠相比,8周亮氨酸补充使腓肠肌蛋白总量增加6.2%(=0.049),肌浆蛋白含量增长26.3%(=0.003);有氧训练使蛋白总量增加7.3%(=0.023),肌浆蛋白增长8.4%(=0.008);联合干预则导致蛋白总量增加27.1%(=0.000),肌浆蛋白增加达36.9%(=0.000),提示,运动与氨基酸两因素具有协同促进效应(图2A、2C)。
如图2B所示,较Sed组小鼠而言,LeuS组肌原纤维蛋白含量增长13.9%(=0.032),Tra组增长19.3%(=0.004),LeuT组则增加达44.5%(=0.000),且LeuT组各指标与LeuS、Tra组小鼠相比,差异亦具有统计学意义(=0.000)。
2.3 类糜蛋白酶活性
如图3所示,较Sed组而言,LeuS组小鼠骨骼肌类糜蛋白酶活性下降9.9%(=0.029),LeuT组则降低达38.4%(=0.000),组间差异均具有统计学意义。且LeuT组各指标与LeuS和Tra组小鼠相比,差异均具有统计学意义(=0.000)。
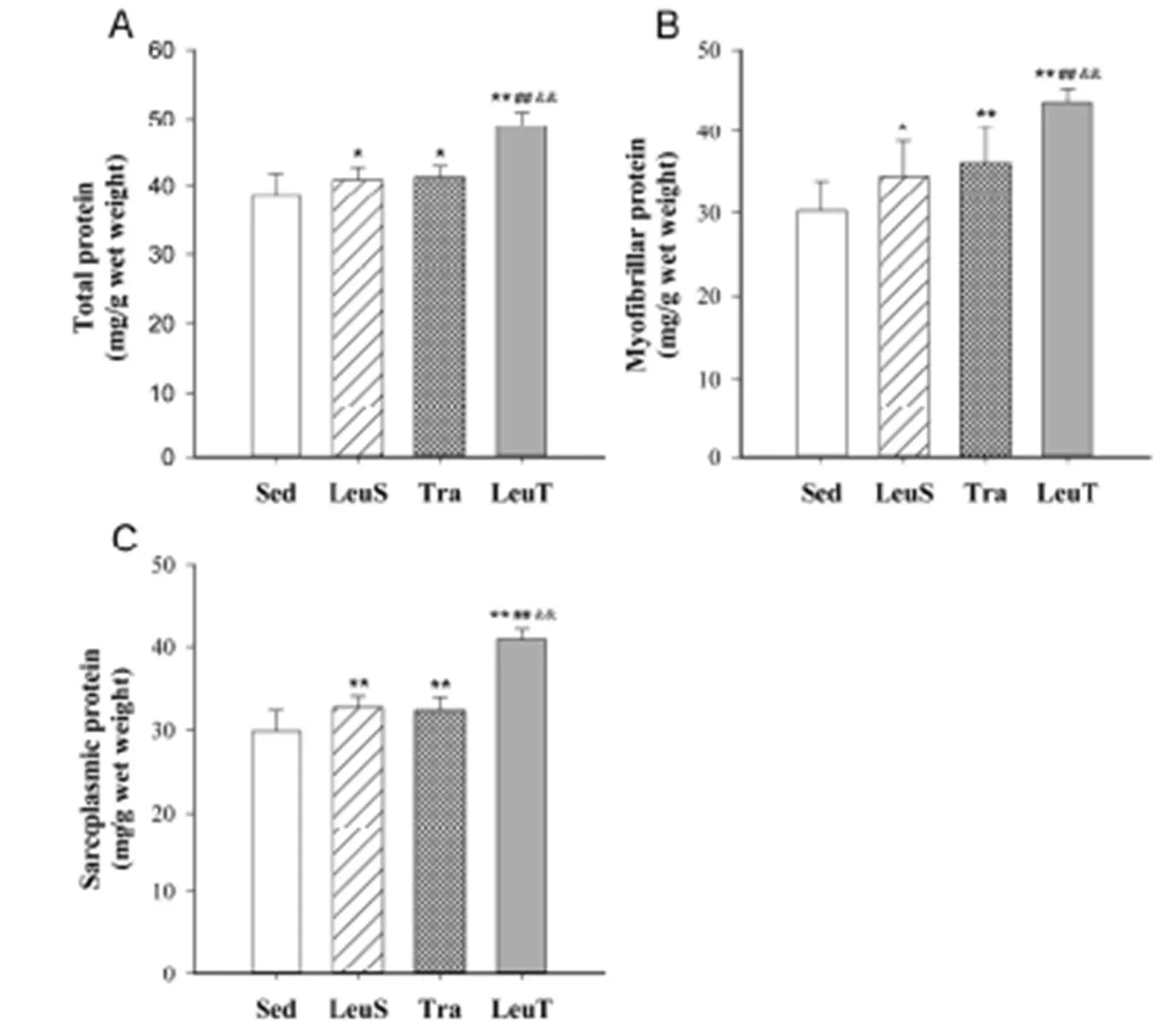
图2 有氧训练和/或补充亮氨酸对腓肠肌蛋白总量(A)、肌原纤维(B)与肌浆蛋白(C)含量的影响示意图
Figure 2 Effect of Aerobic Training and/or Leucine Supplementation on Total Protein (A), Myofibrillar (B) and Sarcoplasmic (C) Protein of Mice (n=8)
注:*:<0.05 vs Sed,**:<0.01 vs Sed;##:<0.01 vs LeuS;&&:<0.01 vs Tra.
2.4 骨骼肌游离氨基酸
如图4所示,各处理组之间仅亮氨酸、异亮氨酸、缬氨酸与丙氨酸含量差异具有统计学意义,其它游离氨基酸未见显著的组间差异。就均值水平而言,LeuS与LeuT组小鼠游离亮氨酸(<0.01)、异亮氨酸(<0.01)与缬氨酸(<0.01)均较Sed与Tra组为高,而丙氨酸(<0.01)水平则较低。
2.5 血清炎性细胞因子含量
如图5A、5B所示,LeuS组血清TNF-α含量较Sed组小鼠下降6.4%(=0.037),IL-6下降11.8%(=0.038);Tra组TNF-α含量下降6.2%(=0.045),IL-6下降12.5%(=0.038);而LeuT组TNF-α则下降达21.3%(=0.000),IL-6含量下降40.5%(=0.000),组间差异均具有统计学意义。就TNF-α而言,LeuT组较LeuS(=0.000)与Tra(=0.000)组差异具有统计学意义;IL-6亦表现出了同样的组间趋势。
如图5C,与Sed组小鼠相比,LeuS组IL-1β含量下降17.1%(=0.039),Tra组下降17.6%(=0.034),而LeuT组则下降40.1%(=0.000)。且LeuT组较Tra(=0.008)与LeuS组(=0.007)差异亦具有统计学意义。

图3 有氧训练和/或补充亮氨酸对类糜蛋白酶活性的影响示意图
Figure 3 Effect of Aerobic Training and/or Leucine Supplementation on Chymotrypsin-like Enzyme Activity (n=8)
注:*:<0.05 vs Sed,**:<0.01 vs Sed;##:<0.01 vs LeuS;&&:<0.01 vs Tra.

图4 本研究有氧训练和/或补充亮氨酸对骨骼肌游离必需(A)与非必需(B)氨基酸的影响示意图
Figure 4 Effect of Aerobic Training and/or Leucine Supplementation on Free Essential (A) and Nonessential (B) Amino Acids in Skeletal muscle (n=8)
注:**:<0.01 vs Sed;##:<0.01 vs LeuS;&&:<0.01 vs Tra,&&:<0.01 vs Tra. Leu:亮氨酸,Ile:异亮氨酸,Val:缬氨酸,Ala:丙氨酸.
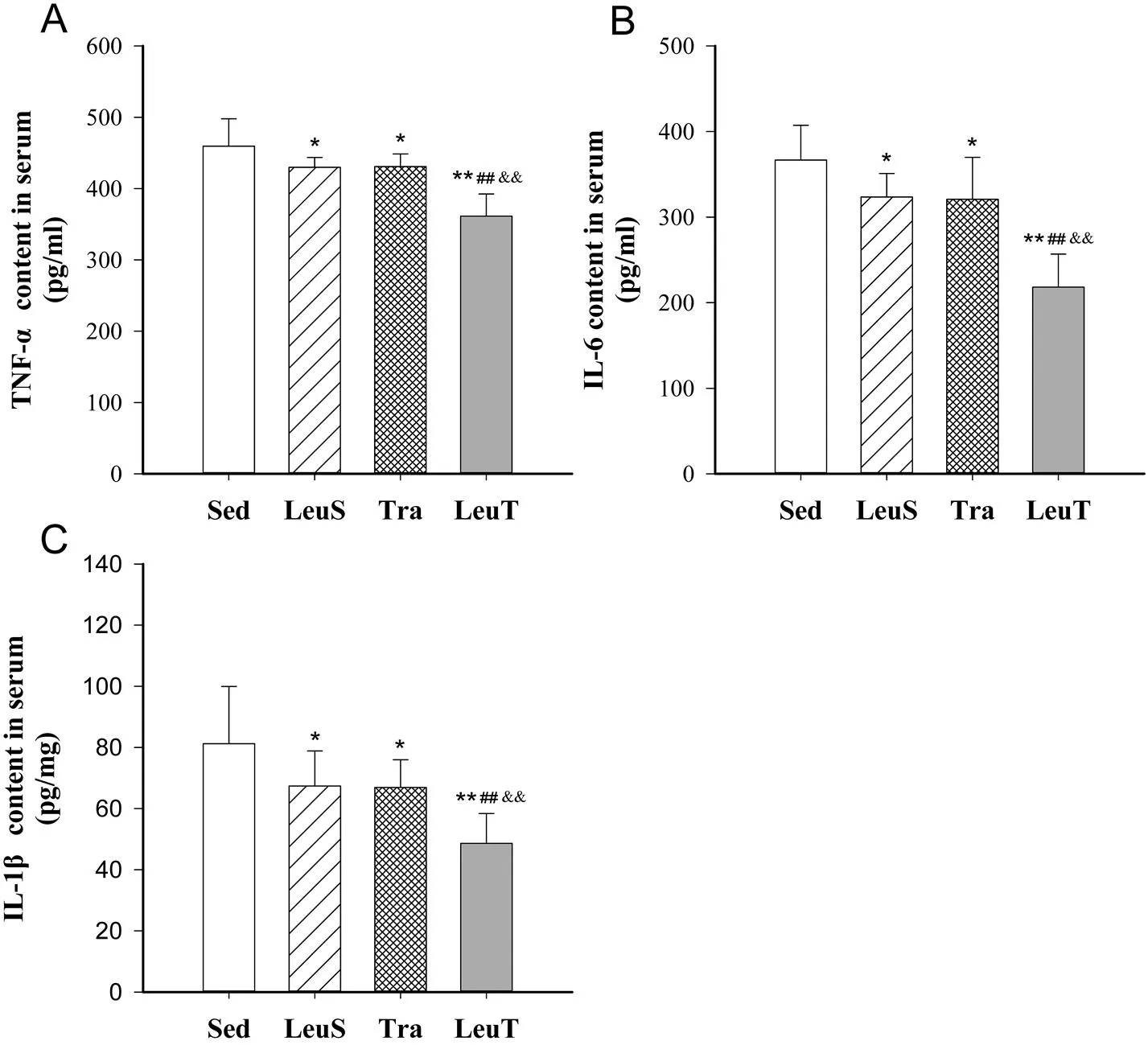
图5 有氧训练和/或补充亮氨酸对血清TNF-α(A)、IL-6(B)与IL-1β(C)含量的影响示意图

注:*:<0.05 vs Sed,**:<0.01 vs Sed;##:<0.01 vs LeuS;&&:<0.01 vs Tra.
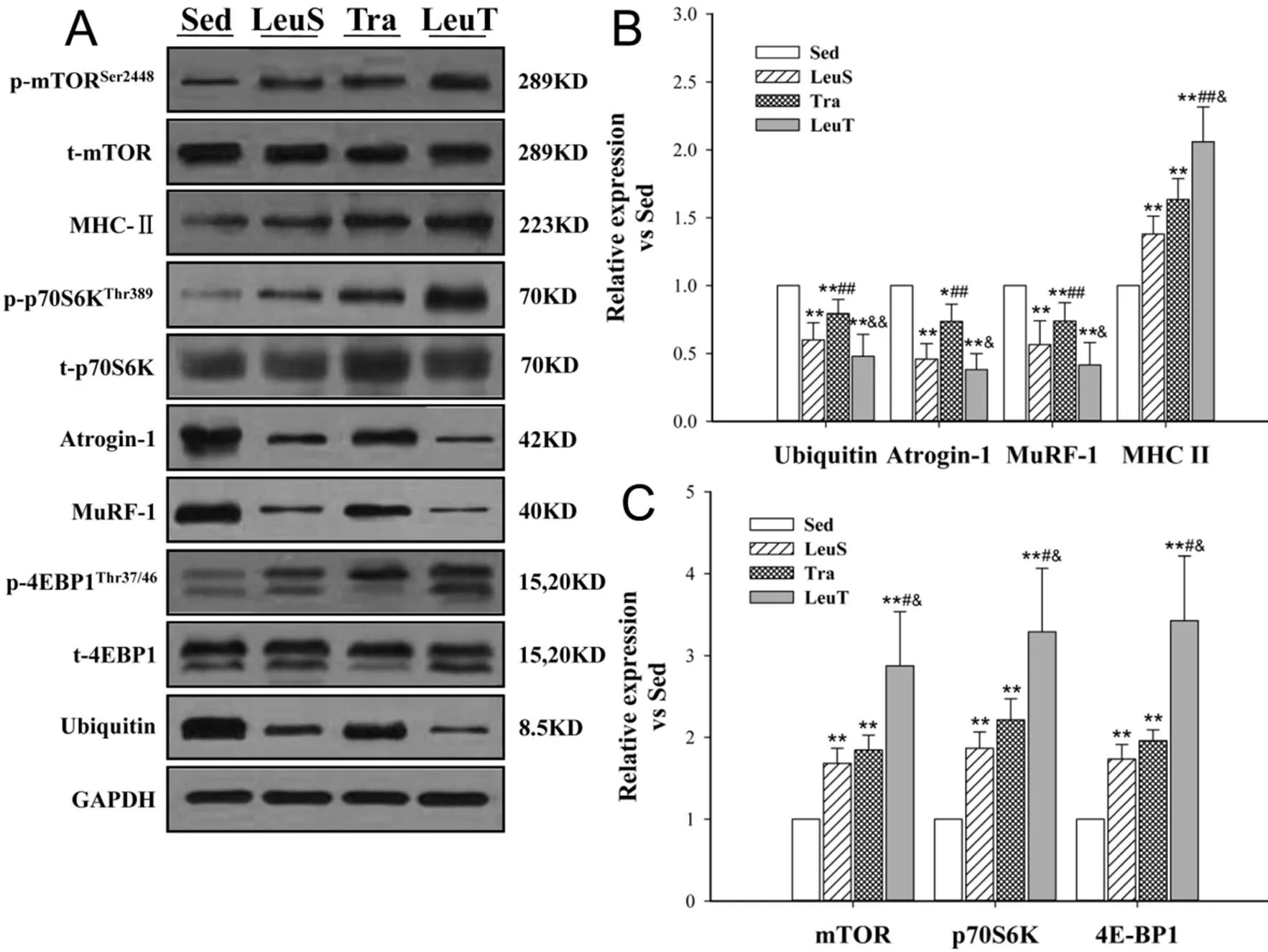
图6 有氧训练和/或补充亮氨酸对蛋白质合成与降解相关蛋白表达的影响示意图
Figure 6 Effect of Aerobic Training and/or Leucine Supplementation on the Expression of Protein in Connection with Protein Synthesis and Degradation (n=8)
注:*:<0.05 vs Sed,**:<0.01 vs Sed;#:<0.05 vs LeuS,##:<0.01 vs LeuS;&:<0.05 vs Tra,&&:<0.01 vs Tra.
2.6 蛋白表达
经8周不同处理,各组小鼠腓肠肌内与骨骼肌蛋白质合成及降解相关的蛋白/磷酸化表达水平如图6所示。就蛋白质降解相关蛋白Ubiquitin、Atrogin-1与MuRF-1表达而言:Tra、LeuS与LeuT组小鼠较Sed组表达水平均下调(<0.01),而LeuS与LeuT组表达则较Tra为低,且差异均具有统计学意义(<0.05或<0.01)。MHCⅡ表达的组间差异趋势与Ubiquitin等降解相关蛋白相反,各实验组表达较Sed组均显著上调(<0.01),LeuT组较Tra(=0.047)与LeuS(=0.003)组表达为高,且差异亦具有统计学意义(图6B)。与蛋白质合成相关的mTORSer2448、p70S6KThr389与4E-BP1Thr37/46磷酸化率如图6C所示,各蛋白组间多重比较结果均与MHCⅡ一致。
3 分析与讨论
本研究以规律有氧训练联合补充亮氨酸的多模式干预方式,从对衰老骨骼肌餐后蛋白质代谢平衡的调节出发,探讨了非药物干预途径在防治衰老性SP过程中可能存在的重要潜力,佐证了运动联合蛋白质营养在衰老性SP临床干预中的重要作用,可为临床干预手段的开发提供一定的理论线索。
3.1 有氧训练与补充亮氨酸对衰老小鼠体重与采食量影响
本研究发现,有氧训练和/或补充亮氨酸并未显著影响衰老小鼠的采食量,生长性能亦表现正常。统计的实验动物体重、采食量往往与称量时间及动物的末次进食时间等因素相关联,循前期研究经验,本研究通过如下手段有效控制了这些混杂因素可能造成的影响:1)固定称量时间。在食物充足的情况下,小鼠的采食习性亦会形成规律,通过固定每日称量体重与采食量的时间,可在一定程度上降低总体采样误差;2)减少磨牙损耗。啮齿类动物具有磨牙习性,易对颗粒饲料造成损耗,从而直接影响采食量计算的准确性。通过在鼠笼内放置椴木块使小鼠用于磨牙,可有效减少其对采食量造成的影响;3)控制饲料配方变化。饲料配方的变化可显著影响实验动物的体重与采食量,这一现象多见于饲喂高脂高糖饲料初期或其它配方具有显著改变的情况下。本研究以国标维持饲料为底料,仅分别进行了5%(亮氨酸)和3.4%(等氮丙氨酸)比例的玉米粉替换,从而较好的保持了实验小鼠习惯的饲料配方;4)应用平均采食量指标进行评价。采食量的变化与代谢体重(W0.75)正性相关[19],通过体重对其采食量进行校正,而得出的平均采食量指标,则可有效规避小鼠每日体重变化对结果所产生的影响。此外,所施加的运动干预手段由于强度较低(血乳酸2.9~3.7 mmol/l),因此未对运动组小鼠的体重与采食量造成显著影响。而小鼠代谢体重的波动变化以及随意采食量本身时多时少的特点,亦可能是采食总量未见显著差异的原因[3]。
3.2 有氧训练与补充亮氨酸对衰老小鼠骨骼肌蛋白质合成与降解的影响
蛋白质平衡紊乱是导致骨骼肌萎缩的根本原因[4,21],可能是蛋白质合成率下降、降解率升高或两者共同作用的结果[10,17]。SP骨骼肌蛋白质合成的调节机制以mTORC1复合物为中心,其中,mTOR-p70S6K/4E-BP1信号通路的活化被视为蛋白质合成促进的间接指示。随着SP进程的发展,mTOR及p70S6K/4E-BP1功能表达在基础状态和/或餐后状态呈下调趋势,从而较健康机体出现蛋白质合成减少,并最终表现为骨骼肌质量与机能的下降。在本研究中我们观察到,与安静对照小鼠相比,各干预组小鼠骨骼肌mTORSer2448、p70S6KThr389与4EBP1Thr37/46磷酸化表达均有显著上调,结合骨骼肌蛋白质总量及肌原纤维和肌浆蛋白含量的变化,说明各组小鼠的MPS均有明显增加。此外,衰老性骨骼肌萎缩变化主要发生于快缩型骨骼肌,而骨骼肌收缩表型及纤维类型由肌球蛋白重链MHC亚型I、Ⅱa和Ⅱx的相对表达所决定[8],因此,腓肠肌MHCⅡ表达的变化亦在一定程度上反映了MPS水平的变化。本研究发现,所施加干预诱使衰老小鼠腓肠肌MHC II表达显著上调,进一步佐证了有氧训练和/或亮氨酸的促MPS潜力。就SP骨骼肌蛋白质降解机制而言,炎性介质活化的泛素-蛋白酶体途径(Ubiquitin-Proteasome System,UPS)是主要水解系统[24]。目前,已知两种被称为Atrogenes的肌肉特异性E3泛素连接酶MuRF1和Atrogin-1直接导致蛋白质合成抑制和骨骼肌分解[24]。当骨骼肌蛋白质降解超过合成,亦会表现为骨骼肌萎缩与机能衰退。本研究结果显示,各干预组小鼠骨骼肌Ubiquitin、Atrogin-1和MuRF-1表达均明显下调。由此可见,规律有氧训练与膳食补充亮氨酸均具有促进衰老机体MPS和抑制MPB的功能。但需要强调的是,通过对各处理组的干预效果进行比较发现,由于有氧训练组小鼠腓肠肌Ubiquitin、Atrogin-1及MuRF-1表达水平均高于膳食补充亮氨酸组(<0.01),且类糜蛋白酶活性较安静对照小鼠并无差异,从而提示,所施加8周有氧训练干预的作用主要在于对MPS的促进而非抑制MPB。而膳食补充亮氨酸虽然产生了与有氧训练类似的促MPS效应,但其对MPB的抑制作用则更为显著。因此,有氧训练联合补充亮氨酸组(LeuT)小鼠所表现出的改善衰老骨骼肌蛋白质平衡作用究竟主要由何种因素所致(有氧训练 vs 亮氨酸)?其作用究竟是侧重于促进MPS还是抑制MPB?目前均不清楚,仍有待深入研究予以澄清。
3.3 有氧训练与膳食补充亮氨酸对衰老小鼠骨骼肌游离氨基酸的影响
作为蛋白质合成前体,游离氨基酸含量直接影响MPS与MPB之间的平衡,从而对于衰老骨骼肌质量与功能的维持具有重要意义。迄今,鲜见运动与补充亮氨酸对骨骼肌游离氨基酸谱影响的相关报道。有零星文献线索提示,在烧伤、极度饥饿等极端情况下,MPB和氨基酸释放增多而用于缓冲血浆氨基酸水平的变化,此时骨骼肌作为“氨基酸池”在骨骼肌量的维持方面发挥着重要作用[28],而适度的运动则可能削弱MPB与骨骼肌氨基酸的释放[9]。本研究中观察到,8周干预仅导致衰老小鼠骨骼肌游离亮氨酸、缬氨酸、异亮氨酸与丙氨酸含量出现显著的组间差异。与安静对照小鼠相比,运动未显著改变各种游离氨基酸水平;补充亮氨酸导致骨骼肌内游离亮氨酸储量增加,缬氨酸、异亮氨酸与丙氨酸水平则均明显较低,且运动联合亮氨酸组小鼠亦观察到了相同趋势。本研究取材时点为餐后2 h,此时骨骼肌分解代谢并不旺盛,骨骼肌内游离氨基酸含量亦较为稳定,可能掩盖了长期训练所导致的氨基酸跨膜转运变化。而由于各组饲料本身亮氨酸与丙氨酸含量的差异,骨骼肌游离亮氨酸与丙氨酸含量的差异亦成为必然。然而需要指出的是:一方面,运动联合补充亮氨酸组小鼠较其它各组而言,仅观察到了游离亮氨酸水平的显著优势,结合本研究中蛋白质含量、蛋白质合成信号通路蛋白与Atrogenes功能表达变化考虑,这一结果极大程度上佐证了亮氨酸在调节衰老骨骼肌蛋白质合成方面的重要作用,与前人的研究结果与观点亦保持了一致[5];另一方面,补充亮氨酸组(LeuS)与运动联合补充亮氨酸组(LeuT)小鼠所表现出的较低缬氨酸与异亮氨酸水平是一个有趣的现象。Rieu研究组此前关于血清氨基酸的检测结果亦观察到了这一变化[23],但迄今仍未明确这一现象的发生机理。该组其后的研究在补充亮氨酸时往往同时额外添加缬氨酸与异亮氨酸以削弱这一改变,但笔者认为,缬氨酸与异亮氨酸作为重要的必需氨基酸,与亮氨酸同时添加时很可能会对骨骼肌蛋白质代谢产生混杂影响,从而掩盖亮氨酸的真正作用。可见,补充亮氨酸为何会导致血浆与骨骼肌内另外两种游离支链氨基酸含量下降,仍是有待探索的问题。
3.4 有氧训练与膳食补充亮氨酸改善衰老骨骼肌蛋白质代谢的可能性机制
运动以及亮氨酸促进衰老骨骼肌MPS并抑制MPB的确切分子机制迄今仍不清楚,但近期的证据表明,其似乎与炎症相关。促炎因子,尤其是TNF-α和IL-6可能在其中具有重要作用[25]。运动训练,尤其是规律地有氧训练对于低水平、全身性炎症的抑制可能具有重要作用[12],当前观点认为,有氧训练可降低腹部、四肢脂肪及循环促炎细胞因子的生成与集聚[11]。本研究中我们观察到小鼠血清TNF-α、IL-6和IL-1β含量在8周有氧干预后出现了显著下降(<0.05),佐证了规律有氧训练的抑炎作用。单纯补充亮氨酸组小鼠亦观察到了类似的结果,亮氨酸对衰老骨骼肌炎性细胞因子含量的影响目前未见相关报道,但近期有研究表明,高脂/胆固醇膳食导致小鼠血清IL-6与TNF-α水平增高(<0.01),而补充1.5%和3%剂量亮氨酸均可逆转这一趋势,且后者效果更为显著[16]。Giri等此前的研究亦显示,补充亮氨酸可抑制脂多糖诱发的炎性反应,显著降低血清TNF-α与IL-1β含量,且具有显著的正性量-效关系(100~350μg/ml剂量范围)[14]。此外,亮氨酸亦被认为可以改善食欲,进而减少MPB,且联合运动时可诱发协同的促进MPS反应[29,30]。本研究发现,有氧运动与补充亮氨酸通过协同促进作用,更为显著的抑制了TNF-α与IL-6血清水平,尽管IL-1β未见显著交互,但其均值水平仍显著低于LeuS与Tra组小鼠。Torres-Leal给高脂膳食大鼠施加5%亮氨酸和/或有氧训练干预(负荷5%自体重,60 min/天,5次/周,共计6周),检测TNF-α含量,亦观察到了与本研究一致的结果[26]。由此可见,有氧运动与补充亮氨酸均可产生抑炎效应,且联合干预效果更为显著。
目前,关于有氧运动联合补充亮氨酸对SP干预的相关研究仍然极为匮乏。但是,鉴于前述蛋白质含量、合成与降解相关通路蛋白的表达变化,以及我们此前的相关研究结果[2-4],有理由相信,采用有氧运动联合亮氨酸膳食补充可削弱炎症,逆转负性骨骼肌蛋白质平衡,并最终改善衰老导致的骨骼肌萎缩[27]。有氧训练与亮氨酸交互作用于炎性反应并进而改善骨骼肌蛋白质代谢的潜在机制如图7所示。

图7 有氧训练和/或补充亮氨酸经调节骨骼肌蛋白质代谢改善SP的机制
Figure 7 Mechanism of Aerobic Training and/or Leucine Supplementation Alleviating Sarcopenia Via the Regulation of Protein Metabolism in Skeletal Muscle

4 结论
3%自体重负荷的中等强度有氧训练以及5%剂量亮氨酸膳食补充均能够促进增龄小鼠腓肠肌蛋白质合成,抑制蛋白质降解,且联合干预时效果更为明显,具有防治衰老性骨骼肌萎缩的重要潜力。究其机理,可能与有氧训练和亮氨酸均能发挥抑炎效应,进而上调mTOR-p70S6K/4E-BP1途径功能表达促进骨骼肌蛋白质合成,并经下调UPS系统活性而抑制蛋白质降解有关。
[1] 孙建琴, 张坚, 常翠青, 等. 肌肉衰减综合征营养与运动干预中国专家共识(节录) [J]. 营养学报, 2015, 37(4): 320-324.
[2] 夏志, 赵艳, 尚画雨, 等. 膳食补充亮氨酸可通过抑制泛素-蛋白酶体削弱增龄小鼠骨骼肌萎缩[J]. 体育科学, 2015, 35(6): 49-56.
[3] 夏志, 赵艳, 尚画雨, 等. 亮氨酸对增龄小鼠腓肠肌蛋白质合成的影响[J]. 北京体育大学学报, 2014, 37(11): 79-85.
[4] 熊伟平, 夏志. 有氧运动促进老年前期小鼠快缩型骨骼肌蛋白质合成代谢的研究[J]. 中国康复医学杂志, 2016, 31(12): 1311-1317.
[5] ANTHONY JC, YOSHIZAWA F, ANTHONY TG,. Leucine stimulates translation initiation in skeletal muscle of postabsorpti-ve rats via a rapamycin-sensitive pathway [J]. J Nutr, 2000, 130(10): 2413-2419.
[6] ANTON SD, HIDA A, MANKOWSKI R,. Nutrition and exercise in sarcopenia [J]. Curr Protein Pept Sci, 2016, http://www.eurekaselect.com/148738/article.DOI: 10.2174/1389203717666161227144349.
[7] BERNABEI R, MARIOTTI L, BORDES P,. The "sarcopenia and physical frailty in older people: multi-component treatment strategies" (SPRINTT) project: advancing the care of physically frail and sarcopenic older people [J]. Aging Clin Exp Res, 2017, 29(1): 1-2.
[8] BOTTINELLI R. Functional heterogeneity of mammalian single muscle fibres: do myosin isoforms tell the whole story? [J]. Pflugers Arch, 2001, 443(1):6-17.
[9] BRAITH R W, MILLS R M, WELSCH M A,. Resistance exercise training restores bone mineral density in heart transplant recipients [J]. J Am Coll Cardiol, 1996, 28(6):1471-1477.
[10] BUDUI S L, ROSSI AP, ZAMBONI M. The pathogenetic bases of sarcopenia [J]. Clin Cases Miner Bone Metab, 2015, 12(1): 22-26.
[11] CAMPOS R M, DE MELLO, TOCK L,. Aerobic plus resistance training improves bone metabolism and inflammation in adolescents who are obese [J]. J Strength Cond Res, 2014, 28(3): 758-766.
[12] DELLA GATTA P A, GARNHAM A P, PEAKE J M,. Effect of exercise training on skeletal muscle cytokine expression in the elderly [J]. Brain Behav Immun, 2014, 39: 80-86.
[13] DE SPIEGELLEER A, PETROVIC M, BOECKXSTAENS P,. Treating sarcopenia in clinical practice: where are we now? [J]. Acta Clin Belg, 2016, 71(4): 197-205.
[14] GIRI SS, SEN SS, JUN JW,Protective effects of leucine against lipopolysaccharide-induced inflammatory response in labeo rohita fingerlings [J]. Fish Shellfish Immunol, 2016, 52: 239-247.
[15] HEPPLE R T, QIN M, NAKAMOTO H,. Caloric restriction optimizes the proteasome pathway with aging in rat plantaris muscle: implications for sarcopenia [J]. Am J Physiol Regul Integr Comp Physiol, 2008, 295(4): R1231-1237.
[16] JIAO J, HAN S F, ZHANG W,. Chronic leucine supplementation improves lipid metabolism in C57BL/6J mice fed with a high-fat/cholesterol diet [J]. Food Nutr Res, 2016, 60: 31304.
[17] KONOPKA A R, HARBER M P. Skeletal muscle hypertrophy after aerobic exercise training [J]. Exe Sport Sci Rev, 2014, 42(2): 53-61.
[18] KOOPMAN R, GEHRIG S M, LEGER B,. Cellular mechanisms underlying temporal changes in skeletal muscle protein synthesis and breakdown during chronic {beta}-adrenoceptor stimulation in mice [J]. J Physiol, 2010, 588(Pt 23): 4811-4823.
[19] MCDONALD P, EDWARDS R A, CREENHALGH JFD,. 实验动物学[M].王九峰,李同洲,译.北京:中国农业大学出版社,2007.
[20] MURTON A J. Muscle protein turnover in the elderly and its potential contribution to the development of sarcopenia [J]. Proc Nutr Soc, 2015, 74(4): 387-396.
[21] REGINSTER J Y, COOPER C, RIZZOLI R,. Recommendations for the conduct of clinical trials for drugs to treat or prevent sarcopenia [J]. Aging Clin Exp Res, 2016, 28(1): 47-58.
[22] RIEU I, BALAGE M, SORNET C,. Increased availability of leucine with leucine-rich whey proteins improves postprandial muscle protein synthesis in aging rats [J]. Nutrition, 2007, 23(4): 323-331.
[23] RIEU I, SORNET C, BAYLE G,Leucine-supplemented meal feeding for ten days beneficially affects postprandial muscle protein synthesis in old rats [J]. J Nutr, 2003, 133(4):1198-1205.
[24] ROM O, REZNICK AZ. The role of E3 ubiquitin-ligases MuRF-1 and MAFbx in loss of skeletal muscle mass [J]. Free Radic Biol Med, 2016, 98: 218-230.
[25] SENTE T, VAN BERENDONCKS AM, FRANSEN E,. Tumor necrosis factor-alpha impairs adiponectin signalling, mitochondrial biogenesis, and myogenesis in primary human myotubes cultures [J]. Am J Physiol Heart Circ Physiol, 2016, 310(9): H1164-1175.
[26] TORRES-LEAL F L, FONSECA-ALANIZ M H, TEODORO G F,. Leucine supplementation improves adiponectin and total cholesterol concentrations despite the lack of changes in adiposity or glucose homeostasis in rats previously exposed to a high-fat diet [J]. Nutr Metab (Lond), 2011, 8(1): 62.
[27] PHILLIPS S M. Nutritional supplements in support of resistance exercise to counter age-related sarcopenia [J]. Adv Nutr, 2015, 6(4): 452-460.
[28] PORTER C, HURREN N M, HERNDON D N,. Whole body and skeletal muscle protein turnover in recovery from burns [J]. Int J Burns Trauma, 2013, 3(1):9-17.
[29] XIA Z, CHOLEWA J, ZHAO Y,. Hypertrophy-promoting effects of leucine supplementation and moderate intensity aerobic exercise in pre-senescent mice [J]. Nutrients, 2016, 8(5): E246.
[30] ZANCHI N E, NICASTRO H, LANCHA A H,. Potential antiproteolytic effects of L-leucine: observations of in vitro and in vivo studies [J]. Nutr Metab (Lond), 2008, 5(1):1-7.
Effects of Aerobic Training in Combination with Leucine Supplementation on Protein Metabolism in Skeletal Muscle of Pre-Senescent Mice
XIA Zhi1, ZHAO Yan1, SHANG Hua-yu2, YANG Li-yuan3, FU Yu2, SUN Jun-zhi2, SU Quan-sheng2
1. Jinggangshan University, Ji’an 343009, China; 2. Chengdu Sport Institute, Chengdu 610041,China;3. Chengdu University, Chengdu 610106, China.
Objective: To investigate the effect and mechanism of aerobic training in combination with leucine supplementation on muscle protein synthesis and protein degradation. Methods: Thirteen-month-old male CD-1® mice were randomly divided into sedentary control, aerobic training control, dietary leucine supplementation, and aerobic training in combination with leucine supplementation. Leucine was supplemented with 5% dosage. Mice in training group received 45 min swimming training with 3% body weight workload for 8 weeks (6 days/wk). Protein content were measured with Bradford kit. The expression and phosphorylation rate of protein were determined by using Western blotting. The concentration of serum inflammatory cytokines were measured with ELISA kit. The profile of free amino acids in muscle was detected with an amino acids analyzer. The activity of chymotrypsin-like enzyme was determined by using fluorescence method. Results: Both aerobic training and 5% leucine supplementation did not change the body weight, and food intake. Myofibrillar, sarcoplasmic and total protein content, the phosphorylation rate of mTORSer2448, 4E-BP1Thr37/46, p70S6KThr389 and the expression of MHCⅡ were significantly elevated, while the expression of Ubiquitin, Atrogin-1 and MuRF-1, and the concentration of pro-inflammatory cytokines in serum were decreased obviously. Besides, leucine supplementation induced a significant decrease of chymotrypsin-like enzyme activity, and increases of leucine, isoleucine and valine in skeletal muscle. The combination of aerobic training and leucine supplementation leaded more significant effects when in comparison with training or leucine supplementation alone. Conclusion: Moderate aerobic training in combination with 5% leucine supplementation promotes post-prandial protein synthesis in skeletal muscle of pre-senescent mice, and inhibits protein degradation, which may be correlated with elevated functional expression of mTOR-p70S6K/4E-BP1 pathway and decreased activity of ubiquitin-proteasome system.
1000-677X(2018)03-0057-10
10.16469/j.css.201803007
G804.7
A
2017-05-10;
2018-03-03
江西省教育厅科技项目(GJJ160738);井冈山大学博士科研基金(JZB15014);江西省高校人文社科项目(TY17210).
夏志,男,副教授,博士,研究方向为运动生理学,E-mail: xiazhi1982@163.com。
