牦牛出血性败血症的病原分离与药敏试验
2018-04-18赵青山赵登雪
赵青山 , 赵登雪
(青海省家畜改良中心 , 青海 西宁 810016)
多杀性巴氏杆菌在自然界中分布广泛,是一种能使多种畜禽及野生动物发生以败血症及呼吸系统疾病为主要症状的重要条件致病菌。在青海地区常见的巴氏杆菌病主要有牛出血性败血症、羊巴氏杆菌病、猪肺疫及禽霍乱等。一般认为家畜在发病前已经带菌,当其饲养在不卫生环境中,由于寒冷、闷热、潮湿、拥挤、气候剧变、营养缺乏、饲料突变、长途运输、寄生虫等诱因,而使其抵抗力降低时,病菌即可乘机侵入体内,经淋巴液而入血液,发生内源性感染[1]。
2012 年3月初,青海省黄南藏族自治州尖扎县尖扎滩村一户牧民饲养的38头牦牛中有13头牦牛陆续发病,发病率为34.21%(13/38),就诊前死亡7头,致死率为53.85%(7/13)。患病牦牛病初体温高达41 ℃,病牛口吐白沫,卧地不起,饮食欲减退或废绝,心跳加快,节律不齐;颌下、喉部及胸前部出现炎性肿胀;腹式呼吸;眼结膜呈蓝紫色;下痢,气味恶臭。对病死牦牛剖检可见: 皮下及肌肉组织有较为严重的出血性胶样浸润,切开后流出淡黄色透明液体;气管内充满大量的泡沫状黏液;淋巴结肿大、出血;肝肿胀、质脆,个别牦牛肝表面有坏死灶;肾稍肿;肺脏切面呈现大理石病变;大网膜和肠系膜上有大面积弥漫性点状、片状出血;真胃和十二指肠黏膜水肿、增厚、出血;结肠呈紫红色,有的发生坏死。通过对采取的实质脏器进行病原的分离鉴定,结合流行病学、临床症状和病理变化,诊断为牦牛出血性败血症,同时对患病牦牛采取了相应的治疗与综合性防制措施,再无新病例发生,结果报告如下。
1 材料与方法
1.1 病料 无菌采取病死牦牛心、肝、脾、肺、肾等脏器9份,置4 ℃冰箱保存待检。
1.2 培养基 TSB肉汤、TSA琼脂平板、TSA琼脂斜面、葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、鼠李糖、棉子糖、阿拉伯糖、木糖、蕈糖、卫矛醇、肌醇、山梨醇、水杨苷、M.R.,V-P、靛基质、明胶、鸟氨酸、硫化氢、西蒙氏枸橼酸盐、硝酸盐、半固体和尿素,均购自北京陆桥生物技术有限责任公司(批号080606);MH培养基,购自北京奥博星生物技术责任有限公司(批号20081206)。
1.3 实验动物 健康昆明系小鼠6只(体重16~18 g),均购自青海省地方病研究所。
1.4 药敏试验 抗生素种类为丁胺卡那霉素和青霉素等24种,购自上海伊华医学科技有限公司。
1.5 方法
1.5.1 触片染色镜检 病料进行触片,分别进行革兰和美蓝染色、镜检。
1.5.2 分离培养 将病料分别无菌接种到TSB肉汤,37 ℃温箱培养18~24 h后摇匀再分别勾取2~3环TSB肉汤培养物划线接种于TSA琼脂平板上进行细菌的数次纯化培养,而后将纯化好的细菌接种到TSA血斜面上,37 ℃培养18~24 h后置4 ℃冰箱备用[2]。
1.5.3 生化试验 将纯化好的疑似多杀性巴氏杆菌株分别接种到葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、鼠李糖、棉子糖、阿拉伯糖、木糖、蕈糖、卫矛醇、肌醇、山梨醇、水杨苷、M.R.,V-P、靛基质、明胶、鸟氨酸、硫化氢、西蒙氏枸橼酸、硝酸盐、半固体和尿素分解培养基中,于37 ℃恒温箱内培养24~48 h后,判定结果。
1.5.4 致病性试验 勾取单个疑似多杀性巴氏杆菌落划线接种于TSA琼脂平板上,37 ℃培养18~24 h后,再用灭菌的生理盐水无菌洗下,与麦氏浊管进行比浊,均选取9×108活菌/mL浓度腹腔注射试验组小鼠3只,0.5 mL/只,对照组3只小鼠腹腔注射灭菌生理盐水,0.5 mL/只,观察结果。
1.5.5 药敏试验 将上述浓度的菌液分别用灭菌棉拭子蘸取后依次均匀涂布整个MH琼脂平板,且每隔60度角旋转1次,均匀涂布1~2次,分别贴上药敏纸片。每块平板贴3片正置于温箱 30 min,然后倒置培养18~24 h。判定标准参照美国临床实验室标准委员会(NCCLS)药敏试验纸片扩散法法规[3]。
2 结果
2.1 触片、染色及镜检 取心、肝、脾、肾等病料进行触片,革兰染色镜检,观察到革兰阴性小杆菌。美蓝染色镜检可见到大量两极浓染的小杆菌。
2.2 菌落形态与培养特性 TSB肉汤37 ℃培养24 h后均匀浑浊,在TSA平板上呈现淡蓝色光泽,形成光滑、湿润、边缘整齐的菌落。
2.3 生化试验 生化试验结果见表1。
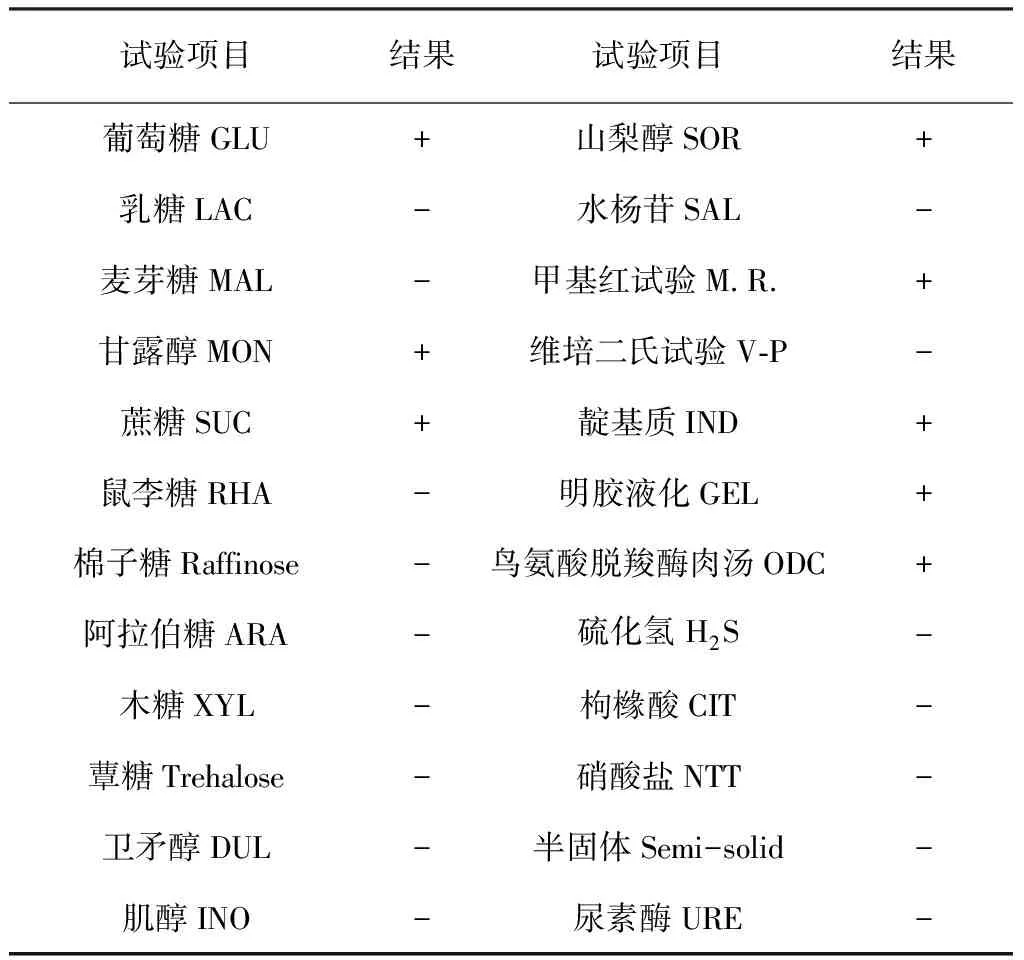
表1 多杀性巴氏杆菌生化试验结果
2.4 动物试验 试验组3只小鼠于16~24 h内全部死亡,对死亡小鼠剖检可见皮下组织略水肿,心包和胸腔有浆液性纤维素性渗出物;有明显的全身出血性变化,肠道出血尤为明显;肝脏表面可见针尖大的灰白色坏死灶,分别采取肝、脾、肺等病料进行细菌分离培养,分别分离到了与上述一致的革兰阴性小杆菌,同时将实质脏器触片后经美兰染色镜检见到中间淡染,两级着色较深的小杆菌。对照鼠饲喂一周后仍健活。
2.5 药敏试验 抑菌圈的测量结果见表2。
2.6 根据流行病学资料的调查与分析,结合临床症状、病理剖检变化和实验室诊断,确诊为牦牛出血性败血症。
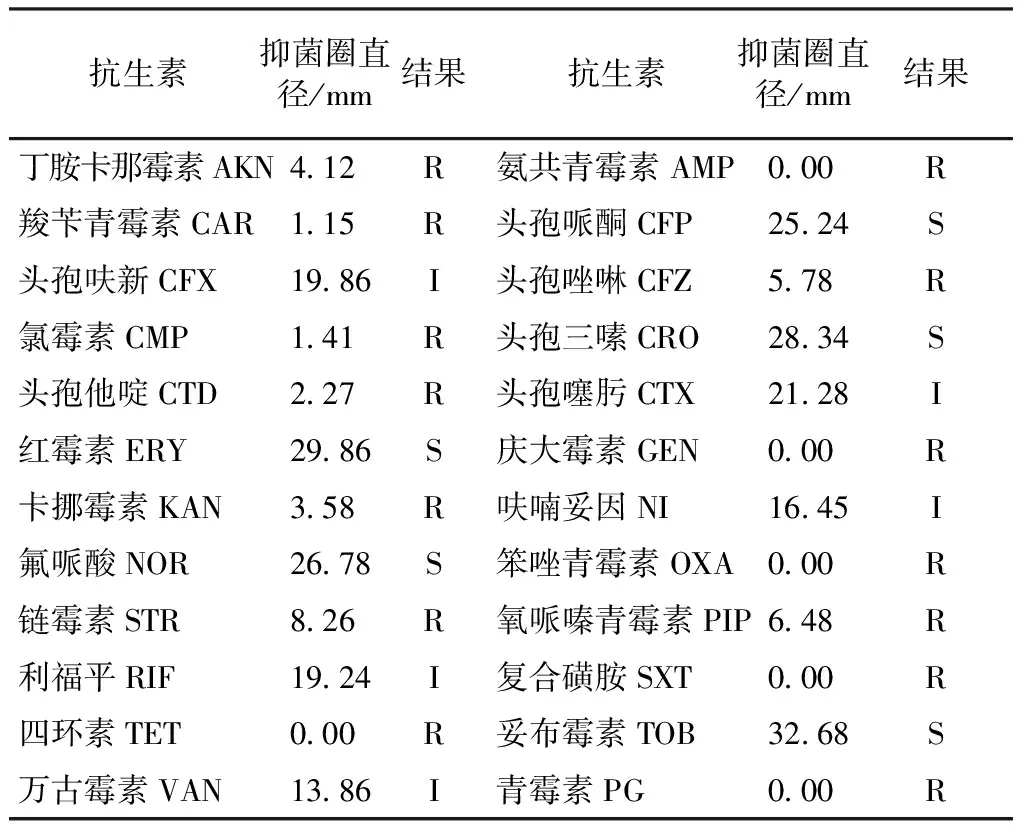
表2 多杀性巴氏杆菌药敏试验结果
说明:根据1994年12月版美国NCCLS药敏试验纸片扩散法法规判定 ,“S”:敏感;“I”:中介;“R”:耐药
3 讨论
3.1 由于多杀性巴氏杆菌为条件性致病菌,在畜禽中带菌率较高。有资料显示,在猪的鼻道深处和喉头内,带菌率为30.9%[4]。该病主要经消化道感染,其次通过飞沫经呼吸道感染,亦有经皮肤伤口或蚊蝇叮咬而感染的。该病常年发生,特别是在青海纯牧业地区,气温的骤降极易导致牦牛抵抗力降低,使多杀性巴氏杆菌通过外源性和内源性传染侵入牦牛机体后,很快通过淋巴结进入血液形成菌血症,并可在24 h内发展为败血症而死亡。此次发病的主要原因:一是与发病前降雪降温有关;二是该牧户的牦牛多年未进行牛出败疫苗的免疫;三是该牧民为减少损失私自剥皮销售和忽视消毒工作而造成了Pm的机械性传播,导致其他牦牛感染本病。
3.2 药敏试验结果显示,在24种抗生素中,多杀性巴氏杆菌对头孢哌酮(CFP)、头孢三嗪(CRO)、红霉素(ERY)、氟哌酸(NOR)、妥布霉素(TOB)等5种抗生素敏感;对头孢呋辛(CFX)、头孢噻肟(CTX)、呋喃妥因(NI)、利福平(RIF)、万古霉素(VAN)等5种抗生素中敏介;对其余14种抗生素耐药。药物筛选的结果说明青链霉素对Pm分离株耐药,这也就验证了该牧民曾用青链霉素配合0.85%氯化钠液与25%葡萄糖进行治疗效果不佳的原因所在。由于该病发病比较急,病程短,常来不及治疗而死亡。因此,必须以预防为主,一旦发病应尽早治疗,越早越好,否则到发病后期则治愈率极低,若临床出现拉稀现象多为预后不良。因此,笔者选取2~3种敏感氟哌酸、头孢哌酮和中敏(呋喃妥因)的药物交替进行治疗(用量按说明书),2 次/d,3d 为1个疗程。同时对尚未发病的牦牛隔离并紧急注射牛出败氢氧化铝灭活疫苗,确保免疫密度达到100%,是防止牦牛出败发生的重要措施。此外,加强饲养管理,避免牦牛受寒以增强其抗病能力;对在剖检过程中被污染的饲草、土壤、血液集中深埋,防止疫病进一步扩散;对病死牦牛进行深埋,严禁私自剥皮或将肉尸、内脏饲喂自家的藏獒;畜主接触牦牛前后均应严格洗手消毒,以避免交叉感染或机械性地传播病原。通过采取上述综合措施1周后,剩余的6例患牛全部被治愈,疫情得到了控制。这一结果也充分说明牦牛出血性败血症在临床上明确诊断、筛选用药与及时采取综合性的防制措施才能有效控制疫情发展。
参考文献:
[1] 黄银云,胡新岗.犬巴氏杆菌病的预防与控制[J].现代畜牧兽医,2008(11):40-41.
[2] H G.兽医微生物学[M].第3版.北京:中国农业出版社,2001:248-252.
[3] 胡继红,高振翔,尹铭芳,等.美国NCCLS2002年版抗生素药敏试验操作标准更新内容[J].中华检验医学杂志,2002,25(6):367-369.
[4] 索绪峰,王建新.猪多杀性巴氏杆菌的分离鉴定及毒素检测[J].中国兽医杂志,2005,41(6):25-27.
