两种旋毛虫丝氨酸蛋白酶抑制剂对巨噬细胞炎性细胞因子mRNA表达的影响
2018-04-18刘照琨关靖喆张煜涵张思远路义鑫
毕 磊 , 刘照琨 , 关靖喆 , 张煜涵 , 张思远 , 路义鑫
(动物疾病防控技术与制剂创制重点实验室 东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030)
丝氨酸蛋白酶抑制剂(Serine protease inhibitor,SPI) 大约由350~400个氨基酸残基构成,具有稳定的空间结构,其分子量处于40 kDa至100 kDa不等,能够通过自身构象变化抑制靶酶,广泛存在于动物、植物及微生物体内,能够调节生物体内许多重要的生命代谢过程。丝氨酸蛋白酶抑制剂在动物体内起到调节机体内环境稳态的重要作用[1]。现已发现在寄生虫感染过程中,包括入侵宿主、免疫逃避、炎症反应、凝血系统和细胞迁徙等都有丝氨酸蛋白酶抑制剂的参与[2-5]。
旋毛虫病(Trichinellosis)是一种由旋毛虫引起的人兽共患寄生虫病,旋毛虫寄生于宿主骨骼肌和肠上皮细胞,通过食源性传播[6],可于同一宿主完成一整个生命过程。长期的寄生伴随的免疫抑制现象对旋毛虫的防治意义重大。但旋毛虫的免疫逃避机制尚未明确,已有研究证实,旋毛虫排泄分泌物能够调节巨噬细胞多种炎性细胞因子的产生,进而逃避宿主免疫应答[7]。但分泌物中的具体作用成分仍有待研究。为确定旋毛虫丝氨酸蛋白酶抑制剂是否具有类似调节功能,本研究以原核表达获得的两种可溶性丝氨酸蛋白酶抑制剂(TsAdSPI和TsKaSPI)为实验对象,利用SYBR Green I实时荧光定量 PCR技术,研究旋毛虫成虫丝氨酸蛋白酶抑制剂(TsAdSPI)和旋毛虫Kazal型丝氨酸蛋白酶抑制剂(TsKaSPI)对J774A.1小鼠巨噬细胞免疫过程中各炎性细胞因子的调节作用。以期证明这两种SPIs能够在旋毛虫入侵宿主时通过调节宿主巨噬细胞炎性细胞因子的生成影响机体免疫应答,为进一步研究旋毛虫免疫逃避机制提供线索。
1 材料与方法
1.1 细胞株及重组蛋白 J774A.1小鼠巨噬细胞系,购自上海霖研生物技术有限公司。TsAdSPI和TsKaSPI重组蛋白由本实验室已成功构建的载体经IPTG诱导表达,及电洗脱纯化后获得。
1.2 主要试剂盒器材 LPS为Sigma公司产品;特级胎牛血清为天津灏洋公司产品;DMEM培养基为美国Hyclone公司产品;rTaqDNA聚合酶、TRIZol、pMD18-T载体试剂盒、DH5α和SYBR PremixExTaqⅡ′,均购自宝生物工程(大连)有限公司;PCR仪为德国 Eppendorf 公司产品;7500 Fast型实时荧光PCR仪为ABI公司产品;UV-120-02 型紫外分光光度计为日本岛津公司产品。
1.3 细胞培养及CCK-8法检测重组蛋白对细胞活力的影响 J774A.1细胞用含10%胎牛血清的DMEM培养基,在37 ℃,5%CO2恒温箱中培养。
分别用不同浓度(1 μg/mL,5 μg/mL,10 μg/mL,15 μg/mL,20 μg/mL)的两种重组蛋白处理巨噬细胞,同时设空白对照组和LPS(100 ng/mL)组,通过CCK-8法检测细胞活力,确定合适的试验组蛋白浓度。
1.4 分组处理细胞 将J774A.1细胞按每孔 1×106个细胞接种于 6孔培养板中。待细胞贴壁后换液,根据试验目的两种重组蛋白(TsAdSPI和TsKaSPI)各分两个试验组:一组向J774A.1细胞中分别加入重组蛋白(5 μg/mL)提前作用24 h,直接加入LPS(100 ng/mL)刺激 12 h,设相同体积的 PBS 作为空白对照,LPS(100 ng/mL)刺激12 h为阳性对照组;另一组向J774A.1细胞中加入重组蛋白(5 μg/mL)单独作用 24 h,设相同体积的PBS 作为空白对照, LPS(100 ng/mL)为阳性对照组。
1.5 细胞总mRNA的提取和反转录 应用TRIZol法提取上述两种重组蛋白(TsAdSPI和TsKaSPI)处理的各组细胞的mRNA,测定RNA浓度和D值,RNA的D260/D280值应该处于1.8~2.1之间。利用各组mRNA分别进行反转录,以反转录产物为模板进行后续PCR扩增。
1.6 荧光定量PCR方法的建立
1.6.1 荧光定量扩增引物PCR引物设计 根据GenBank登陆的小鼠Gapdh(NM-008084.2),TNF-α(BC137720.1),IL-1β(NC_000068.6),IL-6(NM_031168.2),IL-10(NM_010548.2),IL-12(M86671.1)和TGF-β(M13177.1)基因序列,用Primer Premier 5.0和Oligo 6.0分析和设计引物,经BLAST验证引物特异性。Gapdh基因荧光定量上游引物5′- CCAGCCTCGTCCCGTAGACA-3′,下游引物5′- ATACTCAGCACCGGCCTCACCC-3′,扩增长度为298bp;TNF-α基因荧光定量上游引物5′-TCTTCTCATTCCTGCTTGTGG-3′,下游引物 5′- CACTTGGTGGTTTGCTACGA-3′,扩增长度为200 bp;IL-1β基因荧光定量上游引物5′- CCTCGTGCTGTCGGACCCATA-3′,下游引物5′- CAGGCTTGTGCTCTGCTTGTGA-3′,扩增长度为344 bp;IL-6基因荧光定量上游引物5′-CGGAGAGGAGACTTCACAGAG-3′,下游引物5′-ATTTCCACGATTTCCCAGAG-3′,扩增长度为104 bp;IL-10基因荧光定量上游引物5′-AATAAGAGCAAGGCAGTGGAG-3′,下游引物5′- TGTATGCTTCTATGCAGTTGATGA-3′,扩增长度为115 bp;IL-12基因荧光定量上游引物5′-AAAGGCTGGGTATCGG-3′,下游引物5′-CTGGCTGTGCTGGAAC-3′,扩增长度为117 bp;TGF-β基因荧光定量上游引物5′-ATTCCTGGCGTTACCTTGG- 3′,下游引物5′-AGCCCTGTATTCCGTCTCCT-3′,扩增长度为120 bp。以上所有引物均由上海英骏生物技术有限公司合成。
1.6.2 标准品质粒的构建 以所得cDNA为模板,用扩增引物通过PCR的方法扩增小鼠基因片段Gapdh、TNF-α、IL-1β、IL-6、IL-10、IL-12和TGF-β。目的片段产物经胶回收纯化,与pMD18-T载体16 ℃连接过夜,转化入大肠杆菌DH5α,进行质粒提取后,经PCR鉴定,利用紫外分光光度计测得质粒浓度,再根据质粒拷贝数换算公式计算出质粒拷贝数,用ddH2O进行倍比稀释,稀释成100~104共5个梯度,置于-20 ℃保存备用。
1.6.3 荧光定量PCR反应条件的优化 应用SYBR Green染料法,分别对Gapdh、TNF-α、IL-1β、IL-6、IL-10、IL-12和TGF-β荧光定量PCR反应过程中的反应时间及退火温度进行优化,所用反应条件为:95 ℃预变性10 s,95 ℃变性3 s,55 ℃~60 ℃退火20 s~30 s,进行反应40个循环。
1.6.4 标准曲线的建立 用稀释好的标准品为模板进行SYBR Green反应后,以其模板质粒标准品的浓度(lg)为X轴,以获得的Ct值作为Y轴绘制标准曲线。为排除引物二聚体及非特异性扩增产物对结果的影响,分别通过熔解曲线情况分析引物特异性,并计算扩增效率。
1.7 TsAdSPI和TsKaSPI各组相关基因mRNA表达水平的检测 根据步骤1.6已经建立的荧光定量检测体系,以步骤1.5获得的TsAdSPI和TsKaSPI各组反转录合成的cDNA为模板,按照优化后的反应体系,分别对各组样品中相关基因mRNA表达水平进行定量检测(每个样品均设置3个重复反应),得到检测样品的Ct值。根据绘制好的标准曲线代入各Ct值得到样品浓度值,用△△Ct法分别计算TsAdSPI和TsKaSPI各试验组TNF-α、IL-1β、IL-6、IL-10、IL-12和TGF-β基因mRNA的表达水平。
1.8 数据分析 应用ABI 7500 Fast,EXCEL,DNAMAN,GraphPad Prism 5软件对试验数据进行统计和分析。统计学上处理试验数据以均数±标准差(x±s)表示,同时采用GraphPad Prism 5软件进行f检验、方差分析与相关分析。
2 结果
2.1 两种重组蛋白的诱导表达及纯化 已构建的TsAdSPI和TsKaSPI表达载体经IPTG诱导表达后,通过SDS-PAGE检验诱导结果,经电洗脱后获得纯化后的两种蛋白TsAdSPI和TsKaSPI,SDS-PAGE检验目的条带单一,大小正确,如图1和图2所示。
2.2 CCK8检测两种重组蛋白对巨噬细胞活力的影响 结果显示,与PBS空白组相比,TsAdSPI和TsKaSPI对巨噬细胞活力均存在抑制作用,并呈现一定程度的剂量依赖性,差异显著(*P<0.05,**P<0.01),如图3和图4所示。浓度1~5 μg/mL并未造成影响,但浓度从10 μg/mL开始明显影响巨噬细胞增值活力。故本试验选用5 μg/mL作为以下试验工作浓度。
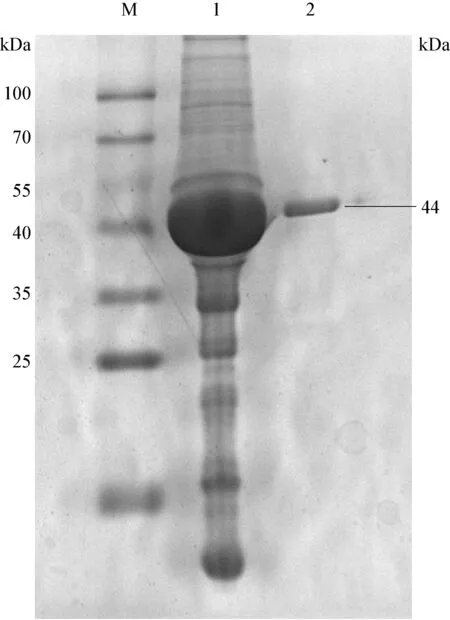
图1 重组蛋白TsAdSPI纯化结果分析

图2 重组蛋白TsKaSPI纯化结果分析

图4 TsKaSPI重组蛋白对巨噬细胞活力的影响
2.3 检测TNF-α、IL-1β、IL-6、IL-10、IL-12和TGF-β mRNA表达水平荧光定量PCR方法的建立
2.3.1 标准品目的片段的扩增与标准品构建 各标准品目的片段(Gapdh、TNF-α、IL-1β、IL-6、IL-10、IL-12和TGF-β)经PCR扩增,连接转化后,菌液由华大基因科技服务有限公司测序,测序结果用DNAMAN序列比对分析,与GenBank报道序列100%一致的菌液进行质粒提取,经质粒PCR与酶切鉴定目的片段与预期大小一致(图5)。并用紫外分光光度计检测质粒浓度。

图5 重组质粒的PCR及酶切鉴定
2.3.2 荧光定量PCR检测方法的建立 经条件优化后确定荧光定量PCR反应条件为:95 ℃预变性30 s,95 ℃变性5 s,退火温度60 ℃,退火时间34 s,反应40个循环。反应结果显示,Gapdh、TNF-α、IL-1β、IL-6、IL-10、IL-12和TGF-β的熔解曲线峰值单一,引物特异性良好。使用ABI 7500 Fast荧光定量PCR仪进行数据处理分析,绘制各目的基因的标准曲线,各标准曲线相关系数(R2)均在0.997~1之内,扩增效率都处于0.96~1.09之间,符合△△Ct法分析标准,可以使用△△Ct法进行分析。
2.4 TsAdSPI和TsKaSPI对巨噬细胞炎性细胞因子mRNA表达情况的影响
2.4.1 TsAdSPI和TsKaSPI对促炎性细胞因子TNF-α、IL-1β、IL-6和IL-12 mRNA表达的影响 通过SYBR Green I实时荧光定量PCR检测,J774A.1小鼠巨噬细胞经重组蛋白TsAdSPI和TsKaSPI预先作用24 h再加入LPS(100 ng/mL)刺激12 h 的处理组,与用LPS(100 ng/mL)单独刺激24 h的阳性组相比,重组蛋白TsAdSPI和TsKaSPI均可明显下调促炎性细胞因子TNF-α、IL-6、IL-1β和IL-12 mRNA 的表达(**P< 0.01,*P< 0.05),如图6和图7所示。其中,其中重组蛋白TsAdSPI对IL-1β mRNA表达的抑制作用最为明显。而重组蛋白TsKaSPI对IL-6 mRNA表达的下调作用最明显,差异极显著(**P< 0.01),对TNF-α和IL-12 mRNA表达的下调作用较弱,差异显著(*P< 0.05)。
2.4.2 TsAdSPI和TsKaSPI对抗炎性细胞因子IL-10和TGF-β mRNA表达的影响 如图8和图9所示,J774A.1小鼠巨噬细胞经重组蛋白TsAdSPI或TsKaSPI单独作用24 h,与经PBS作用的空白对照组相比,抗炎性细胞因子TGF-β和IL-10 mRNA的表达水平均被明显上调,差异极显著(**P< 0.01)。
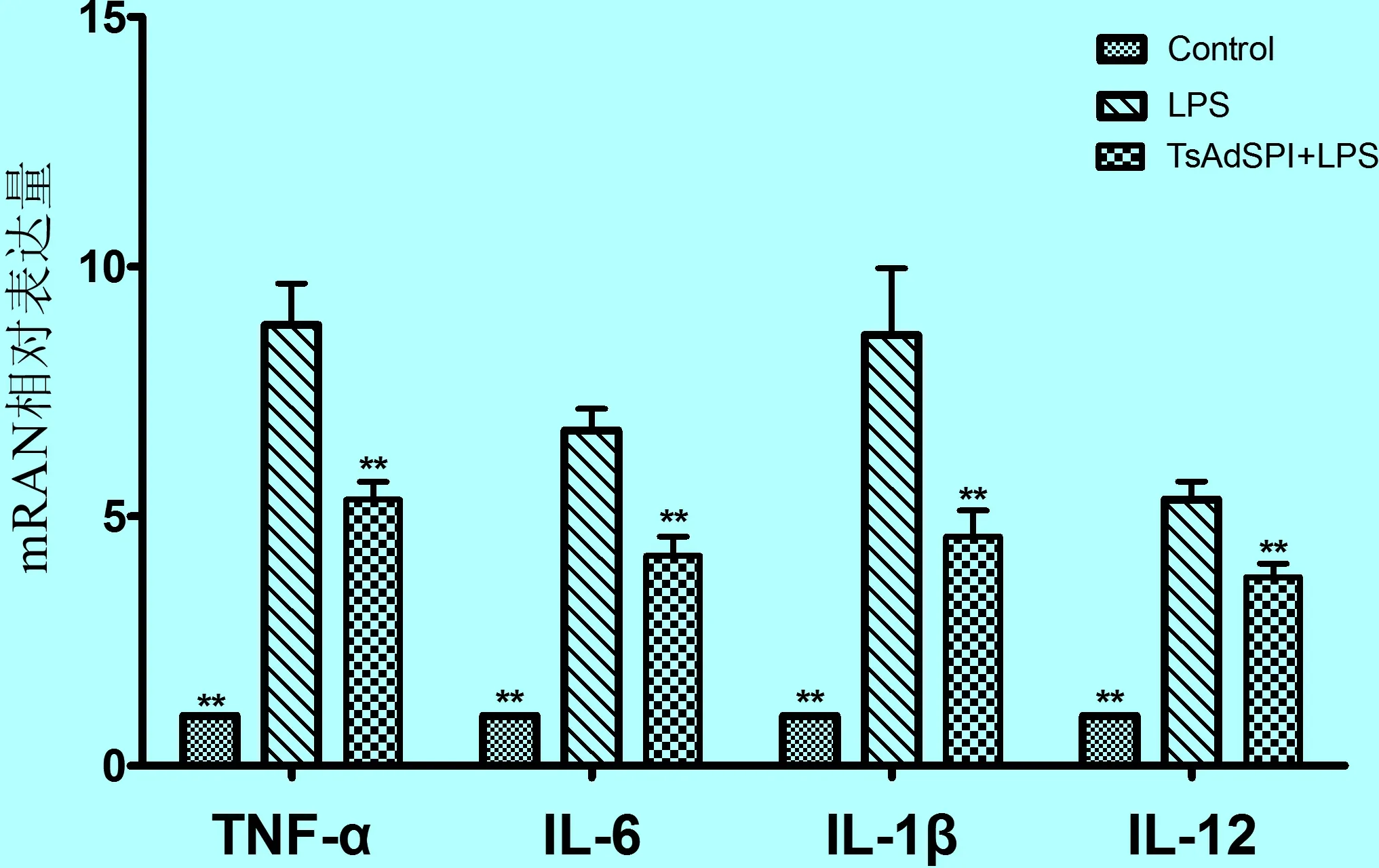
图6 TsAdSPI抑制促炎性细胞因子mRNA的表达

图7 TsKaSPI抑制促炎性细胞因子mRNA的表达

图8 TsAdSPI促进抗炎性细胞因子mRNA的表达
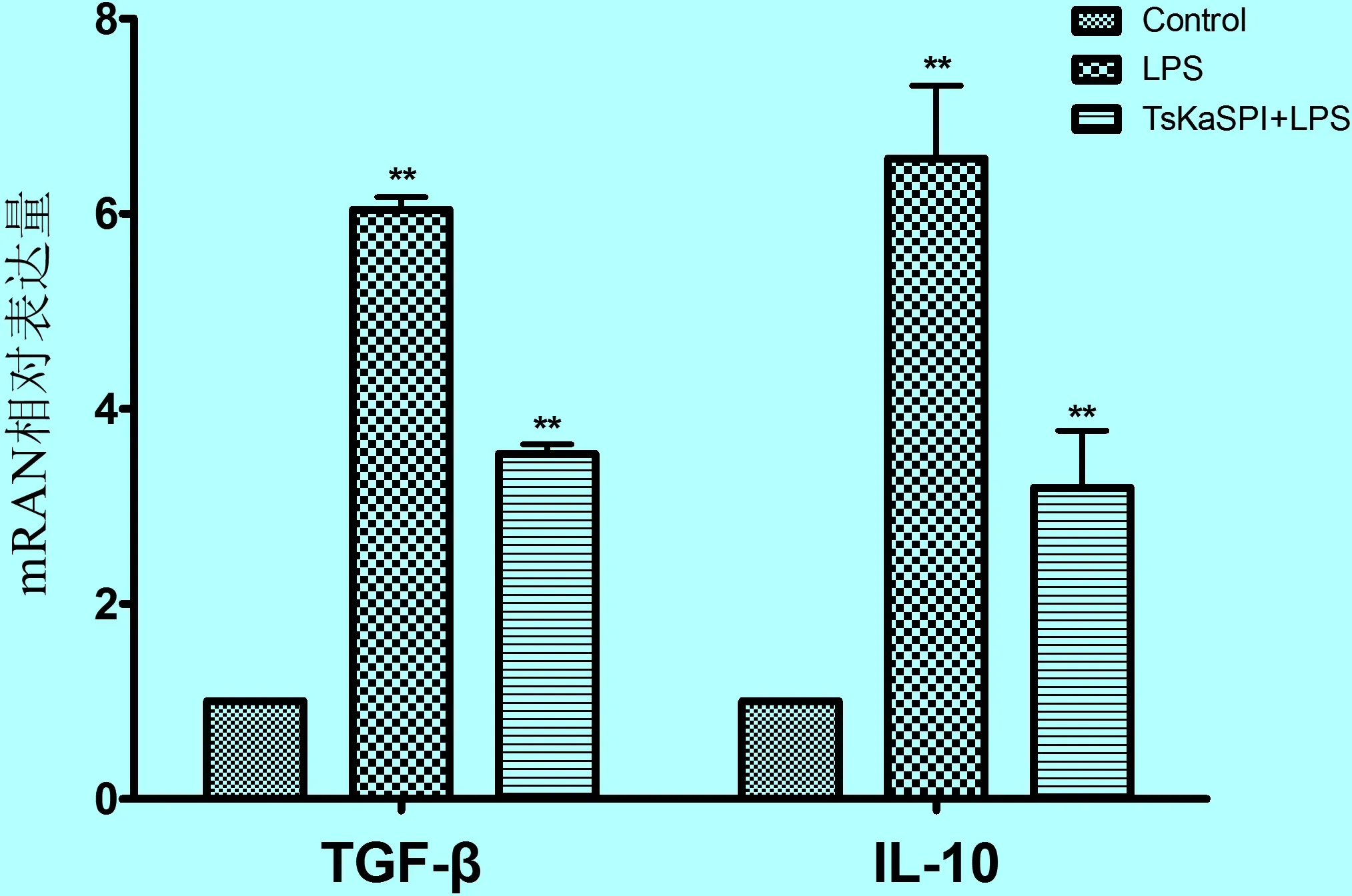
图9 TsKaSPI促进抗炎性细胞因子mRNA的表达
3 讨论
寄生虫产生的丝氨酸蛋白酶抑制剂在寄生虫感染宿主和寄生过程中影响宿主体内多种化学反应,同时调控宿主生理功能以利于其寄生和存活[8];并能在宿主体内引起免疫应答,为寄生虫在宿主体内生存、发育、移行和定居等过程提供有利条件[9-10]。关于旋毛虫入侵宿主时引发免疫逃避的研究还不够深入,近年来有少量涉及旋毛虫排泄分泌物调节巨噬细胞或树突状细胞免疫功能的研究,已经证明旋毛虫的分泌物中存在某些抗原,能够通过调节促炎性细胞因子和抗炎性细胞因子之间的动态平衡对巨噬细胞的免疫活性进行调控[7],并且能够诱导巨噬细胞向替代性活化表型转化,抑制T细胞增殖。
Goerdt S和Orfanos C E[11]的研究表明,在寄生虫等外来病原体入侵时,巨噬细胞会通过释放如促炎性细胞因子TNF-α、IL-6、IL-1β和IL-12及抗炎性细胞因子TGF-β和IL-10等免疫调控因子去影响机体炎症反应,并诱发相关免疫反应,以达到清除病原体的目的。王艳凤[12]的研究表明,伪旋毛虫丝氨酸蛋白酶抑制剂rTp-Serpin可以降低LPS活化后的巨噬细胞多种促炎性细胞因子mRNA的表达水平,也能够促进替代性活化的巨噬细胞表面标志物Arg1和抗炎性细胞因子TGF-β和IL-10m RNA的表达。研究结果揭示rTp-Serpin可参与逃避宿主免疫应答和排虫反应。本研究选用来源于雄性BALA/C小鼠网织细胞肉瘤的J774A.1细胞株进行了相关研究。研究发现,一定浓度的TsAdSPI和TsKaSPI均可对J774A.1的细胞活力产生影响;均能够不同程度的抑制经LPS刺激过的J774A.1小鼠巨噬细胞炎性细胞因子TNF-α、IL-1β、IL-6和IL-12的表达,同时单独作用J774A.1细胞均可明显促进巨噬细胞合成抗炎性细胞因子IL-10和TGF-β。与王艳凤的研究结果相一致。研究结果表明,TsAdSPI和TsKaSPI在旋毛虫侵入宿主肠道后可作为效应分子直接作用于宿主巨噬细胞,通过调节其炎性细胞因子的分泌改变局部免疫环境,进一步影响宿主免疫反应的正常进行和排虫反应的发生。研究TsAdSPI或TsKaSPI免疫调节功能,不仅可以为揭示旋毛虫感染的免疫逃避机制提供理论依据,更为旋毛虫疫苗的研发提供新方向。
参考文献:
[1] Betarbet R, Sherer T B, MacKenzie G,etal. Chronic systemic pesticide exposure reproduces features of Parkinson's disease[J]. Nature neuroscience, 2000,3(12):1 301-1 306.
[2] Ohnmacht C, Schwartz C, Panzer M,etal. Basophils orchestrate chronic allergic dermatitis and protective immunity against helminthes[J]. Immunity, 2010, 33(3):364-374.
[3] Stepek G, McCormack G, Page A P. The kunitz domain protein BLI-5 plays a functionally conserved role in cuticle formation in a diverse range of nematodes[J]. Molecular and biochemical parasitology, 2010, 169(1): 1-11.
[4] Pham C T. Neutrophil serine proteases fine-tune the inflammatory response[J]. The international journal of biochemistry & cell biology, 2008, 40(6): 1 317-1 333.
[5] Hewitson J P, Grainger J R, Maizels R M. Helminth immunoregulation: The role of parasite secreted proteins in modulating host immunity[J]. Mol Biochem Parasit, 2009, 167(1): 1-11.
[6] 叶冬表, 周诗其, 贺德昌, 等. 旋毛虫生活史新观察[J]. 湖北农业科学, 1995, 44(6): 74-78.
[7] 白雪. 旋毛虫排泄分泌物调节巨噬细胞及成肌细胞功能的体外研究[D].长春:吉林大学, 2011.
[8] Zang X X, Maizels R M. Serine proteinase inhibitors from nematodes and the arms race between host and pathogen [J]. Trends Biochem Sci,2001, 26(3): 191-197.
[9] Chandrashekar R, Ogunrinade A, Weil G. Use of recombinant Onchocerca volvulus antigens for diagnosis and surveillance of human onchocerciasis[J]. Tropical Medicine & International Health, 1996, 1(5): 575-580.
[10] Hong X, Mejia J S, Kumar S,etal. Cloning and expression of DiT33 from Dirofilaria immitis: a specific and early marker of heartworm infection [J]. Parasitology, 1996, 112(03): 331-338.
[11] Goerdt S,Orfanos C E. Other functions, other genes: alternative activation of antigen-presenting cells [J]. Immunity,1999,10 (2): 137-142.
[12] 王艳凤. 伪旋毛虫丝氨酸蛋白酶抑制剂在寄生虫免疫逃逸中的功能分析[D].长春:吉林大学, 2015.
