猪源水獭漫游球菌的鉴定与耐药性分析
2018-04-18朱天伦王果帅杨跃飞王彦红
朱天伦 , 王果帅 , 徐 磊 , 陶 娅 , 杨跃飞 , 王彦红
(1. 扬州大学兽医学院 , 江苏 扬州 225009 ;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心 , 江苏 扬州 225009)
2016年12月24日,从扬州大学动物医院收到的送检20日龄病死猪中分离得到1株疑似水獭漫游球菌的革兰阳性球菌,经分离鉴定,确认为水獭漫游球菌。由于水獭漫游球菌能引起人类感染,本研究对临床中采集到的水獭漫游球菌的药敏、生化等特性做了初步研究。
1 材料与方法
1.1 病料来源 2016年12月24日在扬州大学动物医院收到送检的20日龄病死猪。主诉:饲养170头,5日龄开始发病,皮肤发红,无拉稀,无呼吸道症状。病理变化为皮肤点状出血,内脏无明显病变。无菌采集病死猪皮肤以及心、肝、脾、肺、肾等组织脏器。
1.2 主要试剂 用市售的普通绵羊血和普通营养琼脂粉按常规方法配制成血琼脂平板,按常规方法配制的麦康凯琼脂平板;购自杭州天和微生物试剂有限公司的生化培养管和药敏试纸。
1.3 方法
1.3.1 细菌分离培养 采集病死猪的心、肝、脾、肺等组织器官,按常规无菌操作接种于血琼脂平板上,置37 ℃条件下培养24 h,挑选疑似单菌落分别在麦康凯培养基与绵羊血培养基上进行纯化培养。观察纯化菌的生长状况和形态特征。
1.3.2 16S rRNA 根据文献方法[1]制备细菌基因组RNA模板,按照16S rRNA Bacterial Identification PCR Kit方法操作,对其进行PCR扩增,经琼脂糖凝胶电泳进行鉴定,将目的片段切胶后送至金斯瑞生物科技公司进行测序。
1.3.3 生化试验 用接种针挑取纯化后的细菌单个菌落,分别接种于硫化氢、蔗糖、甘露醇、半乳糖、ONPG、山梨醇、木糖醇、尿素、硝酸盐还原、乙酰葡萄糖胺、甘露糖、麦芽糖、精氨酸、蜜二糖、乳糖、蕈糖、V-R、M.R.、木糖对照生化管内反应,置37 ℃条件培养24 h,按生化反应管说明书进行判断。
1.3.4 小鼠毒力试验 将培养于血琼脂平板上的细菌用生理盐水溶解后,采用腹腔注射的方式注射菌液,设置阴性对照组给小鼠腹腔注射生理盐水。24~48 h后观察小鼠状况并进行剖检。
1.3.5 药敏试验 采用Kirby-Bauer药敏纸片的方法,采用头孢曲松、氟苯尼考、美洛西林、多粘菌素B、多西环素、新霉素、丁胺卡那霉素、卡那霉素、庆大霉素、复方新诺明、链霉素、诺氟沙星、左氧氟沙星、环丙沙星和妥布霉素这15种药敏纸片,在无菌条件下,挑取纯化后的菌株,在绵羊血培养基涂布均匀,取药敏纸片贴于平板琼脂面上,37 ℃条件下培养24 h观察结果,测量出各抗生素纸片的抑菌圈直径。
2 结果
2.1 细菌分离 经分离纯化,从病死猪的心血分离出病料接种于血琼脂平板培养24 h后生长良好,形成光滑型菌落,在麦康凯琼脂培养基上不生长。
2.2 16S rRNA的PCR扩增及序列分析 分离菌的16S rRNA经PCR扩增后,出现500 bp左右的目的条带,将所测定的序列结果在NCBI网站上进行BLAST搜索比对,结果表明,所获得的序列与已公布的水獭漫游球菌(序列号:DQ395281)的同源性高达100%。
2.3 生化试验鉴定 细菌接种于微量生化反应管内,37 ℃培养24 h,鉴定结果符合水獭漫游球菌的生化特性。生化试验鉴定结果见表1。
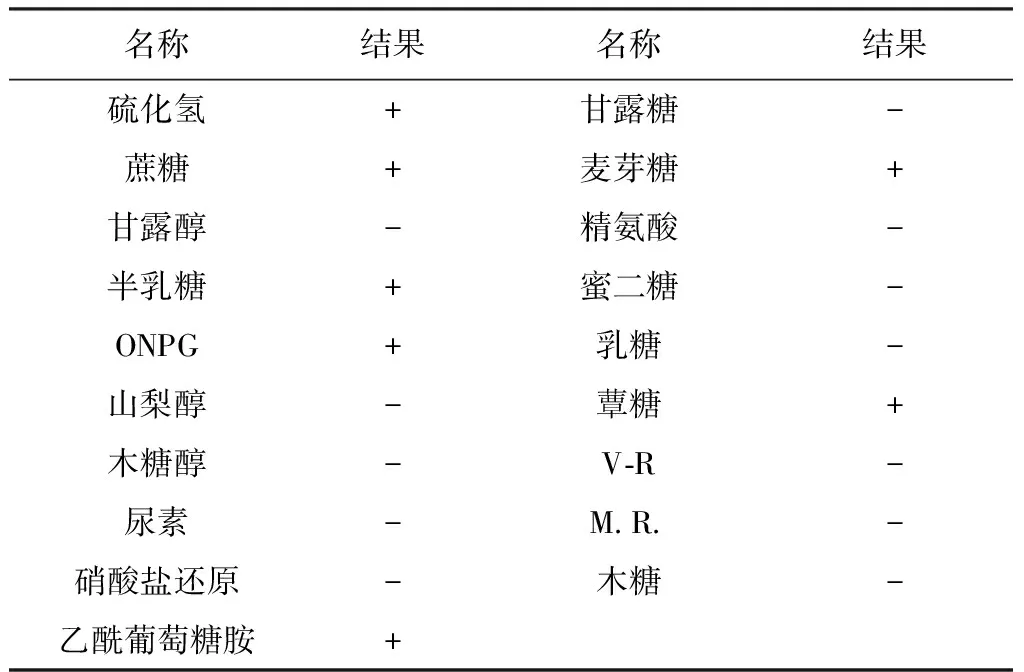
表1 分离菌的生化鉴定结果
注: 在糖发酵试验中,+表示产酸,-表示不产酸。在其他生化试验中,+表示阳性,-表示阴性
2.4 小鼠毒力试验结果 注射菌液48 h后,试验组小鼠精神状况良好。采用颈椎脱臼法处死小鼠,剖检,器官并无明显病变。无菌采取小鼠肝脏制触片,进行革兰染色,未观察到球菌。
2.5 药敏试验结果 药敏试验结果显示,分离株对美洛西林有较高的敏感性;对丁胺卡那霉素与多粘菌素B有较低敏感性;对头孢曲松、氟苯尼考、多西环素、新霉素、卡那霉素、庆大霉素、复方新诺明、链霉素、诺氟沙星、左氧氟沙星、环丙沙星和妥布霉素不敏感。
3 讨论
1989年Collins等报道了漫游球菌属,当时只发现了1个种,为河流漫游球菌[2],截止至2014年,共发现8个种[3]。文献[4]报道了在2005年前发现的5种漫游球菌,分别为1989年发现的河流漫游球菌[2](Vagococcusfluvialis),1990年发现的鲑鱼漫游球菌[5](Vagococcussalmoninarum),1999年发现的水獭漫游球菌[6](Vagococcuslutrae),2000发现的海豹漫游球菌[7](Vagococcusfessus)和2004年发现的嗜肉漫游球菌[8](Vagococcuscarniphilus),其余为Vagococcuselongatus[9](2007),Vagococcuspenaei[10](2009)和Vagococcusacidifermentans[11](2010)。水獭漫游球菌(Vagococcuslutrae)在1999年由Lawson等从普通水獭皮中分离而来[6]。2015年在法国马赛市发现一例由于水獭漫游球菌引起的人类感染,推测感染为食物介导,而此前水獭漫游球菌从未被报道为人类病原体[12]。
水獭漫游球菌是单个、成对或链状排列的革兰阳性球菌,无芽孢,无动力,兼性厌氧,触酶阴性[2]。水獭漫游球菌感染会引起严重的皮肤病变,2015年法国马赛市的水獭漫游球菌人类感染病例,发现时患病已卧床4月,皮肤损害严重,主要通过阿莫西林治疗感染,15日后痊愈。从以上人类感染的病例推测,感染源是由食物介导,由于卫生条件差,细菌跟随直接排放到床上的粪便一同排出,患者皮肤与之直接接触后感染[12],并非由于肠道直接吸收感染。本试验中分离到的水獭漫游球菌的来源是20日龄死亡的仔猪,从小鼠毒力试验结果来看,该菌毒性较弱,并未能引起小鼠死亡,甚至组织器官的明显病变。因此,推测该菌感染并非引起仔猪死亡的直接原因。
从药敏试验结果来看,水獭漫游球菌对美洛西林有较高敏感性。美洛西林属于青霉素类抗生素,同时上述人类感染病例治疗中使用的阿莫西林也属于青霉素类抗生素,由此可见,该菌对青霉素类抗生素有较高的敏感性,因此青霉素类抗生素可作为该菌感染治疗的首选药物。文献[11]中描述该菌对头孢曲松、庆大霉素、红霉素等一些广谱类抗生素均敏感,而本试验结果显示,该菌对广谱类及大多氨基糖苷类抗生素都有较强的耐药性,推测该菌在传播过程中已产生交叉耐药。因此在抗生素的选择使用中应严格遵守抗生素使用原则,避免细菌产生更强的耐药性。
参考文献:
[1] 邹宇靖,丁志国,李军朝,等. 鸭疫里默氏杆菌的分离与鉴定[J]. 黑龙江畜牧兽医,2016(12):114-115.
[2] Collins M D, Ash C, Farrow J A,etal. 16S ribosomal ribonucleic acid sequence analyses of lactococci and related taxa. Description of Vagococcus fluvialis gen. nov. sp. nov[J]. Journal of Applied Bacteriology, 1989, 67(4):453-460.
[3] Teixeira L M, Merquior V L C, Shewmaker P L. Vagococcus[J]. Encyclopedia of Food Microbiology, 2014, 138(2):673-679.
[4] 李仲兴,张新华,刘怀军. 漫游球菌的研究进展[J]. 国外医学.临床生物化学与检验学分册,2005(09):60-63.
[5] Wallbanks S, Martinezmurcia A J, Fryer J L,etal. 16S rRNA sequence determination for members of the genus Carnobacterium and related lactic acid bacteria and description of Vagococcus salmoninarum sp. nov.[J]. International Journal of Systematic Bacteriology, 1990, 40(3):224.
[6] Lawson P A, Foster G, Falsen E,etal. Vagococcus lutrae sp. nov. isolated from the common otter (Lutra lutra)[J]. International Journal of Systematic Bacteriology, 1999, 49(3):1 251-1 254.
[7] Hoyles L, Lawson P A, Foster G,etal. Vagococcus fessus sp. nov. isolated from a seal and a harbour porpoise.[J]. International Journal of Systematic & Evolutionary Microbiology, 2000, 50Pt3(3):1 151.
[8] Shewmaker P L, Steigerwalt A G, Morey R E,etal. Vagococcus carniphilus sp. nov. isolated from ground beef[J]. International Journal of Systematic & Evolutionary Microbiology, 2004, 54(5):1 505.
[9] Lawson P A, Falsen ECotta M A, Whitehead T R. Vagococcus elongatus sp. nov. isolated from a swine-manure storage pit.[J]. International Journal of Systematic & Evolutionary Microbiology, 2007, 57(4):751-754.
[10] Jaffrès E, Prévost H, Rossero A,etal. Vagococcus penaei sp. nov. isolated from spoilage microbiota of cooked shrimp (Penaeus vannamei).[J]. International Journal of Systematic & Evolutionary Microbiology, 2010, 60(9):2 159-2 164.
[11] Wang L, Cui Y S, Kwon C S,etal. Vagococcus acidifermentans sp. nov. isolated from an acidogenic fermentation bioreactor[J]. International Journal of Systematic & Evolutionary Microbiology, 2011, 61(5):1 123-1 126.
[12] Garcia V, Abat C, Rolain J M. Report of the first Vagococcus lutrae human infection, Marseille, France[J]. New Microbes & New Infections, 2016, 9(C):56-57.
